5-Aza-CdR促进小鼠海马神经细胞HT22自噬增加通过启动TSC1/mTOR通路
齐瑞芳,包素雅,邵 国
(1. 包头医学院低氧适应转化医学重点实验室,基础医学与法医学院,包头医学院神经科学研究所,内蒙古 包头 014060;2. 四川大学华西临床医学院,四川 成都 610041)
自噬是一个进化上保守的细胞过程,它可以通过溶酶体的降解来回收细胞成分[1-2]。它是维持应激状态下细胞存活所必需的新陈代谢的必要过程,包括饥饿、低氧等[3]。自噬的激活与否与肿瘤、神经退行性病变、心血管疾病、代谢性疾病、衰老、发育等息息相关,适度的自噬被认为是有益的。据报道自噬对大鼠大脑的各种损伤起保护作用[4]。 研究报道显示,自噬的上调可以保护神经元免受缺血性损伤[5]。自噬诱导剂可在鼠模型中保护神经元免受应激诱导的细胞死亡[6]。甲基化抑制剂5-杂氮脱氧胞嘧啶核苷(5-Aza-2′-deoxycytidine,5-Aza-CdR)可以诱导慢性粒细胞K-562 和MEG-01细胞自噬[7-8]。5-Aza-CdR能否在神经细胞中通过诱导自噬作用进行治疗与其相关的疾病的还需要进一步验证。
哺乳动物雷帕雷素靶蛋白(mammalian target of rapamycin,mTOR)信号通路在自噬的调节中起着至关重要的作用。结节性硬化复合物(tuberous sclerosis complex,TSC)是由TSC1(又称为hamartin)和TCS2(又称tuberin)形成异二聚体,其可以通过TSC2的小GTP酶激活蛋白(GTPase-activating protein,GAP)结构域而负调控mTOR信号传导[9]。本研究中,通过确定5-Aza-CdR能否对小鼠海马神经细胞HT22细胞产生自噬,可否通过TSC1/mTOR通路进行研究,从而为5-Aza-CdR能否作为自噬诱导剂提供更充足的理论依据。
1 材料与方法
1.1 细胞株HT22细胞购自北京协和细胞库。
1.2 试剂DMEM培养液购自美国Gibco公司;胎牛血清购自杭州四季青生物工程材料有限公司;胰蛋白酶、二甲基亚砜(dimethyl sulfoxide,DMSO)、抗生素(青霉素、链霉素等)购自美国Sigma公司;兔抗TSC1多克隆抗体(#4906)、mTOR(#2983),p-mTOR(Ser2448)(#5536),LC3A/B(#4108)购自美国CST公司,5-Aza-CdR(HL-151026)购自西安汇林生物科技有限公司,RIPA裂解液(P0013K)购自杭州碧云天生物技术公司,辣根过氧化物酶标记的驴抗兔IgG购自北京中杉金桥生物技术有限公司(ZB2305),Alexa FluorTM594山羊抗兔IgG(A32740)和DAPI(S36939)购自美国Invitrogen公司,ECL化学发光试剂购自北京普利来基因技术有限公司。
1.3 仪器NanoDrop 2000紫外分光光度计、Multiskan FC型全自动酶标仪购自美国Thermo Fisher公司,荧光定量PCR仪7900HT购自美国ABI公司,垂直电泳槽、蛋白电泳仪购自美国Bio-Rad公司,化学发光仪天能5800购自上海天能科技有限公司,Nikon A1实时全光谱激光共聚焦显微镜购自日本Nikon公司。
1.4 细胞培养和分组小鼠海马神经细胞HT22培养于含10%(体积分数)胎牛血清的DMEM培养液中,37 ℃,5%(体积分数)CO2条件下培养,将细胞分为对照组和5-Aza-CdR组。
1.5 5-Aza-CdR处理细胞5-Aza-CdR粉末使用DMSO溶解,制成浓度为100 mmol·L-1的母液。使用时用PBS或培养基稀释5-Aza-CdR为浓度1 mmol·L-1,在长至0.6~0.7的HT22细胞中,与诱导剂一起加至培养基中,使其终浓度为1、5、10 μmol·L-1。培养24 h后常规收集细胞,样品冻于-80 ℃备用。
1.6 MTS检测细胞活力选取生长状态良好的HT22细胞,将其种于96孔板中,每孔1×103个细胞,每孔加入100 μL完全培养基常规培养24 h。24 h后,加入诱导剂诱导分化TH22细胞,每个分组重复6个复孔,设立一个空白孔,只加入100 μL的完全培养基,作为空白对照。培养24 h后取出,每孔加入20 μL的MTS,放入37 ℃培养箱中孵育150 min,取出后使用酶标仪490 nm处检测OD值。
1.7 Real time RT-PCR将HT22细胞,待测组织冻于-80 ℃备用。使用时在冰上融化,每只小鼠的海马作为一组样品加入1 mL TRIzol常规提取各组RNA,测定RNA浓度。每组样品各取1 μg,利用反转录试剂盒进行反转录反应生成cDNA。从每组反转录产物中各取1 μL,利用SYBR GreenⅠ试剂盒进行real time PCR 扩增,PCR反应条件:95 ℃ 3 min;95 ℃ 30 s;60 ℃ 45 s,72 ℃30 s,共40个循环。根据所得各组的CT值,利用2-ΔΔCT计算mRNA相对表达量[10],实验重复3次。
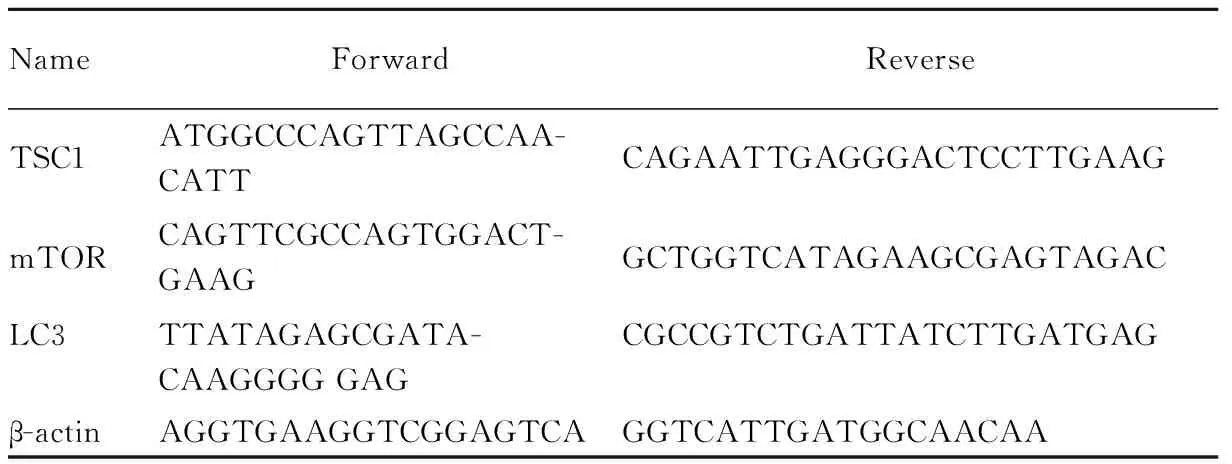
Tab 1 Primer sequences
1.8 Western blot将小鼠海马分离后,待测组织冻于-80 ℃。使用时冰上融化,每只小鼠海马样品中加入300 μL的RIPA裂解液,加入蛋白酶抑制剂和磷酸蛋白酶抑制剂,超声辅助裂解,BCA法测定蛋白浓度。电泳时蛋白上样量为30 μg,条件恒流15 mA, 接着恒流400 mA转膜过夜,将蛋白转移到PVDF膜。室温,50 g·L-1脱脂奶粉封闭1 h,TTBS 洗膜3次,每次10 min,一抗(1 ∶1 000)4 ℃孵育过夜,TTBS 洗膜3次, 每次10 min,HRP标记的驴抗兔二抗(1 ∶1 000)室温孵育1 h,TTBS 洗膜3次,每次10 min,ECL发光。
1.9 免疫组织荧光染色将24孔板每个孔中分别放入多聚赖氨酸处理的圆形盖玻片,将HT22细胞接种于孔板中,每孔2.5×103个细胞。培养24 h后进行诱导和10 μmol·L-15-Aza-CdR处理,24 h后小心弃掉培养基,用PBS洗3遍,加入40 g·L-1的多聚甲醛4 ℃固定过夜;d 2轻轻吸出多聚甲醛, PBS清洗3次,每次5 min;用2 g·L-1Triton X-100通透,室温下孵育5 min;弃掉通透液,PBS清洗3次,每次5 min;用60 g·L-1BSA室温封闭30 min;弃掉封闭液,用PBS清洗3次,每次5 min;用10 g·L-1BSA 1 ∶300稀释一抗,4 ℃孵育过夜;次日取出孔板,复温孵育1 h后用BSA-PBS洗涤3次。加入荧光二抗避光室温孵育4 h;用BSA-PBS洗涤2次,再用去离子水洗1次,浸泡在去离子水中;取出盖玻片将有细胞的一面反过来小心扣在滴加DAPI的载玻片上,用指甲油封片。-20 ℃保存,尽快使用激光共聚焦进行扫描和分析荧光强度。
1.10 质粒构建和DNA转染TSC1-pcDNA3质粒由Nellist博士友情提供[11]。然后,将TSC1亚克隆到EGFP载体中。使用NeroTMTransfection进行TSC1-EGFP质粒转染HT22细胞,使TSC1过表达,将细胞接种于35 mm培养皿中。转染后,将细胞孵育48 h,然后收集。

2 结果
2.1 5-Aza-CdR降低HT22细胞的活力用0(作为对照),1、5或10 μmol·L-1,5-Aza-CdR处理HT22细胞。结果显示,10 μmol·L-1的5-Aza-CdR与对照组相比,可以明显降低HT22细胞的活力(P<0.01,见Fig 1)。
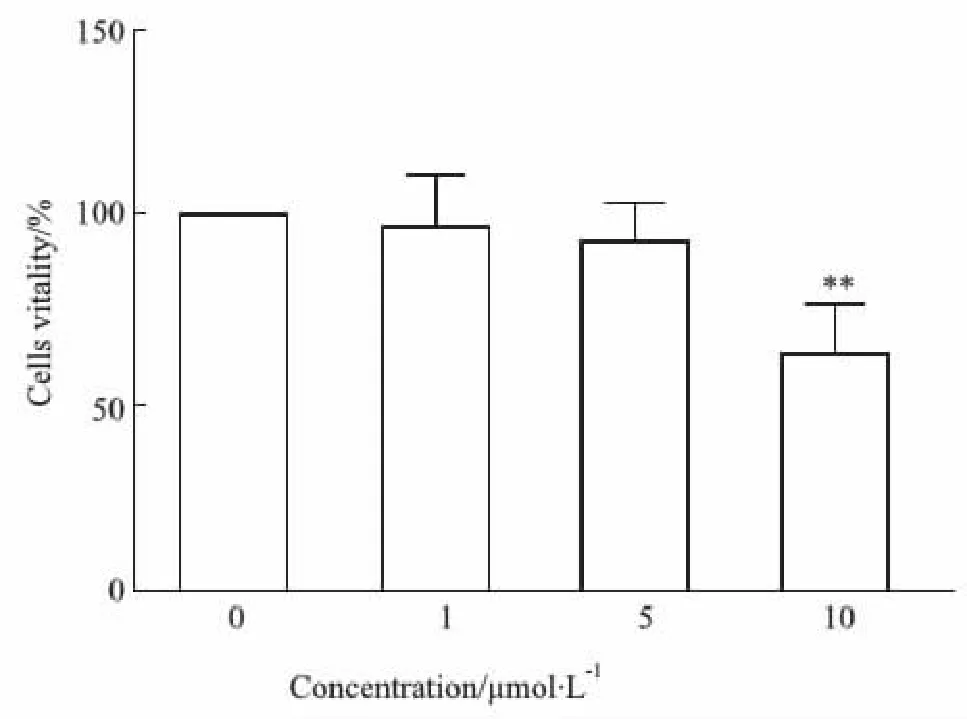
Fig 1 Effect of 5-Aza-CdR on cell vitality **P<0.01 vs control
2.2 5-Aza-CdR促进TSC1 mRNA的表达Real time RT-PCR的结果显示10 μmol·L-1的5-Aza-CR显着增加了TSC1 mRNA(P<0.01),差异具有统计学意义。而mTOR和LC3 mRNA在这些浓度下,均未产生任何明显变化(Fig 2)。结果提示5-Aza-CdR在mRNA水平上对TSC1可产生影响,而对mTOR和LC3 mRNA的影响没有统计学意义。
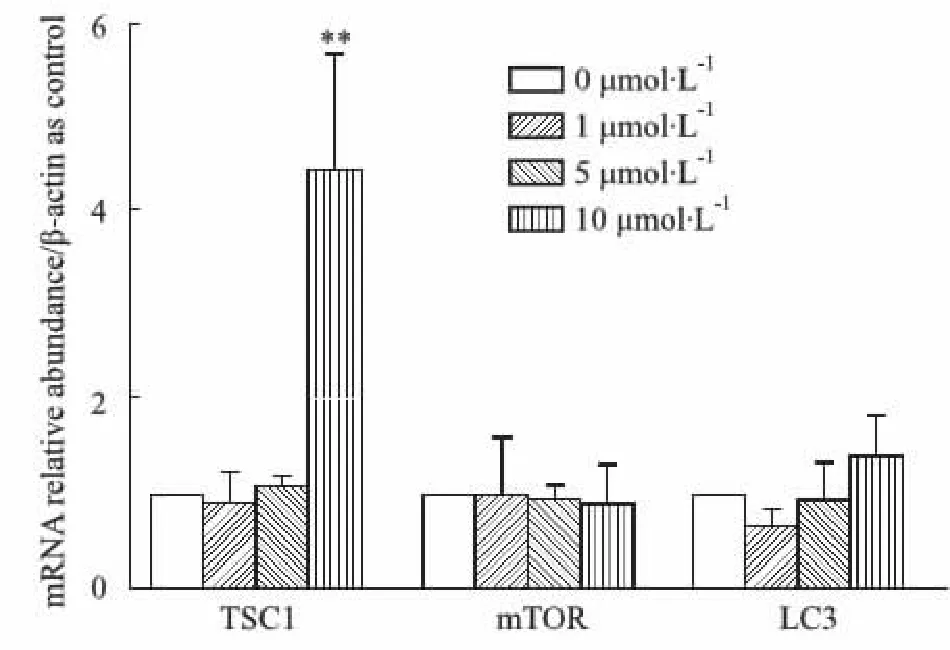
Fig 2 Expression of TSC1, mTOR, LC3 mRNA in HT22 cells **P<0.01 vs control
2.3 5-Aza-CdR可增加TSC1蛋白的表达,降低p-mTOR的表达,增加LC3-Ⅱ/LC3-Ⅰ的比例根据Westren blot的结果显示,10 μmol·L-15-Aza-CdR可增加TSC1蛋白(P<0.01),具有统计学意义;mTOR蛋白表达则不受5-Aza-CdR的影响,而p-mTOR的表达降低(P<0.01)。但是在用5 μmol·L-15-Aza-CdR(P<0.05)和10 μmol·L-1(P<0.01)处理的样品中,LC3-Ⅱ/LC3-Ⅰ的比例增加了(Fig 3)。结果提示5-Aza-CdR可以促进HT22细胞的自噬,并且TSC1/mTOR通路参与其中。
2.4 5-Aza-CdR增强小鼠海马中TSC1蛋白的荧光强度为了进一步检测5-Aza-CdR在形态学对TSC1蛋白的影响,本研究选取有效浓度10 μmol·L-1进行细胞免疫荧光染色,检测TSC1表达水平及其定位(Fig 4)。结果显示,5-Aza-CdR组相比对照组TSC1的荧光强度增强,其表达主要集中在细胞浆中,从形态学上进一步证明5-Aza-CdR促进TSC1蛋白的表达,结果与Western blot一致。

Fig 3 Protein expression of TSC1, mTOR, p-mTOR, LC3 in HT22 cells exposed to 5-Aza-CdR n=6)*P<0.05, **P<0.01 vs control

Fig 4 Immunofluorescence of TSC1 protein in HT22 cells exposed to 5-Aza-CdR(Bar=50 μm)
2.5 过表达TSC1抑制p-mTOR,促进LC3-Ⅱ/LC3-Ⅰ的比例增加为了进一步证明TSC1在此过程中起关键性作用,本研究进行TSC1质粒转染,使其过表达,发现TSC1过表达后,mTOR和p-mTOR蛋白表达降低(P<0.05), LC3-Ⅱ的表达增加(Fig 5)。
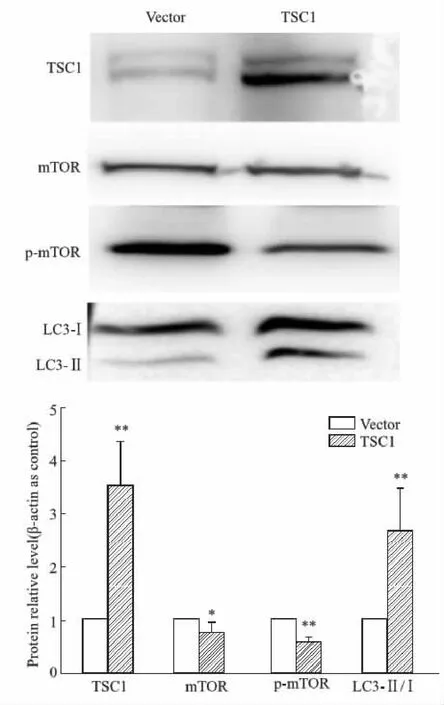
Fig 5 Effect of TSC1 over-expression on protein expression of mTOR, p-mTOR and LC3 in HT22 cells n=6)*P<0.05, **P<0.01 vs control
3 讨论
在本研究中,通过体外培养小鼠海马神经细胞HT22检测自噬标记物LC3作为自噬的标记物,通过LC3-Ⅱ/LC3-Ⅰ的比例衡量细胞自噬水平。本研究发现5-Aza-CdR可通过诱导自噬增加,在此过程中有TSC1/mTOR通路的参与其中。有研究报道5-Aza-CdR可以诱导人慢性粒细胞自噬[7-8]。因此,推测5-Aza-CdR有可能作为自噬诱导剂而在疾病中发挥作用。考虑到自噬在脑外伤、脑缺血、衰老等过程中起着重要作用[2,12],探讨5-Aza-CdR对神经元细胞自噬的作用可能具有一定的意义。
为了进一步研究5-Aza-CdR对神经细胞的作用机制。本研究观察了其对TSC1/mTOR通路的研究。TOR是自噬的主要调节机制之一,那么5-Aza-CdR是否通过此通路发挥作用,鲜有报道。 mTOR是丝氨酸/苏氨酸激酶,是磷脂酰肌醇3-激酶(phosphatidylinositide 3-kinases, PI3K)相关激酶家族的成员,是细胞生长,细胞增殖,凋亡和自噬的重要的调节因子[13]。当mTOR的活性降低时,将诱导自噬。 Kim等[14]报道,自噬增强剂诃子鞣酸通过抑制mTOR活性对神经元细胞具有神经保护作用。与Kim等的结果类似,本研究发现5-Aza-CdR诱导自噬的同时,不会改变mTOR的表达,对p-mTOR(Ser2448)的磷酸化水平被抑制的。TSC1/2在激活mTOR中起关键作用。TSC复合物可通过充当GAP来负调控mTOR信号传导[9]。当诱导TSC1时,在鼠神经原虫/脊髓混合细胞(NSC-34细胞)中伴随mTORC1失活[15]。相反,在缺失TSC1的动物模型中,mTOR信号增加了[16]。本研究中5-Aza-CdR增强了mTOR上游的TSC1表达。因此,推测5-Aza-CdR通过调节TSC1启动子DNA甲基化状态使TSC1增加,从而下调了mTOR活性,致自噬增加。为了证明这些分子之间的关系,本研究使TSC1在HT22细胞中过表达,结果显示mTOR活性下调而自噬上调。
总之,本研究表明,5-Aza-CdR 增加HT22细胞自噬并且TSC1/mTOR通路参与其中,为5-Aza-CdR可能是神经元自噬的诱导剂增加理论依据,但其作用的机制还需要进一步研究。

