胃底腺息肉和胃增生性息肉患者胃液中胃肠激素的变化 *
常丽丽,高 鹤,王利民,李光跃,王 莉,张淑梅,张 静,杨慧君
河北省石家庄市第一医院消化内科,河北石家庄 050011
胃底腺息肉和胃增生性息肉是胃镜下检出最多的胃息肉类型,其发病机制尚不明确。胃液微环境的变化可能与胃底腺息肉和胃增生性息肉的发生关系密切。胃液是由胃壁黏膜各种细胞分泌物组成的透明酸性液体,其成分包括无机物(如盐酸、钾、钠、碳酸氢盐等)、有机物[如胃蛋白酶原、内因子、黏蛋白(MUC)、胃泌素、前列腺素、表皮生长因子(EGF)等]。当十二指肠液反流入胃,胃液中可混杂胆汁酸、胰蛋白酶、脂肪酶等成分。胃息肉患者胃液中哪些成分发生了变化,尚缺乏全面系统的研究。笔者通过观察胃底腺息肉和胃增生性息肉患者胃液中胃蛋白酶原Ⅰ(PGⅠ)、胃蛋白酶原Ⅱ(PGⅡ)、胃泌素-17、前列腺素E2(PGE2)、EGF、MUC2和MUC5AC水平的变化,探讨胃液微环境中胃肠激素的变化与胃底腺息肉和胃增生性息肉形成的关系,现报道如下。
1 资料与方法
1.1一般资料 选择2014年1月1日至2018年2月10日于本院进行胃镜检查,发现胃底腺息肉或胃增生性息肉的患者。纳入标准:经病理学诊断确诊为胃底腺息肉或胃增生性息肉;年龄20~80岁。排除标准:伴内分泌疾病、胃溃疡、胃肠多发性息肉患者;近7 d内服用抑制胃酸分泌和中和胃酸药物的患者。最终纳入胃底腺息肉患者124例(胃底腺息肉组)和胃增生性息肉患者124例(胃增生性息肉组)。选择同期健康体检人群中胃镜检查阴性者124例纳入对照组。胃底腺息肉组男62例、女62例,平均年龄(50.12±29.94)岁;胃增生性息肉组男62例、女62例,平均年龄(49.89±30.18)岁;对照组男62例、女62例,平均年龄(51.09±29.47)岁。3组性别、年龄比较,差异无统计学意义(P>0.05),具有可比性。本研究通过本院伦理委员会审核批准,所有胃镜检查患者均签署知情同意书。
1.2仪器与试剂 DG5031酶联免疫检测仪由上海京工实业有限公司生产。胃泌素-17、EGF、PGE2、PGⅠ、PGⅡ、MUC2、MUC5AC试剂盒由河北博海生物工程开发有限公司提供。
1.3方法 取胃底腺息肉组、胃增生性息肉组患者息肉组织送病理检查,并抽取各组研究对象胃液10 mL密封,-20 ℃冰箱冻存。胃液标本自然解冻,3 500 r/min离心10 min后取上清液。采用DG5031酶联免疫检测仪及相关试剂检测胃泌素-17、EGF、PGE2、PGⅠ、PGⅡ、MUC2、MUC5AC水平。
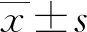
2 结 果
2.13组胃液中胃泌素-17、PGⅠ和PGⅡ检测结果比较 胃底腺息肉组和胃增生性息肉组胃泌素-17水平均高于对照组(P<0.05)。胃底腺息肉组胃泌素-17水平低于胃增生性息肉组(P<0.05)。3组间PGⅠ水平比较,差异无统计学意义(P>0.05)。胃底腺息肉组和胃增生性息肉组PGⅡ水平均高于对照组(P<0.05)。胃底腺息肉组PGⅡ水平高于胃增生性息肉组(P<0.05)。见表1。

表1 3组胃液中胃泌素-17、PGⅠ和PGⅡ检测结果比较
2.23组胃液中EGF、PGE2、MUC2、MUC5AC检测结果比较 胃底腺息肉组和胃增生性息肉组胃液中EGF水平高于对照组(P<0.05),胃底腺息肉组和胃增生性息肉组EGF水平差异无统计学意义(P>0.05)。胃底腺息肉组和胃增生性息肉组PGE2水平均低于对照组(P<0.05)。胃底腺息肉组PGE2水平低于胃增生性息肉组(P<0.05)。胃底腺息肉组和胃增生性息肉组胃液中MUC2水平高于对照组(P<0.05),MUC5AC水平低于对照组(P<0.05)。胃底腺息肉组和胃增生性息肉组MUC2和MUC5AC水平差异无统计学意义(P>0.05)。见表2。

表2 3组胃液中EGF、PGE2、MUC2、MUC5AC检测结果比较
3 讨 论
大量研究报道,质子泵抑制剂(PPI)应用、胆汁反流、幽门螺杆菌(Hp)感染均在胃底腺息肉和胃增生性息肉的发生、发展过程中起着重要的作用[1-4]。Hp感染、胆汁反流或服用PPI,可导致高胃泌素血症,使胃内腺体增生,息肉形成[2,5-6]。高胃泌素水平可能是胃息肉形成的中间环节或关键因素[5]。
胃泌素是胃液中存在的多肽激素,其中最具生物活性、作用最为广泛的是胃泌素-17。正常情况下,胃泌素主要以血清胃泌素形式存在,通过内分泌方式发挥生理作用。异常状态时,胃泌素以自分泌或内分泌或自分泌与内分泌协同作用的方式,导致胃肠黏膜病变发生,如胃癌、胃息肉、结肠癌等[5-6]。有研究发现,无论是胃底腺息肉还是胃增生性息肉,血液中均存在高胃泌素血症,该研究认为血清胃泌素水平升高,可与靶细胞胃泌素受体结合,通过内分泌方式,刺激腺体和黏膜上皮过度生长,促使息肉形成[6]。
本研究排除了PPI应用的影响,结果显示,胃增生性息肉组和胃底腺息肉组患者胃液中胃泌素-17水平均明显高于对照组。这表明胃增生性息肉、胃底腺息肉的形成与胃液的高胃泌素水平关系密切,胃泌素可能通过自分泌的方式,直接与靶细胞胃泌素受体结合,刺激胃黏膜及腺体,促进胃息肉的形成。
胃液中除了胃泌素外,还存在前列腺素、EGF、MUC等。PGE2是胃黏膜的保护因子,促进胃黏膜上皮细胞核酸及蛋白质合成,有助于胃黏膜上皮细胞的快速修复和维持其完整性。此外,PGE2是一种常见的免疫调节因子。多种肿瘤细胞均能使PGE2水平增加。而血清PGE2水平过高,会严重影响机体免疫平衡,导致肿瘤细胞增殖、迁移。陈璐等[7]研究发现,正常胃黏膜中PGE2水平显著高于萎缩性胃炎胃黏膜中PGE2水平。张杨等[8]研究报道,胃肠道恶性肿瘤患者血清PGE2水平明显升高。而胃息肉患者胃液PGE2水平的研究鲜有报道。笔者研究显示,胃底腺息肉和胃增生性息肉患者胃液PGE2水平均明显下降,以胃底腺息肉患者更明显。这提示PGE2缺乏与胃底腺息肉和胃增生性息肉形成有关。
EGF对多种组织细胞有强烈的促分裂作用,微量即能强烈刺激细胞生长,与创伤的愈合、细胞的增殖分化及肿瘤的发生均有密切关系。王凯斌等[9]报道,EGF在食管癌中表达过量,与疾病的发生、发展关系密切。王纪传等[10]报道,EGF、表皮生长因子受体在肝癌患者的肝癌组织中呈高表达,且其表达水平与肝癌患者的淋巴结转移和TNM分期密切相关。李嫄嫄等[11]研究结果发现,胃息肉组患者的血清EGF水平高于对照组,认为EGF水平升高可能是胃息肉发生的高危因素。笔者研究发现,胃底腺息肉与胃增生性息肉患者胃液中EGF水平明显高于对照者(P<0.05),说明胃液中EGF水平增高与胃底腺息肉和胃增生性息肉形成均有密切关系,与息肉的病理类型无明显相关性。
MUC在上皮更新与分化、维持上皮完整性和肿瘤的发生与转移等方面都起到了重要作用。正常情况下,胃液中含MUC1、MUC6、MUC5AC,不含MUC2。笔者研究发现,对照组胃液中MUC2水平为0,而胃底腺息肉组与胃增生性息肉组患者胃液中MUC2水平明显升高,MUC5AC水平明显降低。这说明MUC2和MUC5AC参与了胃增生性息肉和胃底腺息肉的形成,与息肉的病理类型无关。
关于胃蛋白酶原与胃息肉的关系,有少数报道,且结论不一:徐华等[12]的研究结果显示,胃炎性息肉、增生性息肉及腺瘤性息肉患者血清PGⅠ和PGⅡ水平与对照组比较,均明显降低;王梦兰等[6]研究报道,胃增生性息肉组血PGⅡ水平高于浅表性胃炎组,胃底腺息肉组血清PGⅠ、PGⅡ水平高于浅表性胃炎组,且Hp阳性的胃增生性息肉患者血清PGⅡ水平明显高于HP阴性患者,认为胃底腺息肉及胃增生性息肉均伴明显炎症。本研究结果显示,胃底腺息肉组和胃增生性息肉组患者胃液中PGⅠ水平与对照组比较,差异无统计学意义(P>0.05),而PGⅡ水平明显高于对照组(P<0.05)。与之前研究的结论存在差异的原因:可能与入选胃息肉患者是否存在Hp感染、胆汁反流、PPI应用或息肉同时伴肠上皮化生、异型增生等有关。息肉的产生可能是在炎症基础上发生的,也可能是在非炎症刺激因子基础上发生的。或许PGⅡ水平变化不是胃息肉产生的原因,只是胃息肉伴炎性浸润、肠化生或异型增生的结果。
综上所述,胃底腺息肉和胃增生性息肉患者存在胃肠激素分泌紊乱,胃液中胃泌素-17、EGF、MUC2水平升高,PGE2和MUC5AC水平降低。这可能是导致胃底腺息肉和胃增生性息肉形成的关键因素,其确切发病机制尚需进一步研究。

