lncRNA UG0898H09对前列腺癌细胞的增殖和迁移的影响
何 岩,吴春磊,李泽宇,宋伟航,李建昌,窦启锋
前列腺癌起源于前列腺上皮细胞,是男性泌尿生殖系统常见的一种恶性肿瘤,在西方国家男性恶性肿瘤中其发病率占首位,在我国男性恶性肿瘤中的发病率呈逐年增加趋势[1]。探讨前列腺癌发生、发展的相关机制,已成为前列腺癌防治研究的热点。长链非编码RNA(long-chain non-coding RNA, lncRNA)是一类缺乏开放阅读框的单链RNA分子,由于不能编码蛋白,lncRNA一直被认为不具有生物学功能[2]。近年来研究证实,大量lncRNA在多种肿瘤中表达异常,通过影响肿瘤细胞的增殖、分化、凋亡、血管形成、化疗耐药、放疗敏感性等生物学行为,参与肿瘤的发生、发展[3-4]。随着对lncRNA的研究,其在前列腺癌细胞中的作用逐渐被明确,有望成为前列腺癌早期诊断的标志物和治疗靶点[5]。UG0898H09是一种新发现的lncRNA,其在肿瘤中的作用机制尚未见文献报道。本实验旨在检测前列腺癌组织及细胞株中UG0898H09的表达,明确UG0898H09与前列腺癌发生、发展的相关性,观察上调UG0898H09对前列腺癌细胞增殖和迁移的影响,初步探讨UG0898H09在前列腺癌细胞中的作用机制。
1 材料与方法
1.1 材料选取2018年2月~2019年10月新乡医学院第一附属医院泌尿外科存档的手术切除前列腺癌组织和对应癌旁组织53例,术后标本均由本院病理科资深医师确诊,于液氮中冷冻保存。本研究经医院伦理委员会批准,,患者均签署知情同意书。人前列腺癌细胞株(PC-3、C4-2B、LNCaP、PC-3M和DU-145)及正常前列腺上皮细胞(RWPE-1)购于美国ATCC公司;表达UG0898H09的质粒、阴性对照质粒和PCR引物购于广州瑞博生物公司;Lipofectamine 2000转染试剂盒和Trizol试剂盒购于美国Invitrogen公司;荧光定量PCR试剂盒、反转录试剂盒和WST-1细胞增殖试剂盒购自美国Sigma公司;RPMI 1640培养基、KSFM培养基和胎牛血清购于美国HyClone公司;一抗α-Tubulin、KLF4、Cyclin H、CDK7、N-cadherin和ZEB-1均购于美国CST公司。
1.2 细胞培养和转染正常前列腺上皮细胞(RWPE-1)培养在含10%胎牛血清的KSFM培养基中,前列腺癌细胞株(PC-3、C4-2B、LNCaP、PC-3M和DU-145)培养在含10%胎牛血清的RPMI 1640培养基中,在37 ℃、5%CO2饱和湿度的培养箱中培养。LNCaP细胞胰酶消化传代后,按2×105个/孔接种于6孔板,按照随机数字法分为阴性对照组和UG0898H09组。根据Lipofectamine 2000转染试剂盒说明书分别转染阴性对照质粒(阴性对照组)和表达UG0898H09的质粒(UG0898H09组)。
1.3 qRT-PCR法使用Trizol试剂盒提取组织和细胞中总RNA,反转录试剂盒反转录为cDNA,荧光定量PCR试剂盒进行qRT-PCR反应。以GAPDH为内参比较UG0898H09和KLF4 mRNA的表达,以U6为内参比较miR-511-5p的表达。UG0898H09引物序列:上游5′-GCAGCTGCAGAAAGACACCT-3′,下游5′-ATGCTCAGACCCAAGCAGAG-3′。GAPDH引物序列:上游5′-TCCCATCACCATCTTCCA-3′,下游5′-CATCACGCCACAGTTTCC-3′。miR-511-5p引物序列:上游5′-CACTCAGCCTTGAGGGC-3′,下游5′-CAGTGCGTGTCGTGGAGT-3′。KLF4引物序列:上游5′-CAGCTTCACCTATCCGATCCG-3′,下游5′- GACTCCCTGCCATAGAGGAGG-3′。qRT-PCR条件为95 ℃预变性60 s,95 ℃ 40 s、60 ℃ 30 s、72 ℃ 20 s,连续进行40个循环。UG0898H09、miR-511-5p和KLF4 mRNA相对表达量以2-ΔΔCt表示。每组均设置4个平行反应复孔。
1.4 WST-1法检测细胞增殖能力收集转染48 h的两组LNCaP细胞,重悬细胞后以4×103个/孔接种于96孔板,分别于培养第1、2、3、4、5天采用WST-1细胞增殖试剂盒检测细胞增殖能力。检测时,每孔加入WST-1试剂,培养箱内孵育4 h,酶标仪检测每孔波长450 nm处的吸光度(OD)值,绘制细胞生长曲线。每组均设置4个平行反应复孔。
1.5 细胞划痕实验检测细胞迁移能力收集转染48 h的两组LNCaP细胞,无血清培养基重悬细胞,接种于6孔板(接种细胞量以次日铺满培养板一层为宜)。接种24 h后,采用200 μL枪头在6孔板中划痕,PBS洗3次,分别于划痕后0 h和24 h观察细胞的迁移情况并拍照,计算迁移率=(0 h宽度-24 h宽度)/0 h宽度×100%。每组均设置4个平行反应复孔。
1.6 生物信息学技术分析UG0898H09的靶基因采用生物信息学网站starBase v2.0分析UG0898H09可互补结合的miRNA。采用生物信息学网站miRecords分析可互补结合的mRNA。
1.7 Western blot法收集转染48 h的两组LNCaP细胞,细胞裂解液提取总蛋白。采用10%SDS-PAGE胶电泳,行硝酸纤维膜转膜,5%脱脂牛奶在室温下封闭,加入一抗α-Tubulin(1 ∶2 000稀释)、KLF4(1 ∶1 000稀释)、Cyclin H(1 ∶2 000稀释)、CDK7(1 ∶3 000稀释)、N-cadherin(1 ∶2 000稀释)和ZEB-1(1 ∶1 000稀释),于4 ℃下孵育24 h,加入二抗在室温下孵育,采用ECL发光液在成像系统显影并拍照。
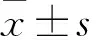
2 结果
2.1 前列腺癌组织中UG0898H09的表达qRT-PCR检测显示UG0898H09在前列腺癌组织和对应癌旁组织中的表达量分别为1.19±0.34和4.99±0.73,UG0898H09在前列腺癌组织中的表达下调(t=47.07,P<0.01,图1),提示UG0898H09可能参与前列腺癌的发生、发展。

图1 前列腺癌组织和对应癌旁组织中UG0898H09的表达:与癌旁组织相比,**P<0.01
2.2 UG0898H09在不同前列腺癌细胞株中的表达qRT-PCR检测显示UG0898H09在前列腺癌细胞株PC-3、LNCaP、C4-2B、PC-3M、DU-145和正常前列腺上皮细胞RWPE-1中表达量分别为0.80±0.04、0.17±0.03、0.43±0.01、0.72±0.03、0.50±0.04和1.00±0.05,UG0898H09在前列腺癌细胞株中的表达下调(P<0.05,图2)。UG0898H09在LNCaP细胞中的表达量最低(P<0.01),选择LNCaP细胞进行后续实验。
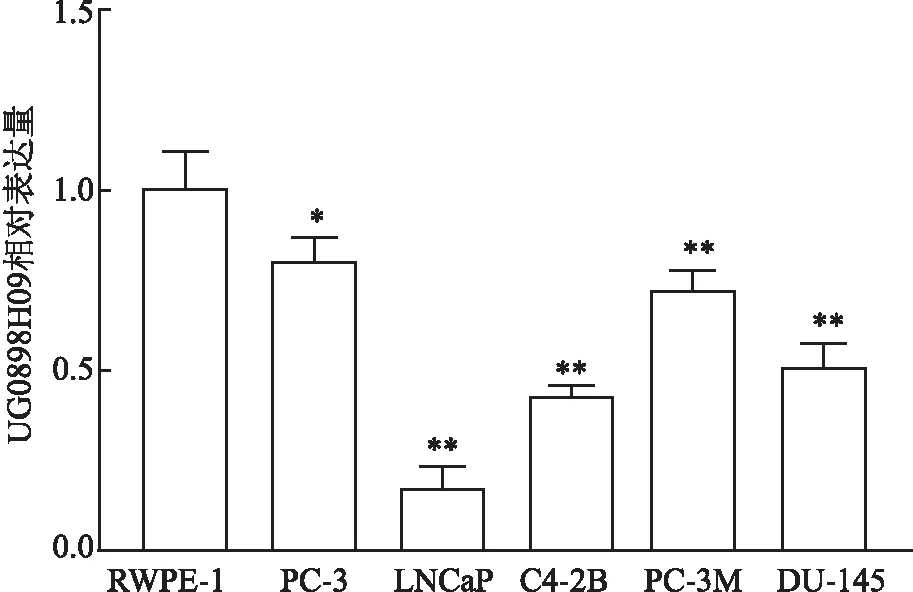
图2 UG0898H09在正常前列腺上皮细胞和前列腺癌细胞中的表达:与RWPE-1细胞相比,*P<0.05,**P<0.01
2.3 qRT-PCR检测转染效率阴性对照组和UG0898H09组LNCaP细胞中UG0898H09的表达量分别为1.02±0.11和8.93 ± 0.56,差异有统计学意义(P<0.01),提示转染成功。
2.4 WST-1法检测转染后细胞增殖能力与阴性对照组比较,转染UG0898H09后的第2天LNCaP细胞增殖能力开始下降,提示UG0898H09可抑制前列腺癌LNCaP细胞的增殖能力(P<0.05,图3)。

图3 WST-1法检测各组LNCaP细胞增殖能力:与阴性对照组相比,*P<0.05,**P<0.01
2.5 细胞划痕实验检测转染后细胞迁移能力阴性对照组和UG0898H09组细胞的迁移率分别为(72.44±3.93)%和(43.83±7.11)%,差异有统计学意义(P<0.05),UG0898H09可抑制前列腺癌LNCaP细胞的迁移能力(图4)。
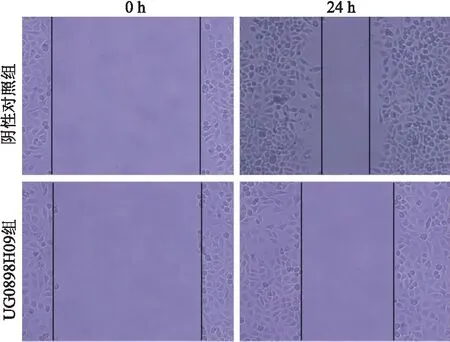
图4 细胞划痕实验检测各组LNCaP细胞迁移能力
2.6 生物信息学技术分析UG0898H09的靶基因采用生物信息学网站starBase v2.0分析,UG0898H09可互补结合miR-511-5p。采用生物信息学网站miRecords分析,miR-511-5p可互补结合KLF4 mRNA(图5)。
图5 生物信息学技术分析UG0898H09的靶基因
2.7 qRT-PCR检测转染后细胞miR-511-5p和KLF4 mRNA的表达阴性对照组和UG0898H09组LNCaP细胞中miR-511-5p的表达量分别为1.01±0.07和0.32±0.07,差异有统计学意义(P<0.01)。阴性对照组和UG0898H09组LNCaP细胞中KLF4 mRNA的表达量分别为1.01±0.10和4.71±0.84,差异有统计学意义(P<0.01)。
2.8 Western blot法检测KLF4和细胞增殖相关蛋白表达Western blot结果显示,与阴性对照组比较,UG0898H09组KLF4蛋白表达明显增加,细胞增殖相关蛋白CDK7和Cyclin H表达明显降低,细胞迁移相关蛋白N-cadherin和ZEB-1表达明显降低(图6)。
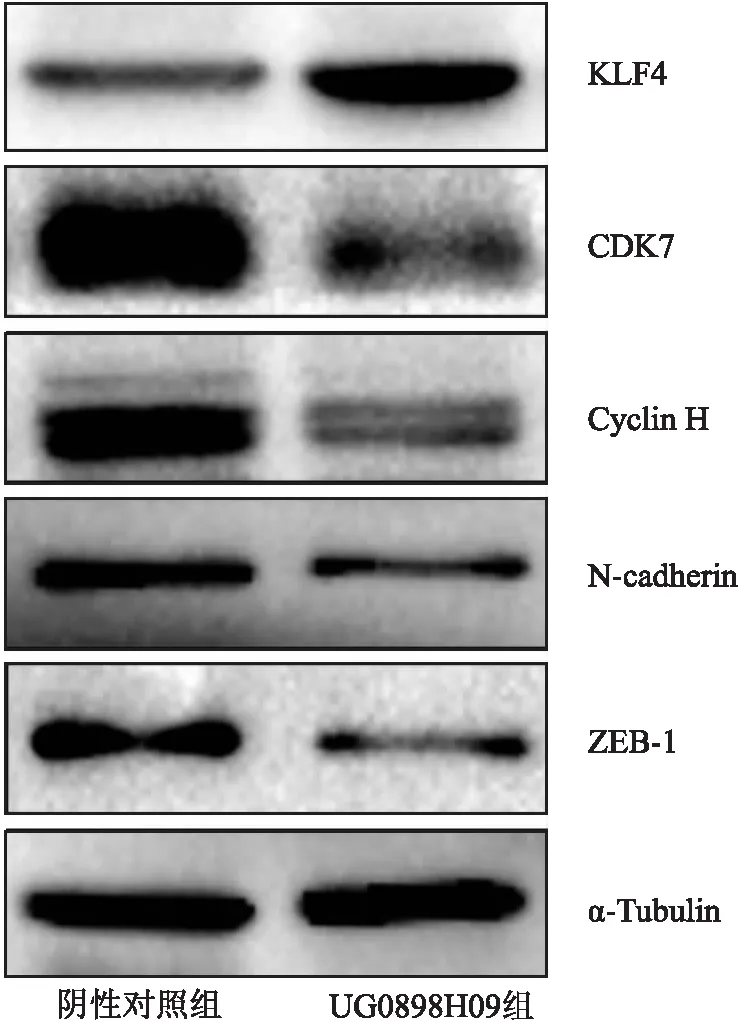
图6 Western blot法检测各组LNCaP细胞KLF4蛋白及相关蛋白的表达
3 讨论
lncRNA属于非编码RNA家族成员,是一类长度大于200个核苷酸的转录本[6-7]。lncRNA参与调控染色体组装,可在转录层面和转录后层面调控基因表达,从而影响细胞的各种生理病理过程[8-9]。已有大量研究证实lncRNA在前列腺癌中出现特异性表达,具有癌基因或抑癌基因作用,在前列腺癌发生、发展中发挥重要作用[10]。例如lncRNA CASC15、SNHG20和MIR4435-2HG在前列腺癌组织和细胞株中呈高表达,参与调控细胞的上皮-间充质转化,可显著促进前列腺癌细胞的迁移和侵袭[11-13]。UG0898H09是一种新发现的lncRNA,其在肿瘤特别是前列腺癌中的作用机制尚不清楚。
本实验证实,与癌旁组织或正常前列腺上皮细胞相比,UG0898H09在前列腺癌组织和细胞中的表达显著下调,提示UG0898H09显著下调可能与前列腺癌的发生、发展相关。本实验通过在LNCaP细胞中过表达UG0898H09,细胞的增殖和迁移能力均被显著抑制,提示UG0898H09在前列腺癌细胞中起着抑癌基因作用。已有研究证实,lncRNA可通过“海绵作用”与微小RNA(miRNA)反应元件竞争性结合,抑制miRNA与靶基因信使RNA(mRNA)的结合,从而降低miRNA的RNA干扰作用,促进靶基因的表达[14]。本实验通过生物信息学网站starBase v2.0发现,UG0898H09可配对结合miR-511-5p。有研究表明,miR-511-5p在肝癌组织和细胞株中表达显著上调,下调miR-511-5p表达可抑制肝癌细胞的增殖,miR-511-5p发挥癌基因作用[15]。本实验表明,过表达UG0898H09后,miR-511-5p表达降低,UG0898H09可能竞争性结合miR-511-5p。通过生物信息学网站miRecords发现,miR-511-5p可配对结合KLF4 mRNA。KLF4基因位于9q31染色体,KLF4蛋白是锌指转录因子KLF家族成员,广泛表达于人体组织,在细胞的各种生理活动中具有重要调节作用[16]。已有研究证实,KLF4蛋白在前列腺癌、乳腺癌、肺癌、结直肠癌等多种恶性肿瘤中低表达,具有抑制肿瘤细胞增殖、迁移和侵袭的作用,与肿瘤的发生、发展关系密切[17-19]。miR-511-5p表达降低后,KLF4 mRNA表达增加,表明UG0898H09可能通过吸附miR-511-5p,促进KLF4基因表达。Western blot法检测显示,KLF4蛋白表达上调后,细胞增殖相关蛋白CDK7和Cyclin H的表达减少,细胞迁移相关蛋白N-cadherin和ZEB-1表达减少,进一步证实前列腺癌细胞的增殖和迁移能力降低。
综上所述,本实验结果证实lncRNA UG0898H09在前列腺癌组织和细胞株中呈低表达,上调UG0898H09可通过miRNA海绵作用负向调控miR-511-5p表达,促进KLF4基因表达,抑制前列腺癌细胞的增殖和迁移能力。UG0898H09有望成为前列腺癌潜在的诊断标志物和治疗靶点。

