基于三维格子Boltzmann铝点蚀动态数值模拟
杨广峰,路梦柯,薛安源,李虎林,崔静
中国民航大学 机场学院,天津 300300
腐蚀会导致航空设备的损坏,造成巨大的经济损失,因此,预测腐蚀的损伤过程和深入理解腐蚀的发生机理,对于保证设备的安全运行起着重要的作用。利用传统的检测方法对设备的材料表面腐蚀进行检测时,既不能实时观测腐蚀发展过程,也无法深入地理解腐蚀发生的机理,而采用相关的数学模型进行腐蚀的数值模拟研究,在一定程度上可弥补传统方法的不足。
腐蚀过程是一个包括多组分之间的质量传输、界面动力学和电化学反应等多重因素相互影响的复杂过程。目前,主要采用有限元方法、分子动力学模拟以及元胞自动机方法对腐蚀现象进行数值模拟。顾孜昌[1]、马明利[2]采用有限元方法对管道的腐蚀缺陷进行了模拟;乔贵民[3]、李栾菊[4]、刘捷[5]等采用分子动力学模拟的方法对腐蚀进行模拟;陈梦成和温清清[6]、胡姗[7]、芦星等[8]、崔艳雨和赵沅沅[9]通过元胞自动机方法对腐蚀进行了模拟。邓景辉等[10]通过抛物线模型对铝合金材料的预腐蚀疲劳性能进行了模拟;张福泽[11-12]提出了一种简单易行的金属任意腐蚀损伤量日历寿命的计算模型和相应的求解曲线,并且对其进行了验证,可以得出其计算结果与实例环境下的相对误差为17.8%。但是,以上方法在模拟腐蚀时都有各自的缺点:有限元方法在计算腐蚀时,其计算精度不高,复杂边界难以处理,多相问题解决困难;分子动力学模拟虽然计算精度较高,但是计算主要是在计算机群进行,计算的成本高;元胞自动机多数为定性地分析腐蚀形状的变化,并且其腐蚀模拟对于多组分之间的质量传输和腐蚀化学反应只进行了简单元胞转化,并没有理论支撑,模拟过程中涉及的流动与扩散问题并不满足Navier-Stokes方程和对流扩散方程。而格子Boltzmann 方法(Lattice Boltzmann Method,LBM)作为一种介观方法(Mesoscopic Technique),近年来已经成功地应用于多种微观物质相互作用的流体系统问题中。Liu和Mostaghimi[13]、Nogues[14]等和Huber[15]等分别应用LBM研究了矿物质腐蚀溶解过程。Chen 等[16]为了解决多相流动中的相变和溶解沉淀问题,将LBM 同结点体积(Volume of Pixel[17],VOP) 方法在孔隙尺度下相结合,解决了多相流中的相分离、质量传输、化学反应、溶解沉淀等问题,这些都为LBM 模拟腐蚀工况提供了理论支撑。
但是,现有的格子Boltzmann腐蚀模型中,腐蚀边界在各个方向上受到的腐蚀作用相同,对腐蚀过程中钝化问题也未考虑,并且没有考虑腐蚀产物对腐蚀过程的影响,也未对腐蚀产物是否发生相变进行研究以及没有对腐蚀产物某种具体状态进行量化。其化学腐蚀的方式略显单一,仅考虑了阳极固体的溶解,对阴极进行了忽略,并且没有学者使用金属铝作为研究对象进行腐蚀模拟。
根据纯金属铝点蚀过程所包含诸多复杂问题分别建立多个子模型,并将子模型耦合形成格子Boltzmann腐蚀模型,在模拟过程中以电化学反应中半反应的方式为创新来模拟腐蚀体系中阴阳极的共同作用,并以金属钝化概率同格子Boltzmann腐蚀模型结合的方式,对金属阳极腐蚀速率和蚀坑形貌进行了修正处理。
1 格子Boltzmann腐蚀模型
1.1 多组分模型
金属铝在中性溶液中发生点蚀,液体组分在反应的过程中发生着流动传输,因此,使用Shan-Chen模型[18]来处理多组分介质间的流动,其演化方程为
fα(x+ceαΔt,t+Δt)-fα(x,t)=
(1)

D3Q19模型的平衡分布函数为
(2)
式中:α=0,2,…,18,ω0=1/3,ω1-6=1/18,ω7-18=1/36,即图1中D3Q19模型中0-18方向。D3Q19可用图1表示。

图1 D3Q19模型Fig.1 D3Q19 model
宏观量密度ρ和速度u可由密度分布函数求得:
ρ=∑fα
(3)
ρu=∑fαeα
(4)
在Shan-Chen模型中,为了降低误差和保证计算结果的稳定性,模型中使用了分子作用力对速度进行了修正,其分子间作用力为
(5)


(6)
式中:Fσw为液体分子与固相分子之间的作用力;wσw代表了液体与固体壁面的作用强度,wσw可通过接触角的变化进行调整;s用来区分固液相[21],当s=1时,该结点为固体结点,当s=0时,该结点为液体结点,这样就可以清晰地描述腐蚀溶液中组分与金属铝或者腐蚀产物等固体的相互作用。
在目前的研究中,Shan-Chen模型中速度的修正表示为
(7)
式中:Fσ为该结点所受到的合力,即结点受到的液体与液体分子作用力、液体分子与固体分子作用力的总和;u′为式(4)所求的速度。将式(7)所计算的u代入式(2)进行平衡分布函数的计算。
1.2 质量传输模型
金属铝在中性溶液中发生点蚀,溶液内的不同粒子组分发生反应的过程中伴随着传质扩散,因此需要使用LB(Lattice Boltzmann)质量传输模型[22],其演化方程为
gk,α(x+ceαΔt,t+Δt)-gk,α(x,t)=
(8)

对于D3Q7模型,浓度的平衡分布函数为
(9)
式中:Ck为第k组分宏观量深度。
对于D3Q7模型,系数Jk,α的表达式为
(10)
D3Q7模型如图2所示。

图2 D3Q7模型Fig.2 D3Q7 model

Ck=∑gk,α
(11)
浓度场中的扩散系数与Jk,0、浓度场松弛时间τk,g关系为
(12)
式中:Dk为k组分的扩散系数;τk,g为浓度场中的第k组分的松弛时间。
1.3 电化学反应模型
以中性溶液中的纯金属铝作为研究对象,以纯金属铝在点蚀过程中发生的电化学反应[24]为基础,构建了电化学反应模型,如图3所示。
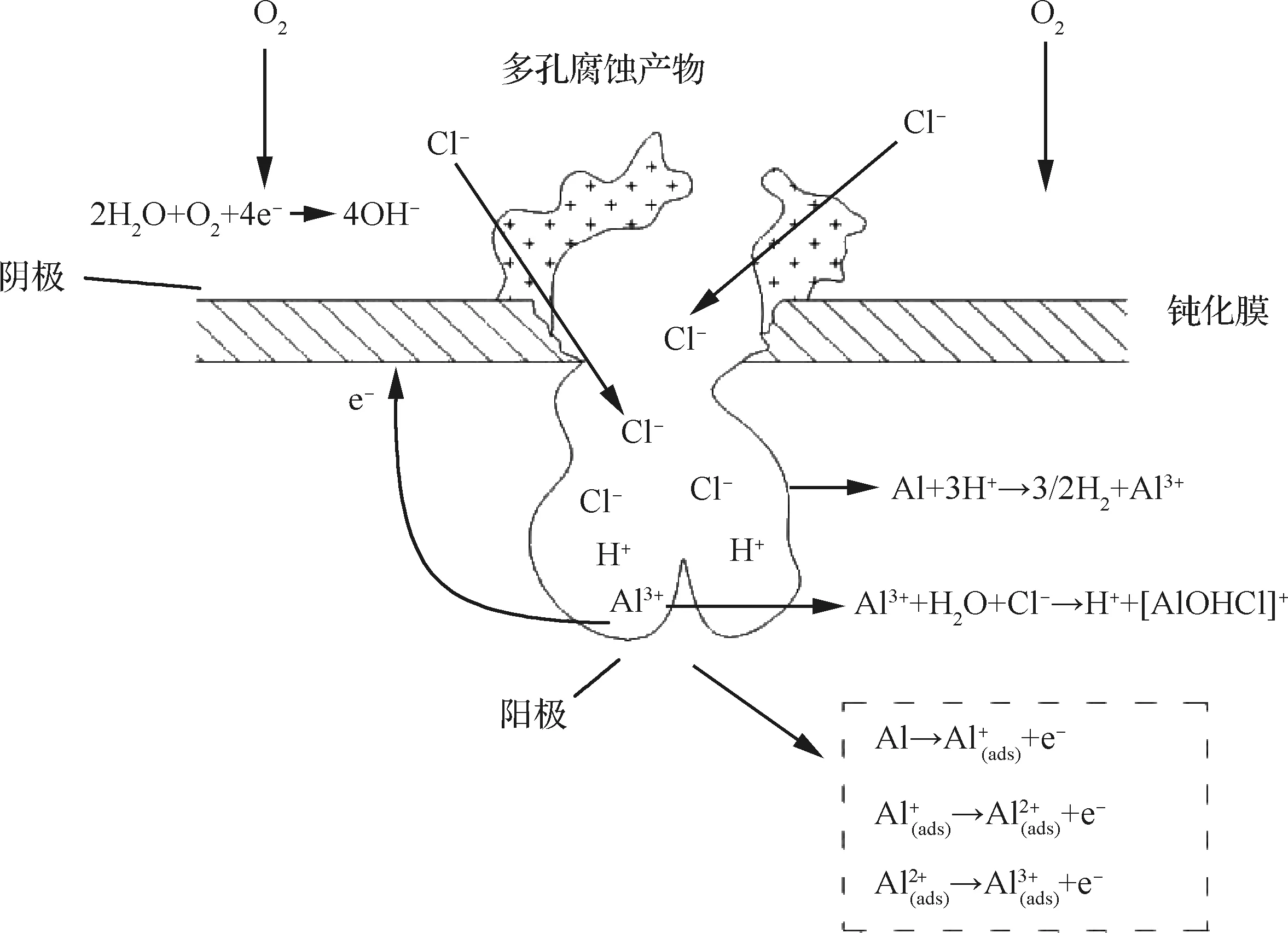
图3 金属铝的点蚀多重反应示意图Fig.3 Diagram of multiple reactions for aluminum pitting
1) 钝化膜溶解:




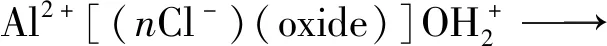

2) 阳极反应:



3) 阴极反应:

4) 总反应:
5)沉淀反应:

6)水解反应:


K1,1=1.07×10-5

K1,2=3.16×10-11

K1,3=3.16×10-17
因为求解反应式①的水解平衡常数远大于求解反应式②和求解反应式③的水解平衡常数,因此,为了简化计算模型,仅考虑水解反应式①。
7)自催化反应:

1.4 LB腐蚀边界迁移模型
由于金属铝在点蚀的过程中,金属铝的溶解与腐蚀产物的生成引起了固流界面的动态演化,所以必须采用一定的模型或方法来实时追踪固流界面。VOP法作为追踪固流界面方法的一种,可运用于金属铝腐蚀溶解与腐蚀产物沉淀所引起的固流界面变化。为了能实时追踪新的固体边界,采用VOP法在基础网格为D3Q19的模型中进行运算。
金属铝基体表面结点体积变化[25]为
(13)
钝化膜其结点体积变化为
VAl(oxide)OH(t+Δt)=VAl(oxide)OH(t)-
(14)
新生成沉淀结点在固体表面的体积变化为
VAl(OH)3(t+Δt)=VAl(OH)3(t)+
(15)

(16)
(17)
(18)
式中:CO2(aq)为腐蚀边界上的O2的消耗浓度;CCl-(aq)为钝化膜与溶液相接触边界Cl-的消耗浓度;CAl3+(aq)为腐蚀边界上物质Al3+的生成浓度;k1为化学反应式(16)的化学腐蚀反应速率;k2为化学反应式(17)的钝化膜腐蚀溶解反应速率;n为反应固体表面的外法线方向向量;DO2(aq)为O2扩散系数;DCl-(aq)为Cl-扩散系数;DAl3+(aq)为Al3+扩散系数。
通过式(16)~式(18)计算腐蚀边界组分O2、Al3+和Cl-的浓度。
1.5 结点钝化模型
在大部分点蚀过程中,亚稳态蚀坑可能会发生再钝化,减缓向稳态蚀坑发展,因此本文在VOP模型中引入了钝化概率,结点发生钝化的几率叫做钝化概率P,如果腐蚀边界某一结点发生钝化,将会导致该结点的体积减小,腐蚀速率变慢。钝化概率的大小与腐蚀边界处的结点腐蚀溶液浓度有关:
(19)
式中:ε为钝化概率系数;R为模拟过程任意生成的0~1之间任意随机实数;P为钝化概率;CO2为该腐蚀结点处氧气浓度。通过式(19)得到钝化概率系数,并对原有的结点体积法点蚀溶解式(13) 进行修正,修正后的公式为
(20)
假使不在结点体积法中引入钝化概率,腐蚀边界只会发生完全腐蚀溶解反应,就不会存在腐蚀溶解和再钝化的动态平衡,腐蚀边界的腐蚀结点在周围每一个方向上所受的腐蚀作用相等。由于结点体积法是在D3Q19模型中进行运算的,相同的腐蚀溶解速率将导致点蚀坑的形状呈现完全对称的半球形,这与真实的腐蚀形貌并不相符。因此,在结点体积法中很有必要引入钝化概率。
2 数值模拟
2.1 点蚀演化过程分析
所选格子区域为40×40×60,液体区域为40× 40×30格子,钝化膜所占区域为40×40×3格子,金属铝基体区域为40×40×27格子。计算网格中,在含氧腐蚀溶液同钝化膜接触的界面上选取两个点作为点蚀的萌生点(方便将蚀坑放在视野中心),所取点的坐标分别为(16,20,30)、(24,20,30)。在整个计算区域中,对两侧液体边界以及上部液体边界使用了三维非平衡外推格式处理,对金属铝基体与含氧腐蚀溶液之间、金属铝钝化膜与含氧腐蚀NaCl溶液之间以及腐蚀产物固体沉淀与含氧腐蚀溶液之间的作用碰撞,使用三维标准反弹格式进行边界处理。为了方便计算,节省内存,将模拟过程中工况的实际单位转化为格子无量纲单位。表1给出了实际物理量及其单位,并且给出了转换[24,26-27]无量纲后的格子数值。

表1 三维模型模拟中使用的参数Table 1 Parameters used in 3D model simulation
图4为x=20处蚀坑形貌随时间变化的剖面图。从图4可以看出,在t=0~10 000时,含氧NaCl腐蚀溶液对点蚀萌生点附近区域的钝化膜进行侵蚀,并且金属基体与腐蚀溶液相互接触,点蚀成核完成。在t=10 000~20 000时间段内,基体金属铝开始在腐蚀溶液作用下,其钝化膜下的蚀坑逐渐变大,点蚀坑呈现半球状。t=25 000时,在点蚀孔口处,出现了腐蚀产物沉淀,阻碍了蚀孔内外的组分传输,使点蚀坑内产生自催化效应,从而维系着点蚀继续进行。随着时间的延续,如图4(i)所示,可以观察到孔口腐蚀产物沉淀的数量越来越多,金属铝被腐蚀的体积也越来越大。

图4 在x=20处点蚀坑形貌随时间变化的剖面图Fig.4 Profile of pitting morphology with time at x=20
图5为金属铝点蚀过程中氯离子随时间的浓度分布情况的截面图,所取截面分别为x=20(如图5(a))和y=16,24(如图5(b))。从图5中可以发现,在t=0~10 000时,萌生点周围的钝化膜逐渐被氯离子侵蚀,被侵蚀的钝化膜附近溶液中的Cl-浓度下降,由于其它区域的Cl-浓度较高,在浓度差的作用下,腐蚀溶液远处的Cl-不断向点蚀萌生附近处迁移,并为后续反应提供动力。当金属铝基体与腐蚀溶液接触时,腐蚀电池发生作用,点蚀坑逐渐变大,导致腐蚀边界处氯离子浓度逐渐降低,蚀坑外的氯离子逐渐向蚀坑内扩散传输。

图5 点蚀过程中氯离子浓度随时间分布的截面图Fig.5 Sectional view of concentration distribution of chloride ions over time during pitting
图6为点蚀过程中阳极腐蚀产物铝离子随时间的浓度分布情况的截面图,所取截面分别为x= 20(图6(a))和y=16,24(图6(b))。从图6中的(a1)~(a3)和(b1)~(b3)可以看出,在t=0~10 000时,由于金属铝点蚀正处于点蚀成核过程中,腐蚀溶液并没有与金属铝基体发生接触,腐蚀电池并未发生作用,溶液中并没有出现铝离子。当t≥15 000时,如图6中的(a4)~(a6)和(b4)~(b6)所示,氯离子已将钝化膜侵蚀,导致腐蚀溶液与基体金属相接触,金属铝开始被含氧腐蚀溶液腐蚀,腐蚀边界处生成了铝离子。随着时间的延续,生成的铝离子越来越多,并且向低浓度区域进行扩散,即从蚀坑内部向蚀坑外部传输。在t=30 000时,如图6中的(a9)和(b9)所示,孔口处出现的腐蚀产物沉淀阻碍了蚀坑内的铝离子向外扩散,蚀坑内的铝离子向外传输困难,导致蚀坑内铝离子浓度升高。

图6 点蚀过程中铝离子浓度随时间分布的截面图Fig.6 Sectional view of concentration distribution of aluminum ions over time during pitting
图7为点蚀过程中腐蚀含氧溶液里氧气浓度随时间分布的截面图,所取截面分别为x=20(图7(a))和y=16,24(图7(b))。从图7可以看出,在t=0~10 000时,腐蚀溶液中的氧气含量几乎没有变化,这是因为在这个时段内钝化膜阻碍了含氧腐蚀溶液与铝基体的接触。当钝化膜被氯离子侵蚀到一定程度后,腐蚀溶液与金属铝接触形成腐蚀电池发生了吸氧腐蚀,溶液中的氧气在阴极(蚀坑周围的钝化膜表面)发生反应而被消耗,因此阴极周围的氧气含量逐渐降低。随着蚀坑逐渐变大,腐蚀边界附近的氧气逐渐被稀释,因此在浓度差的作用下,氧气由高浓度区域向低浓度区域进行扩散,形成浓度梯度;当t=30 000时,蚀坑孔口出现的腐蚀产物沉淀阻碍了蚀坑内外间氧气的扩散传输,发生较为明显的浓度分层。

图7 点蚀过程中含氧腐蚀溶液里氧气浓度随时间分布的截面图Fig.7 Sectional view of concentration distribution of oxygen over time in corrosive oxygenated solution during pitting
图8为点蚀过程中铝离子水解产生的氢离子浓度随时间分布的截面图,所取截面分别为x=20(图8(a))和y=16,24(图8(b))。从图8中可以看出,在t=30 000前,溶液中几乎不存在氢离子,这是因为阳极腐蚀产物铝离子的浓度没有达到破坏铝离子水解平衡条件时,金属铝的腐蚀只经历了点蚀成核过程和亚稳态点蚀过程;当t=30 000时,蚀坑内的铝离子浓度达到了破坏水解平衡的条件,铝离子的水解向正向移动,产生了大量的氢离子,而孔口处的腐蚀产物同样阻碍了氢离子向蚀坑外低浓度区域扩散。因此,随着点蚀的进行,蚀坑内呈现出酸性环境,氢离子与蚀坑内金属发生了析氢反应,使得腐蚀反应速率变快。

图8 点蚀过程中水解产生的氢离子浓度随时间分布的截面图Fig.8 Sectional view of concentration distribution of hydrogen ion concentration by hydrolysis over time during pitting
图9为点蚀过程中阴极腐蚀产物氢氧根离子随时间的浓度分布截面图,所取截面分别为x=20(图9(a))和y=16,24(图9(b))。当t=0~10 000 时,金属铝点蚀为成核阶段,钝化膜保护了金属铝基体不受含氧腐蚀溶液腐蚀,因此,溶液中仅有少量的氢氧根离子均匀分布在液体环境中;当t=15 000时,萌生点处附近区域的金属铝基体失去了钝化膜的保护,点蚀进入亚稳态点蚀阶段,在该阶段中,吸氧腐蚀电池开始作用,阳极金属铝被腐蚀溶解的同时蚀坑孔口附近的钝化膜可充当阴极,并在该区域内发生阴极反应,消耗溶液中的氧气,生成氢氧根离子。如图9中所示,蚀坑内的氢氧根离子浓度很低,这是因为随着反应的进行,溶液中氢氧根离子的浓度越来越大,氢氧根离子会由阴极表面向溶液其他浓度较低区域扩散;当氢氧根离子扩散至蚀坑内部时,由于蚀坑内含有大量的氢离子,蚀坑内的氢氧根离子将会和氢离子发生中和反应;当t=30 000~40 000时,由于阳极产生的铝离子扩散至孔口周围,与阴极产生的氢氧根离子相接触产生氢氧化铝。随着时间的进行,生成的氢氧化铝越来越多,在蚀孔口周围的氢氧化铝浓度达到了其在该工况下的饱和浓度,产生的沉淀会阻碍蚀坑内外粒子的传输扩散。

图9 点蚀过程中氢氧根离子随时间的浓度分布Fig.9 Concentration distribution of hydroxide ions over time during pitting
图10为金属铝腐蚀的最大深度随时间的变化关系。通过对金属铝点蚀全过程中的不同时刻被腐蚀的蚀坑的最大深度进行统计,可以得到点蚀过程中腐蚀金属铝的最大深度随时间的变化关系图。如图10所示,随着时间的增加,金属铝被腐蚀的体积越来越大,这与Li等[28]使用元胞自动机模拟的点蚀过程所得到的模拟结果相符。并且通过拟合得到蚀坑最大深度与腐蚀时间之间关系满足经验公式:

图10 铝腐蚀蚀坑最大深度随时间变化关系Fig.10 Relationship of maximum depths of aluminum corrosion pits over time
h(t)=Atb
(21)
式中:t代表时间;A和b是常数。模拟所得最大深度与时间的幂函数拟合结果很好地与实验经验公式吻合[6,29],可以看出Chi-Sqr为0.149 9,R2为0.981 6。
图11为在t=40 000时,蚀坑中心(16,20,30)和(16,20,30)竖直方向不同点的浓度分布。通过图11可以很明显地看出,越靠近底部蚀坑,氯离子、氧气和氢氧根浓度越低,而铝离子、氢离子浓度越高,这些都是因为随着腐蚀边界的不断更新,在浓度差的作用下,它们从高浓度向低浓度扩散,所有的铝离子和氢离子在腐蚀边界处生成,而氯离子、氧气和氢氧根离子则在边界处被稀释。该模拟结果与Sanchez-Perez等[30]使用网格方法所做的模拟结果相符。

图11 蚀坑1中心(16,20,30)和蚀坑2中心(16,20,30)竖直方向不同点的浓度分布Fig.11 Concentration distribution at different points in vertical direction of center of pit 1 (16,20,30) and that of pit 2 (16,20,30)
2.2 影响因素分析
2.2.1 氯离子初始浓度
氯离子会对金属铝的钝化膜进行侵蚀,阻碍阳极再钝化的发生,加大吸氧腐蚀电池的作用强度。因此,改变环境中氯离子初始浓度,可以得到氯离子浓度对金属铝点蚀的影响。表2给出了时间为t=40 000时不同的模拟工况。图12为在表2 模拟工况下,最终钝化膜xoz平面的形貌。

表2 模拟不同初始氯离子浓度的工况Table 2 Simulated conditions with different initial chlorine ion concentrations
通过图12可以看出,初始氯离子的浓度越高,金属铝被腐蚀得越多,蚀坑的最大深度越大;这是因为氯离子初始浓度越高,表面的钝化膜被破坏得越快,使得含氧腐蚀溶液与金属铝基体更快地接触,金属铝的点蚀更快地进入稳态阶段,从而加快了腐蚀反应速率。图13为图12所对应的当腐蚀时间一定时,氯离子初始浓度不同条件下的蚀坑内氢离子分布情况。从图13中可以看出,在相同的腐蚀时间下,随着初始氯离子浓度的升高,蚀坑内的氢离子浓度逐渐增加,并且在蚀坑底部氢离子浓度更快地达到峰值,这是因为氯离子浓度的增加能够加速钝化膜的溶解,更快地形成吸氧腐蚀电池,使蚀坑进入稳态点蚀的时间提前。铝离子更早地发生水解反应生成大量的氢离子,会降低蚀坑内的pH,尤其对于蚀坑底部这种闭塞程度较大的区域。因此,金属铝被腐蚀的程度会随着氯离子初始浓度的升高而加深。
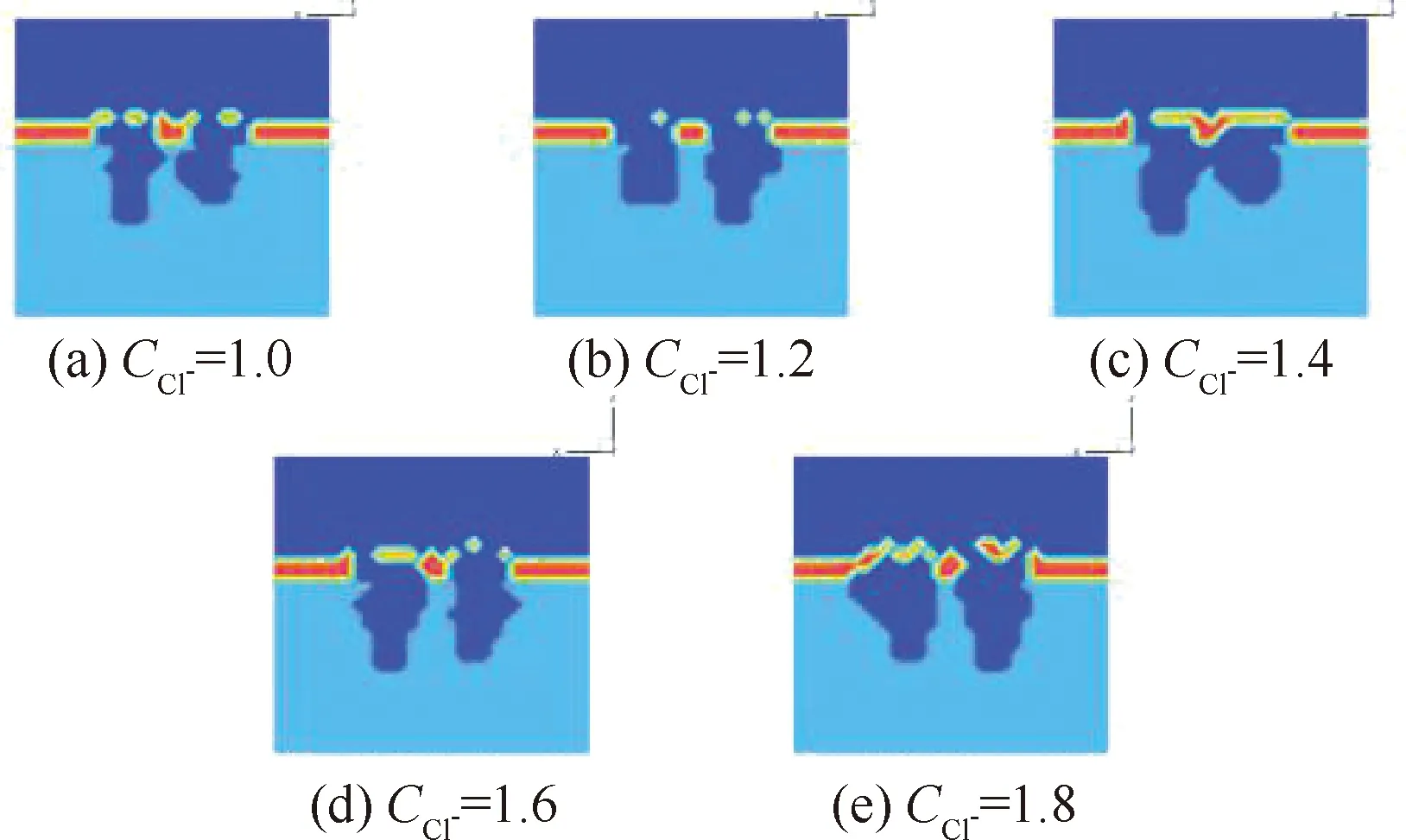
图12 氯离子初始浓度不同条件下最终钝化膜xoz平面的形貌Fig.12 Morphology of xoz plane of final passivation film at different initial chlorine ion concentrations

图13 氯离子初始浓度不同条件下的蚀坑内氢离子分布情况Fig.13 Distribution of hydrogen ions in etch pit under different initial chlorineion concentrations
图14给出了氯离子初始浓度不同的条件下,铝点蚀蚀坑平均最大深度随时间的变化关系图,这与形貌图所表现的结果相一致。在相同时间内,随着初始氯离子浓度的增加,金属铝被腐蚀的程度加深;氯离子初始浓度越高,腐蚀反应速率突变的就时间越早。该模拟结果与Mccafferty[31]所提出的结论相符,氯离子浓度会影响腐蚀速率的快慢。因此,可以通过减少氯离子浓度的方法,降低金属铝点蚀的倾向。

图14 不同初始氯离子浓度与蚀坑平均最大深度关系Fig.14 Relationship of different initial chlorine ion concentrations and average maximum depths of pit
2.2.2 腐蚀反应速率
在腐蚀边界迁移模型中,通过改变腐蚀反应速率,来衡量腐蚀反应速率对金属铝点蚀的影响。表3给出了模拟时间为t=40 000时,不同条件下的模拟工况。图15给出了不同腐蚀反应速率下的蚀坑xoz平面形貌图。

表3 腐蚀反应速率在不同条件下的模拟工况Table 3 Simulated conditions with different corrosion reaction rates

图15 不同腐蚀反应速率下的蚀坑xoz平面形貌Fig.15 Etch pit morphology of xoz plane with different corrosion reaction rates
从图15可以看出,腐蚀速率越快,金属铝点蚀的体积越大,蚀坑的最大深度也越深。这是因为腐蚀反应速率变快将导致吸氧腐蚀电池的作用加快,使得孔口处的腐蚀产物沉淀增多,而孔内腐蚀产物铝离子浓度升高,加快了铝离子水解作用,使孔内的pH降低,这种自催化作用的加大,使得蚀孔内的阳极金属铝的溶解速率加快。
图16为图15中对应的在不同腐蚀反应速率下蚀坑内氢离子浓度的分布图。从图16中可以看出,腐蚀反应速率越快,蚀坑越容易从亚稳态蚀坑变化为稳态蚀坑,这是因为随着蚀坑底部铝离子发生水解的速度地加快,提前生成了氢离子,坑内的氢离子浓度(尤其是蚀坑底部)随着腐蚀反应速率的加快而升高,而蚀坑外部大量的铝离子与氢氧根结合生成固体腐蚀产物,沉积在蚀坑孔口,蚀坑也呈现更加封闭的状态,进而导致蚀坑内pH进一步减小,加速了蚀坑内部的自催化作用。

图16 在不同腐蚀反应速率下蚀坑内氢离子浓度的分布Fig.16 Hydrogen ion concentrations in corrosion pit under different corrosion reaction rates
图17给出了不同腐蚀反应速率下,金属铝点蚀蚀坑平均最大深度随时间的变化关系图,这与形貌图所表现的结果相一致,即在相同的时间内,金属铝点蚀蚀坑的最大深度随着腐蚀反应速率的加快而增大。

图17 腐蚀反应速率与蚀坑平均最大深度的关系Fig.17 Relationship of corrosion reaction rates and mean maximum depths of pit
3 结 论
1) 使用格子Boltzmann方法建立了不同腐蚀条件下的流场以及不同组分的浓度场数学模型,可模拟真实的液体组分流动扩散;以电化学反应中半反应的方式为创新,对腐蚀体系中阴阳极的作用进行了描述;将金属钝化概率引入结点体积法之中,对金属阳极腐蚀速率和蚀坑形貌进行修正处理,并使用结点体积法对腐蚀产物的形态变化进行了研究,结点体积法可快速寻找到腐蚀边界。
2) 纯铝点蚀的全过程中,点蚀逐步经过了点蚀成核、亚稳态点蚀过程以及稳态点蚀过程;并且随着时间的增加,金属铝被腐蚀的体积越来越大。
3) 相同的腐蚀时间下,氯离子初始浓度的升高使得吸氧腐蚀电池更早地形成,铝点蚀坑内pH降低,因此金属铝被腐蚀的程度加深;在相同的腐蚀时间下,随着腐蚀电池中铝阳极反应速率的增加,蚀坑内生成大量铝离子,使得铝离子水解向正向移动,加速了蚀坑内的自催化反应,铝点蚀的程度加深。
4) 将模拟中铝点蚀蚀坑最大深度与时间进行拟合,得到的模拟结果与实验经验公式h(t)=Atb吻合良好。

