长链非编码RNA LINC01133基因表达与胃癌发展的相关性研究
陈圳泽 曾伟超 郑辉达 颜长江 许建华
【摘要】 目的:探討LINC01133在胃癌组织中的表达情况和对体外培养的胃癌细胞表型的影响。方法:采用qPCR检测各组织细胞的LINC01133的表达水平。比较30例胃癌组织及其相应癌旁组织LINC01133的表达。比较正常胃黏膜上皮细胞(GES-1细胞)、人胃癌细胞(MGC-803、BGC-823)中LINC01133的表达水平。选择LINC01133低表达的表达MGC-803细胞设置NC组(MGC-803细胞转染过表达空质粒组)与LINC01133组(MGC-803细胞转染LINCO1133-pcDNA3.1质粒组),比较两组LINC01133的表达水平。采用CCK-8、流式细胞术、划痕实验检测比较两组细胞增殖、凋亡、迁移。结果:胃癌组织中LINC01133的表达水平明显低于癌旁组织(P<0.05)。MGC-803细胞的LINC01133表达水平低于GES-1和BGC-823细胞(P<0.05)。LINC01133组LINC01133表达水平高于NC组(P<0.05)。LINC01133组细胞存活与迁移速率均低于NC组,而细胞凋亡率高于NC组(P<0.05)。结论:LINC01133在胃癌组织中表达下调,LINC01133表达可抑制胃癌细胞增殖、迁移,促进细胞凋亡,在胃癌发展中发挥抑癌基因的作用,LINC01133低表达可能是胃癌患者的一个不良因素,有望成为胃癌诊断和治疗中新的研究靶点。
【关键词】 LINC01133 胃癌 增殖 凋亡
[Abstract] Objective: To investigate the expression of LINC01133 in gastric cancer tissues and its effect on the phenotypic of gastric cancer cells cultured in vitro. Method: The expression level of LINC01133 in each tissue cell was detected by qPCR. The expression of LINC01133 in 30 cases of gastric cancer and its adjacent tissues were compared. MGC-803 cells with low expression of LINC01133 were selected to set up NC group (MGC-803 cells transfected with empty plasmid group) and LINC01133 group (MGC-803 cells transfected with LINCO1133-pcDNA3.1 plasmid group), and the expression levels of LINC01133 in the two groups were compared. CCK-8, flow cytometry and scratch test were used to compare the proliferation, apoptosis and migration of cells in the two groups. Result: The expression level of LINC01133 in gastric cancer tissues was significantly lower than that in adjacent tissues (P<0.05). The LINC01133 expression level of MGC-803 cell was lower than those of GES-1 and BGC-823 cells (P<0.05). The expression level of LINC01133 in LINC01133 group was higher than that in NC group (P<0.05). The survival and migration rates of LINC01133 cells were lower than those of NC group, while the apoptosis rate was higher than that of NC group (P<0.05). Conclusion: The expression of LINC01133 is down-regulated in gastric cancer tissues, and the expression of LINC01133 can inhibit the proliferation and migration of gastric cancer cells, promote cell apoptosis, and play a role of tumor suppressor gene in the development of gastric cancer. The low expression of LINC01133 may be an adverse factor in patients with gastric cancer, which is expected to become a new research target in the diagnosis and treatment of gastric cancer.
[Key words] LINC01133 Gastric cancer Growth Apoptosis
First-authors address: The Second Affiliated Hospital of Fujian Medical University, Quanzhou 362000, China
doi:10.3969/j.issn.1674-4985.2020.23.004
胃癌已经成为全球范围内导致死亡的主要原因,尤其在日本、韩国和中国等东亚国家发病率较高[1-4]。当今胃癌患者的生存率已经有了很大的提高,但由于胃癌可以向淋巴结、肝脏、腹腔转移和扩散,其预后较差,5年生存率低于30%[5]。目前,胃癌的早期治疗主要是手术方式,大多数胃癌被检出时已为进展期,因此,探索胃癌浸润、转移机制具有重要意义。
长链非编码RNA(long non-protein coding RNA,lncRNA)是非蛋白编码RNA的一种,长度大于200 nt[6]。如今,越来越多的证据表明lncRNA通过基因水平、转录水平和翻译水平来调节生物学过程中多种活动,在肿瘤发生发展中扮演重要角色[7]。目前已经鉴定出许多功能性lncRNA,例如lncRNA MEG3能够抑制宫颈癌细胞的增殖能力,在人宫颈癌组织中MEG3表达明显下调,表明lncRNA MEG3发挥重要的抑癌基因功能[8]。在肝脏中发现lncRNA LALR1能够促进肝细胞增殖,在肝组织再生过程中发挥重要作用[9]。lncRNA MVIH在肝肿瘤组织中高表达,能促进血管生成,并带来更差的预后[10]。众多研究发现lncRNA还可作为潜在的生物标志物,有助于肿瘤的辅助诊断和判断预后,其在胃癌发展中的重要作用也被广泛报道[6]。
在既往研究中,存在LINC01133在胆囊癌、结直肠癌、非小细胞肺癌、肺鳞状细胞癌及骨肉瘤中表达的探讨[11-15]。检索GEO(gene expression omnibus)数据库GSE54129,GSE69963、GSE15495、GSE22366数据集和TCGA(the cancer genome atlas)数据库,发现LINC01133基因与胃癌的预后相关,高表达LINC01133的胃癌患者总生存时间更长。本课题通过组织和细胞两个层次开展对胃癌LINC01133的表达水平和细胞表型的研究,揭示LINC01133基因在胃癌发展的作用,以此来促进针对该疾病的lncRNA指导的诊断和治疗方法的发展,现报道如下。
1 材料与方法
1.1 材料
1.1.1 组织样本和细胞株 胃癌组织标本收集于2008-2012年,购自上海芯超生物科技有限公司。包括30例胃癌组织和癌旁组织冰冻样本的RNA反转录成的cDNA。所有标本的使用均征得了上海芯超生物科技有限公司伦理委员会同意。正常胃黏膜上皮细胞(GES-1细胞)、人胃癌细胞(MGC-803、BGC-823)来自福建医科大学干细胞医学研究所冷冻保存。
1.1.2 主要试剂 完全DMEM培养基、CCK8法细胞增殖检测试剂(KGA316)购自芯超生物,HiFiScript cDNA 第一链合成试剂盒(CW2569M)、UltraSYBR Mixture(CW0956M)购自CWBIO 康为世纪,qPCR试剂盒购自Takara,Annexin V-FITC/PI Apoptosis Kit(AP101-100-kit)、Cell Cycle Staining Kit(CCS102)、质粒小提试剂盒(DP103-02)、pcDNA3.1(+)vetor,过表达空质粒、LINCO1133-pcDNA3.1质粒购自中洪博元生物。
1.2 方法
1.2.1 qPCR检测 Trizon法提取胃癌、癌旁组织、GES-1、MGC-803、BGC-823细胞的总RNA,逆转录合成cDNA,荧光PCR仪检测LINC01133的表达水平。相应引物:LncRNA01133 F:CTCCCCACCAGAAAGTCCT,LncRNA01133 R:TCCCTATGCCCTCAAACC,GAPDH F:GAAGGTCGGAGTCAACGGAT,GAPDH R:CCTGGAAGATGGTGATGGG。PCR数据分析方法使用2-△△Ct法。由此选择LINC01133低表达的MGC-803细胞进行后续试验。
1.2.2 实验分组 NC组(MGC-803细胞转染过表达空质粒组)与LINC01133组(MGC-803细胞转染LINCO1133-pcDNA3.1质粒组)。
1.2.3 细胞培养及转染 MGC-803细胞在含有10%胎牛血清的DMEM完全培养基,置于37℃,5% CO2培养箱。细胞密度达60%时,准备转染。DNA转染(MGC-803细胞):EP管2个,即NC组与LINC01133组,每管加125 μL Opti-MEM,NC组加入5 μL lipofectamine 3000,LINC01133组加入2.5 μg质粒、5μL P3000,混匀滴到6孔板中,4 h后6孔板中加入血清含量20%的完全培养基1 mL,48 h后进行相应检测。
1.2.4 CCK8法 生长状态良好的对数生长期的MGC-803细胞,每孔按4×103个接种至96孔板中,根据上述分组进行细胞转染和加药物处理,继续培养48 h后,弃含药培养基,每孔加10 μL的毒性检测液CCK8,置于培养箱中培养4 h,用酶标仪测波长为450 nm的OD值。实验重复3次,取实验结果的平均值作为最终结果。
1.2.5 流式细胞术 取两组生长状态好的对数生长期细胞,每孔按4×103个接种至12孔板中,每组设置3复孔,于细胞培养箱中培养,根据上述分组进行细胞转染和加药物处理,继续培养48 h后,PBS洗细胞两次,加Annexin V/PI检测试剂盒,流式检测仪检测细胞凋亡。
1.2.6 划痕实验 用marker笔在24孔板背后,用直尺比着孔的正中央,均勻地画横线,横穿过孔。分别加入两组细胞,约5×105个,掌握为过夜能铺满。第二天用枪头比着直尺,垂至于背后的横线划痕。48 h后再次给每孔的划痕拍照。根据划痕情况确定使用48 h划痕数据与0 h划痕数据求出对应的划痕宽度,进而计算出细胞的迁移速率。迁移速率=迁移距离/迁移时间。
1.3 統计学处理 所有实验均进行3次生物学重复。应用SPSS 20.0软件进行实验数据的统计与分析,计量资料用(x±s),比较采用t检验,以P<0.05为差异有统计学意义。
2 结果
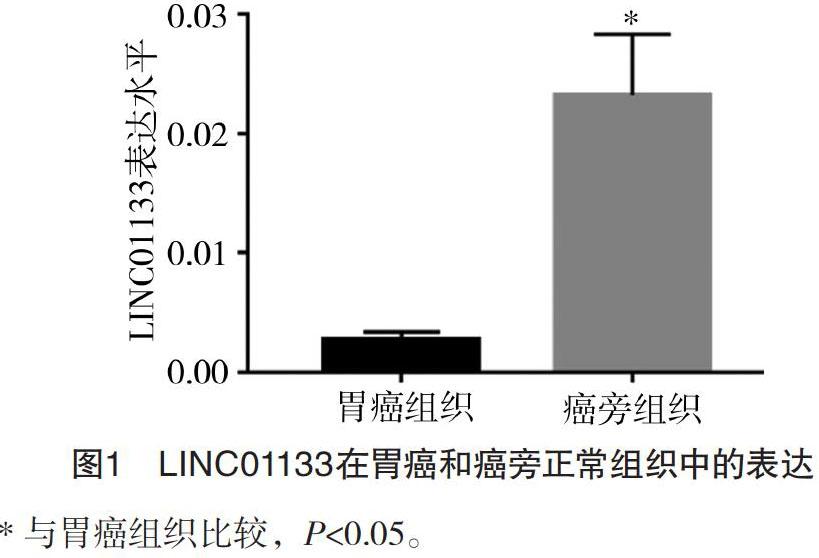
2.1 胃癌组织与癌旁组织中LINC01133的表达 胃癌组织中LINC01133的表达水平(0.002 8±0.000 6)明显低于癌旁组织(0.023 2±0.005 1),差异有统计学意义(P<0.05)。见图1。
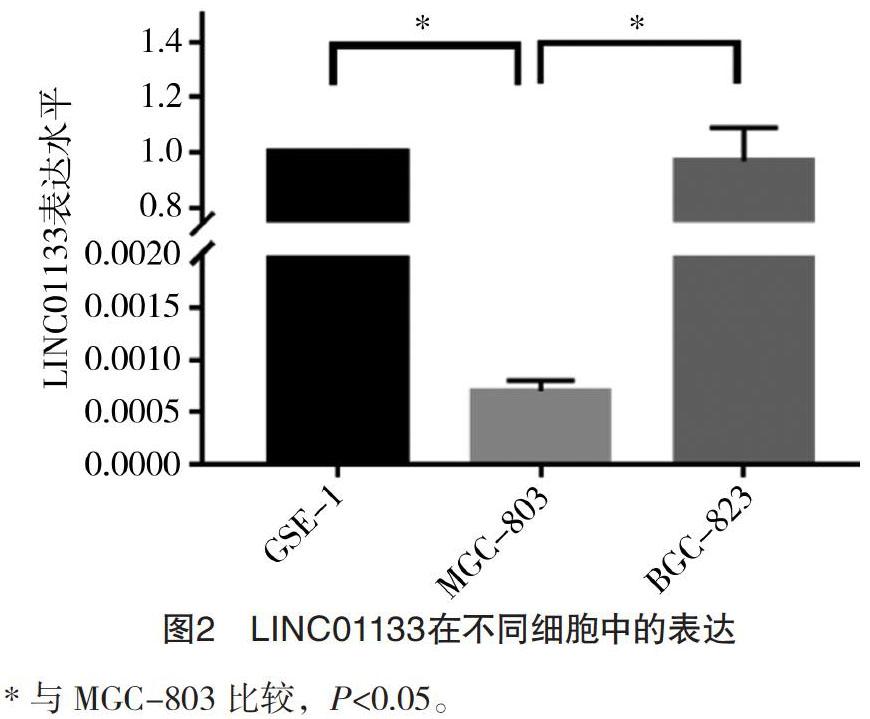
2.2 GES-1、MGC-803、BGC-823细胞中LINC01133表达比较 MGC-803细胞的LINC01133表达水平(0.000 7±0.000 1)低于GES-1细胞(1.000 0±0.000 0)和BGC-823细胞(0.967 6±0.121 9),差异均有统计学意义(P<0.05),见图2。
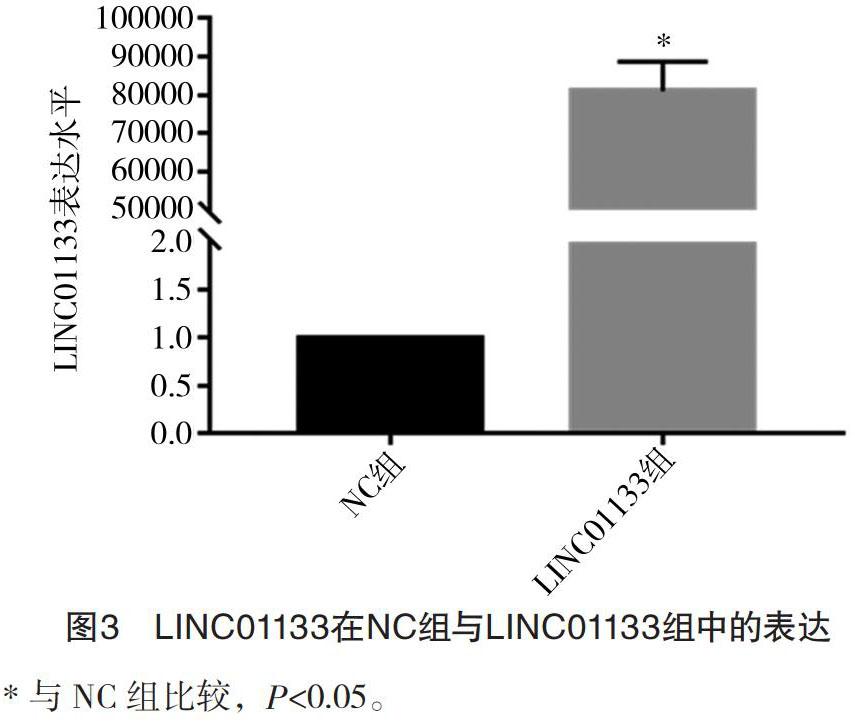
2.3 NC组与LINC01133组中的LINC01133表达情况比较 LINC01133组LINC01133表达水平(81 007.072 1±7 801.458 5)高于NC组(1.000 0±0.000 0),差异有统计学意义(P<0.05),见图3。
2.4 NC组与LINC01133组细胞增殖、凋亡、迁移情况比较 LINC01133组细胞存活率(81.11±0.82)%低于NC组(95.68±0.92)%,差异有统计学意义(P<0.05),见图4。NC组凋亡率(24.25±3.69)%低于LINC01133组(90.06±5.16)%,差异有统计学意义(P<0.05),见图5。LINC01133组迁移速率(1.61±0.16)μm/h低于NC组(2.51±0.11)μm/h,差异有统计学意义(P<0.05),见图6。
3 讨论
lncRNA是一类转录本长度大于200个核苷酸不编码蛋白质的RNA分子。lncRNA的作用模式包括(1)与编码基因上游的启动子区结合;(2)与基因竞争结合转录因子;(3)脚手架结构作用;(4)与蛋白编码基因的转录本形成互补双链;(5)结合到特定蛋白上,改变该蛋白的活性;(6)作为miRNA的靶分子,或者前体分子[8]。成千上万的lncRNA包含在癌症基因组中,表明它们可能是癌症生物学的潜在驱动因素并且可用作临床生物标志物[16]。
许多文献已经报道lncRNA在胃癌组织与非肿瘤组织中表达差异,下调和上调lncRNA基因表达均影响着疾病过程。Sun等[17]发现,长链非编码HOXA11-AS在胃癌中特异性上调,并通过体内、体外实验证明了HOXA11-AS促进胃癌细胞增殖,迁移和侵袭并抑制细胞凋亡。并发现GAS5在患者胃癌组织中表达下降,抑制其表达则能够促进胃癌细胞的生长[18]。同年发现MEG3在胃癌和癌旁检测后,特异性低表达,敲减MEG3后促进细胞增殖,过表达后细胞增殖抑制[19]。
lncRNA作为医学科研领域的研究热点,本研究结合当今热点lncRNA和临床胃癌疾病进行分析。在30例胃癌组织及其配对癌旁组织进行了差异表达检测,发现较癌旁组织,LINC01133在胃癌组织中呈低表达,表明胃癌组织中LINC01133表达缺失,但是相关实验研究表明在胆囊癌和非小细胞肺癌,癌组织中LINC01133表达相对癌旁组织上调,表明了LINC01133的表达具有组织和器官的特异性,在不同器官肿瘤中特异性表达[13,20]。结合数据库的生存分析,高表达LINC01133的胃癌患者有更高生存率,说明LINC01133与胃癌预后相关。LINC01133表达具有抑制胃癌细胞增殖、迁移、侵袭和促进其凋亡的能力,在明确其表型及临床样本的表达意义后,就需要对其机制调控研究进行深入挖掘,以明确其作用机制。
首先,LINC01133具有抑制胃癌细胞增殖的能力,Wu等[11]研究发现LINC01133在胆囊癌组织转录水平显著高于相应的非肿瘤组织,促进肿瘤增殖,并激活AKT-mTOR,mTOR是PI3K-AKT下游的一种重要的丝氨酸-苏氨酸蛋白激酶,通过激活核糖体激酶来调节细胞增殖和存活,mTOR信号通路可影响基因转录及蛋白质合成,在细胞增殖中起重要作用。其次,LINC01133表达具有抑制胃癌细胞迁移和侵袭的能力,Kong等[12]发现LINC01133在结直肠癌细胞中相对癌旁组织低表达,作为抑癌基因,抑制结直肠癌细胞侵袭和转移,参与上皮间质转化,表达受到TGF-β信号通路抑制。TGF-β信号转导调控机制多种多样,TGF-β信号通路激活具有促癌作用,大多发生在癌症晚期,可通过促进肿瘤转移及细胞免疫逃逸,以及促进血管的产生发挥它的促癌作用,也可通过激活经典Smad通路和非经典Smad通路,来促进上皮间质转化,使得癌细胞向其他组织扩散。LINC01133抑制胃癌细胞迁移和侵袭作用可能与TGF-β信号通路的激活有关。
综上所述,LINC01133在胃癌组织中表达下调,LINC01133表达可抑制胃癌细胞增殖、迁移,促进细胞凋亡,在胃癌发展中发挥抑癌基因的作用,LINC01133低表达可能是胃癌患者的一个不良因素,有望成为胃癌诊断和治疗中新的研究靶点。
参考文献
[1] Bray F,Ferlay J,Soerjomataram I,et al.Global cancer statistics 2018[J].CA Cancer J Clin,2018,68(6):394-424.
[2] Torre L A,Bray F,Siegel R L,et al.Global cancer statistics,2012[J].CA Cancer J Clin,2015,65(2):86-108.
[3] Strand M S,Genetics of Gastric Cancer[J].Surg Clin North Am,2016,96(2):345-360.
[4] Chen W.Cancer statistics in China,2015[J].CA Cancer J Clin,2016,66(2):115-132.
[5] Ilson D H.Adjuvant treatment for gastric cancer:too much is not enough[J].Lancet Oncol,2014,15(8):688-689.
[6] Djebali S,Davis C A,Merkel A,et al.Landscape of transcription in human cells[J].Nature,2012,489(7414):101-108.
[7] Nagano T,Fraser P.No-nonsense functions for long noncoding RNAs[J].Cell,2011,145(2):178-181.
[8] Zhang J,Yao T,Wang Y,et al.Long noncoding RNA MEG3 is downregulated in cervical cancer and affects cell proliferation and apoptosis by regulating miR-21[J].Cancer Biol Ther,2016,17(1):104-113.
[9] Liu T,Xu M Y.Influence of long non-coding RNA on liver diseases and related mechanisms[J].Zhonghua Gan Zang Bing Za Zhi,2016,25(5):393-396.
[10] Niu Z S,Niu X J,Wang W H.Long non-coding RNAs in hepatocellular carcinoma:Potential roles and clinical implications[J].World J Gastroenterol,2016,23(32):5860-5864.
[11] Wu X S,Wang F,Li H F,et al.LncRNA-PAGBC acts as a microRNA sponge and promotes gallbladder tumorigenesis[J].EMBO Rep,2017,18(10):1837-1853.
[12] Kong J,Sun W,Li C,et al.Long non-coding RNA LINC01133 inhibits epithelial-mesenchymal transition and metastasis in colorectal cancer by interacting with SRSF6[J].Cancer Lett,2016,380(2):466-484.
[13] Zang C,Nie F Q,Wang Q,et al.Long non-coding RNA LINC01133 represses KLF2,P21 and E-cadherin transcription through binding with EZH2,LSD1 in non small cell lung cancer[J].Oncotarget,2016,7(10):11696-11707.
[14] Zhang J,Zhu N,Chen X.A novel long noncoding RNA LINC01133 is upregulated in lung squamous cell cancer and predicts survival[J].Tumour Biol,2015,36(10):7465-7471.
[15] Zeng H F,Qiu H Y,Feng F B.Long Noncoding RNA LINC01133 Sponges miR-422a to Aggravate the Tumorigenesis of Human Osteosarcoma[J].Oncol Res,2016,26(3):335-343.
[16] Sahu A,Singhal U,Chinnaiyan A M.Long noncoding RNAs in cancer:from function to translation[J].Trends Cancer,2015,1(2):93-109.
[17] Sun M,Nie F,Wang Y,et al.LncRNA HOXA11-AS Promotes Proliferation and Invasion of Gastric Cancer by Scaffolding the Chromatin Modification Factors PRC2,LSD1,and DNMT1[J].Cancer Res,2016,76(21):6299-6310.
[18] Sun M,Jin F Y,Xia R,et al.Decreased expression of long noncoding RNA GAS5 indicates a poor prognosis and promotes cell proliferation in gastric cancer[J].BMC Cancer,2014,14(1):319.
[19] Sun M,Xia R,Jin F,et al.Downregulated long noncoding RNA MEG3 is associated with poor prognosis and promotes cell proliferation in gastric cancer[J].Tumour Biol,2014,35(2):1065-1073.
[20] Hajjari M,Behmanesh M,Sadeghizadeh M,et al.Up-regulation of HOTAIR long non-coding RNA in human gastric adenocarcinoma tissues[J].Med Oncol,2013,30(3):670.
(收稿日期:2020-01-18) (本文編辑:田婧)

