荧光碳点的制备及银离子辅助的点亮型识别青霉胺
李玲芳 王 琦
(太原工业学院化学与化工系,太原 030008)
药品和个人护理产品(pharmaceuticals and personal care products,PPCPs)是日常生活中经常用到的一类化学产品,然而由于过度和不当的使用,它们近年来已经被列入了新型水污染物的行列[1]。药品污染往往通过尿液、排泄物、生活废水、污水、肥料等途径进入环境中[2],严重威胁着环境安全和人类健康[3]。D对映体形式的青霉胺(D-enantiomeric penicillamine,D-PA)是临床上治疗威尔逊氏病的关键药物,但是它同样能够引起一些如皮疹、溃疡、味觉失灵,甚至于免疫相关的血管炎等疾病[4,5]。因此,测定人体体液样品中的青霉胺含量具有重要意义。目前,测定青霉胺的方法主要有高效液相色谱法[6]、毛细管电泳法[7]、电化学传感方法[8]、化学发光法[9]、紫外可见吸收光谱法[10]和荧光光谱法[11-13]等。其中,荧光分析法由于其快速、灵敏、多样化的优点备受关注并广泛应用于青霉胺的测定。
碳点(carbon nanodots,CDs)是一种近年来备受关注的新型荧光材料。它具有优异的发光性能、抗光漂白、低毒性和高生物相容性,因此在光学传感领域表现出了优越性。碳点表面带有丰富的官能团,且易于后修饰,因此碳点能够构建出各种各样类型的传感模式,已经成功地应用于荧光检测金属离子[14]、阴离子[15]、生物小分子[16]等领域。同样地,诸如四环素[17]、诺氟沙星[18]、磺胺嘧啶[19]、甲硝哒唑[20]等药物也都能够通过碳点荧光识别。对于基于碳点的青霉胺荧光识别,科研人员也进行了大量的研究。Yuan等[21]通过水热法制备了荧光碳点并发现汞离子能够猝灭其荧光,随后基于汞离子和青霉胺的亲和力使得荧光恢复,由此建立了碳点-汞离子-青霉胺的荧光逻辑门模式来测定青霉胺。Ensafi等[22]从藏红花制备得到了碳点,并利用青霉胺与铜离子结合形成的配合物吸收碳点荧光的原理,基于内滤效应建立了测定青霉胺的荧光猝灭识别模式。Gunjal等[23]从水果壳制备得到了荧光碳点,并通过铁离子猝灭它的荧光,而加入青霉胺后,它能与铁离子结合使得荧光恢复,由此建立碳点-铁离子-青霉胺荧光开关识别模式。在这些报道中,研究人员都关键性地利用了青霉胺与金属离子强烈的配位作用[24],通过金属离子的辅助建立基于碳纳米点的荧光识别模式。
受上述工作启发,本工作从半胱氨酸出发,一步热解法制备了荧光碳点。尽管半胱氨酸作为前驱体制备碳点的工作已有所报道[25],但这些工作往往需要通过水热[26]、超声[27]或微波[28]等手段,设备复杂、耗时较长。我们通过一步热解法制备碳点,具有简便快速的优点。该碳点表现出了与银离子的结合趋势,使得后者通过光诱导的电子转移(photoinduced electron transfer,PET)有效地猝灭了碳点荧光。在此基础上引入青霉胺后,由于它与银离子强烈的结合作用,使得银离子离开碳点表面进而实现荧光恢复。由此建立了银离子辅助的碳点荧光点亮型识别模式测定青霉胺的新方法。银离子首次被用来构建荧光开关以识别青霉胺,这对于青霉胺的分析测定是一个有效的补充。
1 实验部分
1.1 试剂与仪器
L-半胱氨酸(99%)、D-青霉胺(98%)购自阿拉丁试剂有限公司;硝酸银(AR)购自麦克林试剂公司;氢氧化钠及其它试剂均为国产分析纯;实验用水为二次去离子水;尿液样品取自于健康的志愿者并且在测试前过滤稀释50倍。
所用仪器有JEM-F200型透射电子显微镜(日本JEOL公司);ZS90型激光纳米粒度仪(英国Malvern公司);XSAM 800型X射线光电子能谱仪(英国Kratos公司);F-7000荧光分光光度计(日本Hitachi公司);TU-1901型紫外-可见分光光度计(中国普析公司);FLS 1000型荧光光谱仪(英国Edinburgh公司)。
1.2 碳纳米点的合成方法
从半胱氨酸出发,通过热解法一步制备荧光碳点。首先,将1 g半胱氨酸固体粉末均匀平铺于烧杯底部并放置在加热器上,在300℃下加热5 min。在得到的棕黑色固体中加入4 mL 100 mg·L-1的氢氧化钠溶液浸泡30 min后,置于超声清洗机中分散。接着将获得的分散液以5 000 r·min-1离心10 min除去大颗粒,然后将获得的上清液装入截留分子量2 000 KDa的透析袋中在去离子水中透析24 h进一步纯化碳点溶液。最后,得到的碳点溶液保存在冰箱中用以后续的表征和测量。
1.3 荧光点亮型检测青霉胺
基于碳点-银离子体系的荧光点亮型检测青霉胺在中性条件下测定。将100 μL上述碳纳米点溶液加入到700 μL去离子水中,接着加入100 μL浓度为5 mmol·L-1的新鲜配制的银离子溶液,混匀后立即加入100 μL不同浓度的青霉胺溶液或去离子水(作为空白对照),混匀后立即测定其在360 nm激发下440 nm处的荧光强度。仪器狭缝宽度均设置为5 nm。所有灵敏度和选择性测试全部平行测定3次。
1.4 尿液样品的检测
尿液样品取自健康的志愿者。将100 μL样品加入到含有碳点溶液(100 μL)、银离子溶液(0.5 mmol·L-1)和已知浓度的标准青霉胺溶液(浓度分别为30.00、100.00、400.00 μmol·L-1)的去离子水中,保持最终体积为1 mL。混匀后测定所得样品溶液在360 nm激发下440 nm处的荧光强度,并计算其加标回收率。
2 结果与讨论
2.1 碳纳米点的表征
图1A所示为碳点的高分辨透射电子显微镜(HRTEM)图片。从图中可以观察到均匀分散的颗粒并且表现出球状的形貌,尺寸小于5 nm。插图为单个碳点的HRTEM图,图中并未观察到明显的晶格条纹,证明该碳点为无定型态。图1B所示为碳点溶液的动态光散射纳米粒度分布,结果表明该纳米颗粒的尺度分布在2.33~4.85 nm之间,平均粒度为3.12 nm。图1C所示为碳点溶液的紫外可见吸收光谱图,图中表明碳点在200~400 nm处表现出了宽的吸收(黑线),这是由于碳点的芳香结构中的π→π*电子跃迁和羰基氧原子上的n→π*电子跃迁引起的[29]。而单独的半胱氨酸(红线)并没有吸收。插图中黄色溶液即为制备所得的碳点溶液。图1D所示为该碳点溶液在不同波长的激发光下的荧光发射光谱,结果表明该碳点表现出了激发依赖的荧光发射性能,这个现象是由碳点的尺寸效应和发射位点的分布共同引起的,此类现象在先前的工作中也有所报道[30]。由图可知,碳点在360 nm的激发下在440 nm处有最为明显的荧光发射。上述结果表明,从半胱氨酸一步热解法制备得到的碳点表现出了优良的荧光性能,为其作为荧光探针进行分子识别奠定了基础。
为了研究半胱氨酸为前驱体制备的碳点的元素组成,我们测试了材料的X射线光电子能谱(XPS)。图2A所示为碳点的X射线光电子能谱全谱扫描图,图中明显地显示出了 C1s、N1s、O1s、S2s和S2p的特征峰,没有出现其他杂质峰,证明该碳点是由碳、氮、氧、硫元素组成。图2B所示为C1s的能谱图,图中拟合曲线表明材料中C有3种不同的结合状态,284.8、286.1、287.7 eV处明显的分峰分别对应于C=C、C-S、C=O/C-O的特征峰。图2C所示为O1s的能谱图,图中拟合曲线出现531.0和532.5 eV两个分峰,它们分别对应于C=O和C-O-H/C-O-C的特征峰。N1s的能谱(图2D)拟合曲线出现了399.2和400.2 eV两个分峰,它们对应于C-N-C和N-H特征峰。在S2p的能谱(图2E)的拟合曲线中,可以观察到163.1和163.9 eV两个分峰,它们分别对应于C-S/R-S-H和Ph-S的特征峰。上述结果证明了本方法制备的碳点的元素组成和结合形式。

图1 碳点的(A)HRTEM图(插图为单个碳点的HRTEM图)、(B)动态光散射粒度分布图、(C)紫外可见吸收光谱图(插图为制备所得的碳点溶液)和(D)不同激发波长下的荧光发射光谱图Fig.1 (A)HRTEM image(Inset:HRTEM of single CDs),(B)dynamic light scattering size distribution,(C)UV-Vis absorption spectrum(Inset:image of as-prepared CDs solution),and(D)fluorescence emission spectra under different excitation of as-prepared CDs

图2 碳点的XPS谱:(A)全谱、(B)C1s分谱、(C)O1s分谱、(D)N1s分谱和(E)S2p分谱Fig.2 XPS spectra of as-prepared CDs:(A)full scan,(B)C1s,(C)O1s,(D)N1s and(E)S2p
2.2 Ag+和D-PA对CDs荧光性能的影响
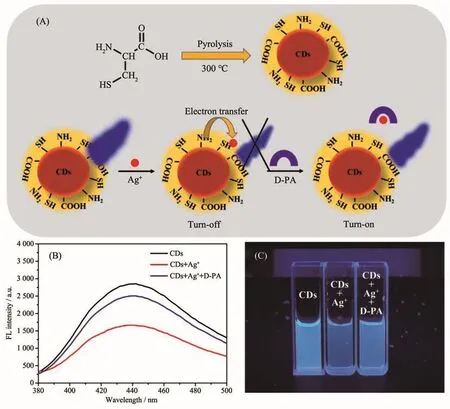
图3 (A)半胱氨酸制备碳纳米点和银离子辅助的碳点-银离子-青霉胺荧光开关示意图;(B)碳点(黑色)、碳点+银离子(红色)、碳点+银离子+青霉胺(蓝色)溶液的荧光发射光谱图;(C)碳点、碳点+银离子、碳点+银离子+青霉胺溶液在365 nm的紫外灯照射下的照片Fig.3 (A)Schematic illustration of synthesis of CDs and Ag+assisted CDs-Ag+-D-PA fluorescence switch;(B)Fluorescence spectra of CDs(black),CDs+Ag+(red)and CDs+Ag++D-PA(blue),respectively;(C)Photographs of CDs,CDs+Ag+and CDs+Ag++D-PA under UV(365 nm)illumination
图3A所示为半胱氨酸一步法热解制备碳点和银离子辅助的碳点-银离子-青霉胺荧光开关的示意图。有报道称,以半胱氨酸为前驱体制备的碳点表面富含巯基[31],得益于银离子与巯基之间的结合作用[32],银离子能够首先结合到碳点表面,通过光诱导电子转移有效地猝灭碳点的荧光;进一步引入青霉胺后,青霉胺分子与银离子配位结合,使得后者离开碳点表面,实现了碳点的荧光恢复。基于此,本工作建立了银离子辅助的碳点荧光点亮型识别青霉胺的模式。图3B所示为碳点(黑色)、碳点+银离子(红色)、碳点+银离子+青霉胺(蓝色)溶液在360 nm激发下的荧光发射光谱图。图中结果表明,银离子加入后引起了碳点荧光强度的降低,而继续加入青霉胺后,碳点的荧光又在一定程度下得以恢复。图3C所示为碳点、碳点+银离子、碳点+银离子+青霉胺溶液在365 nm的紫外灯照射下的照片。由图可知,碳点溶液发射出明亮的蓝色荧光,而加入银离子后,蓝色的荧光强度明显减弱,进一步加入青霉胺后蓝色又呈现出恢复的状态。上述结果表明,银离子加入碳点溶液后通过荧光猝灭实现“关”的状态,而青霉胺通过配位使得荧光恢复实现“开”的状态,由此建立基于碳纳米点的荧光开关。
为了研究荧光传感的机理,我们测试了碳点(黑色)、碳点+银离子(红色)、碳点+银离子+青霉胺(蓝色)溶液在440 nm处的时间分辨荧光衰减光谱(图4)。通过表1的拟合数据,我们可以看出碳点、碳点+银离子、碳点+银离子+青霉胺的荧光寿命分别是5.02、3.98、5.03 ns。结果表明,碳纳米点在加入银离子后荧光寿命有了明显的减小,而青霉胺加入后寿命又回到初始状态,此结论说明银离子对于碳点的荧光猝灭属于动态猝灭。有报道称,重金属离子能够通过光诱导电子转移猝灭碳点荧光,在此过程中,碳点和金属离子之间形成了一种可以返回基态但不发射光子的复合物[33]。因此,在本工作中,结合到碳点表面的银离子通过光诱导电子转移猝灭了碳点荧光。而青霉胺具有优异的与重金属离子配位的能力[24],它能够与银离子配位结合使得后者离开碳点表面,进而打断了猝灭剂与碳点之间的电子转移,使得碳点荧光实现恢复。因此,银离子辅助的碳点荧光点亮型识别青霉胺是由银离子光诱导电子转移和青霉胺配位作用共同来实现的。

图4 碳点(黑色)、碳点+银离子(红色)、碳点+银离子+青霉胺(蓝色)溶液在440 nm处的时间分辨荧光衰减光谱图Fig.4 Time-resolved fluorescence decay spectra at 460 nm from CDs(black),CDs+Ag+(red)and CDs+Ag++D-PA(blue),respectively
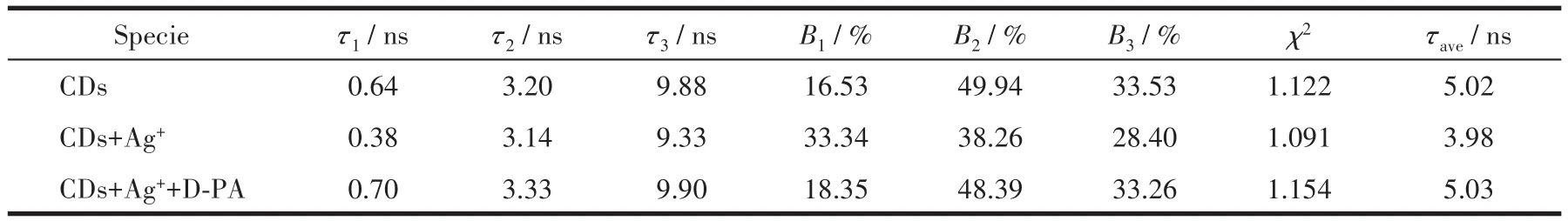
表1 多指数荧光衰减拟合参数Table 1 Parameters of multi-exponential fitting to the fluorescence decay
2.3 体系酸度对荧光识别青霉胺的影响
基于上述青霉胺响应的荧光恢复能力,将该银离子辅助的碳点荧光点亮型探针用于青霉胺的测定。由于银离子和青霉胺能够在室温下迅速引起碳纳米点荧光的改变,因此体系的酸度可能会是影响青霉胺测定的关键因素。考虑到银离子在碱性条件下会沉淀析出,我们考察了酸性和中性条件下不同pH值对此荧光开关的影响。图5A所示分别为碳点(黑色)、碳点+银离子(红色)、碳点+银离子+青霉胺(蓝色)溶液在不同pH值去离子水中的荧光强度。通过计算,图5B所示为不同pH值下的荧光恢复效率(ΔF/F0,ΔF为加入青霉胺前后 CDs-Ag+体系的荧光强度差值,F0为碳点初始的荧光强度)。结果表明,随着pH值增加,荧光恢复效率也逐渐提高,在pH=7处达到最佳。这是由于青霉胺的配位作用主要来源于氨基和巯基,在酸性条件下氨基质子化,孤电子对与氢离子配位,因此失去了与金属离子空轨道配位的能力,进而使得青霉胺与银离子的结合能力下降,最终导致了荧光恢复效率的减小。综上所述,荧光恢复效率在pH=7时达到最佳,因此我们后续测定青霉胺在中性条件下进行。
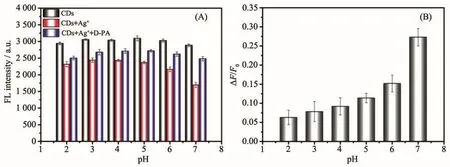
图5 (A)碳点(黑色)、碳点+银离子(红色)、碳点+银离子+青霉胺(蓝色)溶液在不同pH值下的荧光强度;(B)荧光开关在不同pH值下的荧光恢复效率(ΔF/F0)Fig.5 (A)Fluorescence intensity of CDs,CDs+Ag+and CDs+Ag++D-PA solutions under different pH values;(B)Fluorescence recovery efficiency(ΔF/F0)of the switch under different pH values
2.4 标准曲线及选择性
在上述最佳条件下,图6A所示为青霉胺浓度依赖的荧光线性响应。结果表明,碳点-银离子体系的荧光恢复效率与青霉胺的浓度在8~500 μmol·L-1的范围内呈现线性关系,线性方程为ΔF/F0=0.012 84+0.000 695 7c(R2=0.998 7),其中c为青霉胺浓度(μmol·L-1),检出限为 5.62 μmol·L-1(3σ)。图6B所示为碳点-银离子体系在不同浓度青霉胺存在时的荧光光谱,可以看出随着青霉胺浓度逐渐增加,荧光强度逐渐增强。进一步,我们研究了碳点-银离子荧光开关测定青霉胺的选择性。如图7所示,我们考察了一些可能共存的金属离子、代谢产物和氨基酸对体系荧光恢复效率的影响。由图中可知,除青霉胺表现出明显的荧光恢复之外,其他等浓度的干扰物并未对碳点产生荧光恢复,证明了该银离子辅助的碳点荧光开关对于青霉胺的识别具有良好的选择性。
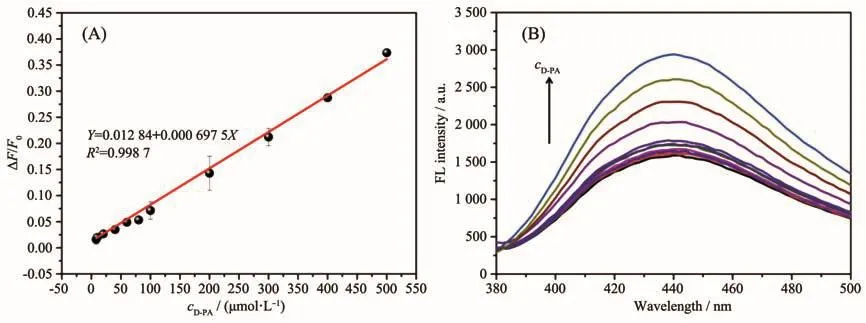
图6 (A)碳点-银离子荧光开关测定青霉胺的标准曲线;(B)碳点-银离子体系在不同浓度的青霉胺存在时的荧光光谱Fig.6 (A)Linear calibration plot for D-PA detection using CDs-Ag+fluorescent switch;(B)Fluorescence spectra of CDs-Ag+system with different concentrations of D-PA

图7 碳点-银离子荧光开关测定青霉胺的选择性Fig.7 Selectivity of CDs-Ag+fluorescent switch for D-PA detection
此外,我们对比了本工作与其他金属离子辅助识别青霉胺的方法。如表2所示,该银离子辅助的荧光开关方法,在具有较低检出限的同时,具有较宽的线性范围。这证明该方法具有一定的优势,对青霉胺的分析方法是一个有效的补充。
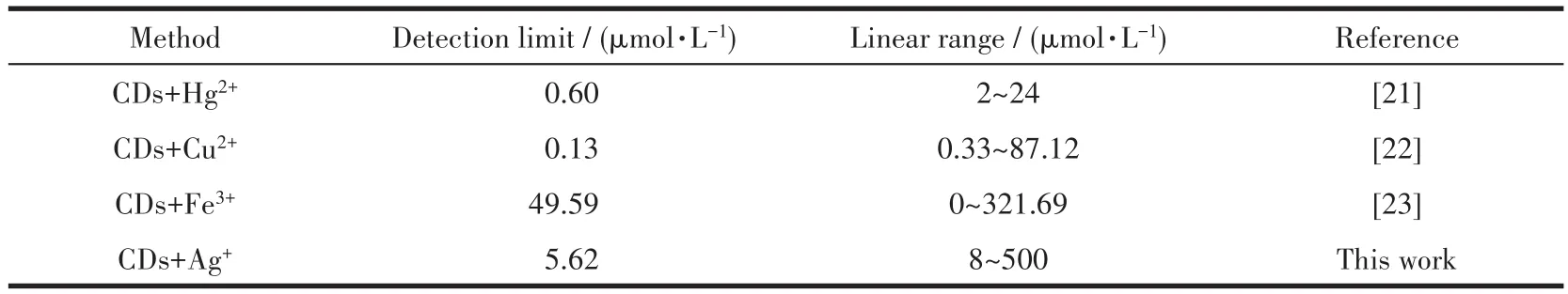
表2 本工作与其他金属离子辅助识别青霉胺方法的对比Table 2 Comparison of this work with other metal ions assisted methods for D-PA recognition
2.5 实际样品测定
上述结果表明,该银离子辅助的碳点荧光开关具有检测实际样品中青霉胺含量的能力。我们选取了健康志愿者的尿液作为测定样品。表3记录了测定结果,可以看出样品的加标回收率处在97.17%~102.05%之间。该结果证明了碳点-银离子荧光开关在实际样品中测定青霉胺具有可靠性。
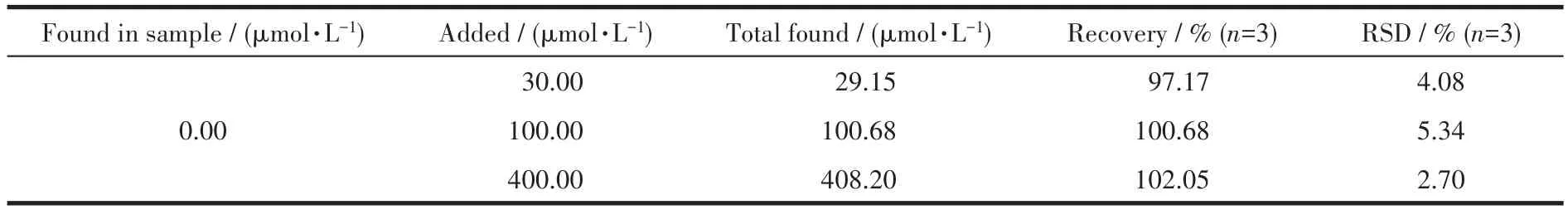
表3 尿液样品中青霉胺含量的测定Table 3 Determination of D-PA in human urine sample
3 结论
从半胱氨酸出发,通过一步热解法制备得到荧光碳点。银离子能够结合到碳点表面通过光诱导的电子转移猝灭碳点荧光,进一步引入青霉胺后,由于青霉胺和银离子的配位作用,银离子离开碳点表面实现荧光恢复,基于此建立了荧光点亮型探针识别青霉胺,并成功应用于实际样品测定。本方法具有灵敏度高、选择性好的优点,并且银离子是首次用于构建基于碳点的荧光开关识别青霉胺,对青霉胺的荧光分析是一个有效的补充。

