土霉素对斜生栅藻的毒性效应研究
武鹏鹏,王雅学,沈洪艳,*
1. 河北科技大学环境科学与工程学院,石家庄 050018 2. 河北省药用分子化学重点实验室,石家庄 050018
四环素类抗生素是目前使用量最大的一类人畜共用药物,每年用量占中国抗生素使用总量的14%左右[1-2]。四环素类抗生素是由放线菌产生的一类广谱抗生素,被大量用于促进动物生长的促进剂及人和动物的感染性疾病的治疗[3-5]。土霉素是其中使用量最大的一种,被添加到家畜饲料中预防疾病和促进家畜生长。抗生素类药物在动物体内很难吸收,30%~90%通过动物尿便以母体或代谢产物的形态排出体外后进入环境中[6]。由于四环素类抗生素过量使用,在环境中出现了“假持久性”现象,并引起了一系列的生态环境污染问题[7]。Kümmerer[8]发现人或动物体排出的大量抗生素通过各种途径最终进入水环境,并对水生生物造成危害[9]。有研究表明,美国地表水中土霉素检出浓度为340 ng·L-1[10],巴西水产水域中土霉素检出浓度为14~7 993 ng·L-1 [11],我国水体中抗生素检出浓度已达到μg级甚至mg级[12-13],安徽汪洋河水体中土霉素检出浓度为3.6×105ng·L-1[14]。
很多学者研究了土霉素的毒性效应,土霉素对鱼腥藻和铜绿微囊藻的生长繁殖具有一定的抑制作用,6~90 mg·L-1的土霉素对铜绿微囊藻的叶绿素a表现为抑制作用,且浓度越高抑制作用越强[15-16]。赵素芬和曹日波[17]研究了不同浓度土霉素对湛江等鞭金藻的细胞数量、叶绿素含量和类胡萝卜素含量的影响,发现0~10 mg·L-1的土霉素随着浓度的增加,金藻的细胞数量在生长期增幅越小,在衰退期衰退越快,且叶绿素a含量越少,而类胡萝卜素含量增加。田智宇等[18]发现,当土霉素废渣中含量为25~50 mg·kg-1时,对黄瓜种子发芽和幼苗生长有促进作用,超过100 mg·kg-1对黄瓜种子和幼苗表现出显著性抑制作用。土霉素废水对斑马鱼会造成氧化损伤,并进一步损伤DNA[19-20]。斑马鱼暴露于青土霉素废水时,斑马鱼超氧化物歧化酶(superoxide dismutase, SOD)和丙二醛(malondialdehyde, MDA)发生了显著性变化,在第8天斑马鱼受到了明显的氧化损伤[21]。因此,土霉素的生态环境效应需进一步关注。
单细胞藻类是水生生态系统食物链的起点,对整个生态系统影响较大,并且具有易获得、繁殖快和对环境敏感等特点,被广泛应用于毒理学试验,其中,斜生栅藻(Scenedesmusobliquus)是国际化标准组织(ISO)认可的试验模式生物之一,也是我国环境监测试验藻种[22],所以,学者们把斜生栅藻应用于对抗生素毒理学研究中,通过暴露实验,从斜生栅藻的生化指标变化情况来衡量抗生素的毒性效应。
本研究,以土霉素为试验对象,以斜生栅藻为模式生物,通过研究土霉素对斜生栅藻生长抑制以及对叶绿素a含量、SOD活性、MDA含量和活性氧(reactive oxygen species, ROS)含量的影响,来探究土霉素对斜生栅藻的毒性效应机制,为评估土霉素对藻类的环境风险提供一定的科学依据。
1 材料与方法(Materials and methods)
1.1 实验材料
土霉素(oxytetracycline dihydrate)购买自上海阿拉丁生化科技股份有限公司,CAS6153-64-6,纯度为97%,分子式为C22H24N2O9·H2O。
取适量土霉素,溶解在BG-11培养基中,搅拌使其充分溶解以获得1 g·L-1的母液,用倍数稀释法稀释母液以获得土霉素工作溶液(0、2、4、10、20和40 mg·L-1)备用。
本实验选用的斜生栅藻(Scenedesmusobliquus)株系购买自中国科学院淡水藻种库,编号FACHB-12。实验期间严格按照经济合作与发展组织(OECD)发布的OECD 201藻类生长抑制实验方法中的暴露实验质量控制措施进行,要求实验进行无菌操作,将斜生栅藻培养在人工气候培养箱(PRX-250B,宁波赛福实验仪器有限公司,中国)中,温度(25±1) ℃,湿度60%,光照强度为12 000 LX,光照周期为14 h昼∶10 h夜,每天人工摇荡至少3次,多次反复接种,使其处于对数生长期。
1.2 实验方法
在无菌条件下,按照OECD 201藻类生长抑制实验方法,选取生长状态良好的斜生栅藻进行实验,初始藻液浓度为1×106个·mL-1,实验溶液由藻液和土霉素工作溶液配制(V藻液∶V工作溶液=1∶1),最终实验溶液浓度为0、1、2、5、10和20 mg·L-1,每个浓度设3个平行组。
1.2.1 藻细胞生长量的测定
本实验建立了斜生栅藻细胞密度与吸光度之间的线性方程,拟合优度R2>0.99,将藻细胞暴露在不同浓度的土霉素中96 h,每24小时测定各浓度组在685 nm处的吸光度,进而获得藻密度。
1.2.2 叶绿素a含量的测定
各浓度组取5 mL藻液,6 000 r·min-1离心15 min,并用预冷的磷酸盐缓冲液(PBS)(0.01 mol·L-1,pH=7.3)清洗3次,去除上清液,加入5 mL体积分数为95%的乙醇在75 ℃水浴锅中水浴3 min。再次离心后用紫外分光光度计测定在665 nm和649 nm处吸光度,并依据公式进行计算[23]:
ca=13.95A665-6.88A649
1.2.3 粗酶液的提取
各浓度组取10 mL藻液,6 500 r·min-1离心15 min,用预冷的PBS清洗3次,用10 mL PBS再次悬浮藻细胞,在冰水浴下用超声波细胞破碎仪(BILON92-IIDL,上海比朗仪器制造有限公司,中国)破碎10 min,设置功率95%,工作8 s,间隔3 s,细胞破碎后,在4 ℃下以10 000 r·min-1离心10 min,上清液为粗酶液。
1.2.4 ROS、SOD和MDA的测定
ROS采用DCFH-DA(2,7-dichlorofuorescin diacetate)活性氧探针,用多功能酶标仪(Synergy H1,美国伯腾仪器有限公司)在激发波长485 nm、发射波长525 nm下测定;SOD采用黄嘌呤氧化酶法[24]测定;MDA采用硫代巴比妥酸(TBA)比色法[25]测定;以上测定均严格按照南京建成生物工程研究所试剂盒说明书操作。
1.2.5 数据处理
统计结果用平均值±标准偏差(Mean±SD)表示。用SPSS 24对数据进行单因素方差分析(One-way Anova),并进行显著性差异分析及t检验,P<0.05,表示差异显著,使用Origin 2017绘图。
2 结果(Results)
2.1 土霉素对斜生栅藻生长的影响
通过血球计数板计数得斜生栅藻细胞浓度(y)与其在685 nm下测得的吸光度(x)的线性回归方程为y= 78.398x-9.257(R2= 0.9956)。用不同浓度的土霉素分别处理藻液,以藻细胞密度为纵坐标,暴露时间为横坐标绘制生长曲线,如图1所示。

图1 土霉素对斜生栅藻生长的影响Fig. 1 Effects of oxytetracycline hydrochloride on the growth of Scenedesmus obliquus
由图1可知,在所测浓度范围的土霉素的胁迫下,各浓度组斜生栅藻生长均受到抑制作用,并且随着时间的延长,生长抑制越明显;斜生栅藻在96 h生长抑制最为严重,1、2、5、10和20 mg·L-1的土霉素对斜生栅藻的抑制率分别达到了15.5%、17.8%、25.8%、25.7%和44.4%。经SPSS软件计算可知,土霉素对斜生栅藻96 h半数效应浓度(96 h-EC50)为21.3 mg·L-1,无可见效应浓度(NOEC)为2 mg·L-1,最低可观察效应浓度(LOEC)为5 mg·L-1。
2.2 土霉素对斜生栅藻叶绿素a含量的影响
叶绿素a是植物进行光合作用的重要参数之一,植物通过光合作用产生自身需要的能量和有机物,其浓度变化能够直接影响植物生物量的变化,并且可以间接反映植物生长繁殖情况[26]。图2为土霉素对斜生栅藻叶绿素a含量的影响,由图2可知,土霉素对斜生栅藻叶绿素a含量的影响与其对斜生栅藻生长的影响呈现相似的变化规律,96 h内,随时间延长,各浓度组叶绿素a含量均有增长,但随暴露浓度的增加,叶绿素a受到的抑制作用也越来越明显,表现出了一定的剂量-效应关系。24 h时,各浓度组与对照组相比,叶绿素a含量无明显差异;72 h时,1 mg·L-1和2 mg·L-1浓度组表现出了短暂的促进作用;在96 h时,2 mg·L-1浓度组与对照组相比表现出了显著性差异(P<0.01),5、10和20 mg·L-1浓度组表现出了显著抑制(P<0.001),叶绿素a含量分别下降了24.2%、21.7%和28.9%。
2.3 土霉素对斜生栅藻SOD活性的影响
SOD属于金属酶,是唯一以自由基为底物的抗氧化酶,在清除过量活性氧自由基、控制膜脂质过氧化水平及减轻膜氧化损伤过程中,发挥着至关重要的作用[27-28]。土霉素对斜生栅藻SOD活性的影响如图3所示,各浓度组斜生栅藻SOD活性与对照组相比,除1 mg·L-1浓度组略微升高外,其他浓度组均表现为抑制作用;1 mg·L-1浓度组达到实验期间最大值675.96 U·mg-1prot,2、10和20 mg·L-1浓度组实验期间受到显著抑制(P<0.05),20 mg·L-1浓度组达到最低值,比对照组低38.8%。这可能是由于10 mg·L-1和20 mg·L-1的土霉素对斜生栅藻造成了严重的氧化损伤,并且抑制了SOD酶的合成。
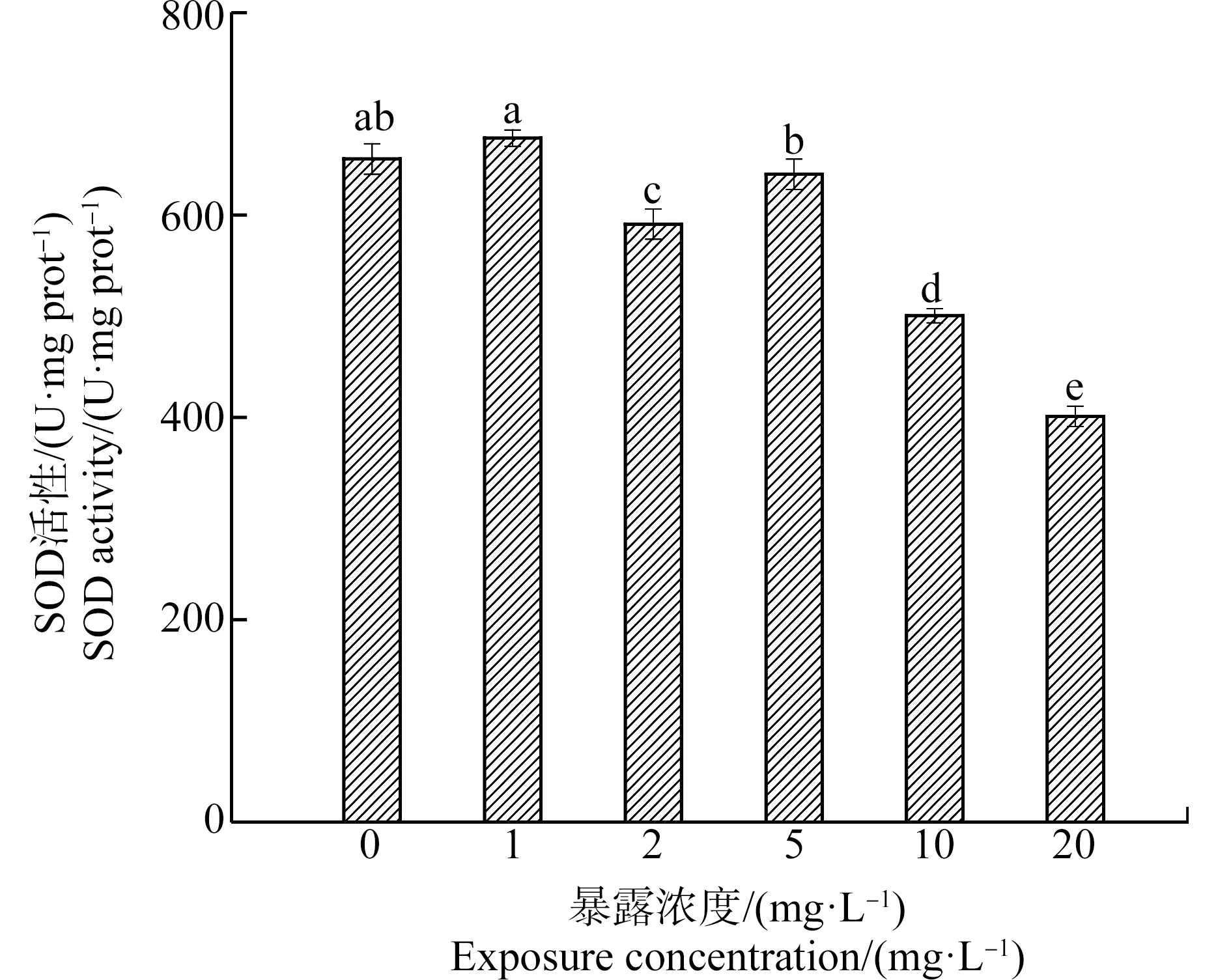
图3 土霉素对斜生栅藻超氧化物歧化酶(SOD)活性的影响注:字母相同表示不同浓度组间差异不显著,字母不同表示不同浓度组间差异显著;下同。Fig. 3 Effects of oxytetracycline hydrochloride on the superoxide dismutase (SOD) activity of Scenedesmus obliquusNote: The same letters indicate no significant difference among different concentration groups; different letters indicate significant differences among different concentration groups; the same below.
2.4 土霉素对斜生栅藻MDA含量的影响
MDA是自由基与生物膜中的多不饱和脂肪酸(polyunsaturated fatty acid, P-UFA)发生脂质过氧化作用形成的脂质过氧化物[29];它可与生物膜上的蛋白质氨基酸残基或核酸反应生成席夫碱,降低生物膜的稳定性[30-32]。MDA含量可以反映出膜脂的过氧化程度,也是反映生物氧化损伤的代表性指标[33]。土霉素对斜生栅藻MDA含量的影响如图4所示。MDA含量随着土霉素浓度的增加呈现出上升的趋势;1 mg·L-1和2 mg·L-1浓度组与对照组相比MDA含量无显著性差异,这表明斜生栅藻的抗氧化系统能够清除该浓度下土霉素的氧化胁迫;5、10和20 mg·L-1浓度组与对照组相比MDA含量受到了显著性诱导(P<0.05),MDA含量分别为对照组的1.5倍、2.2倍和3.2倍,表明斜生栅藻细胞已经受到了一定程度的氧化损伤。
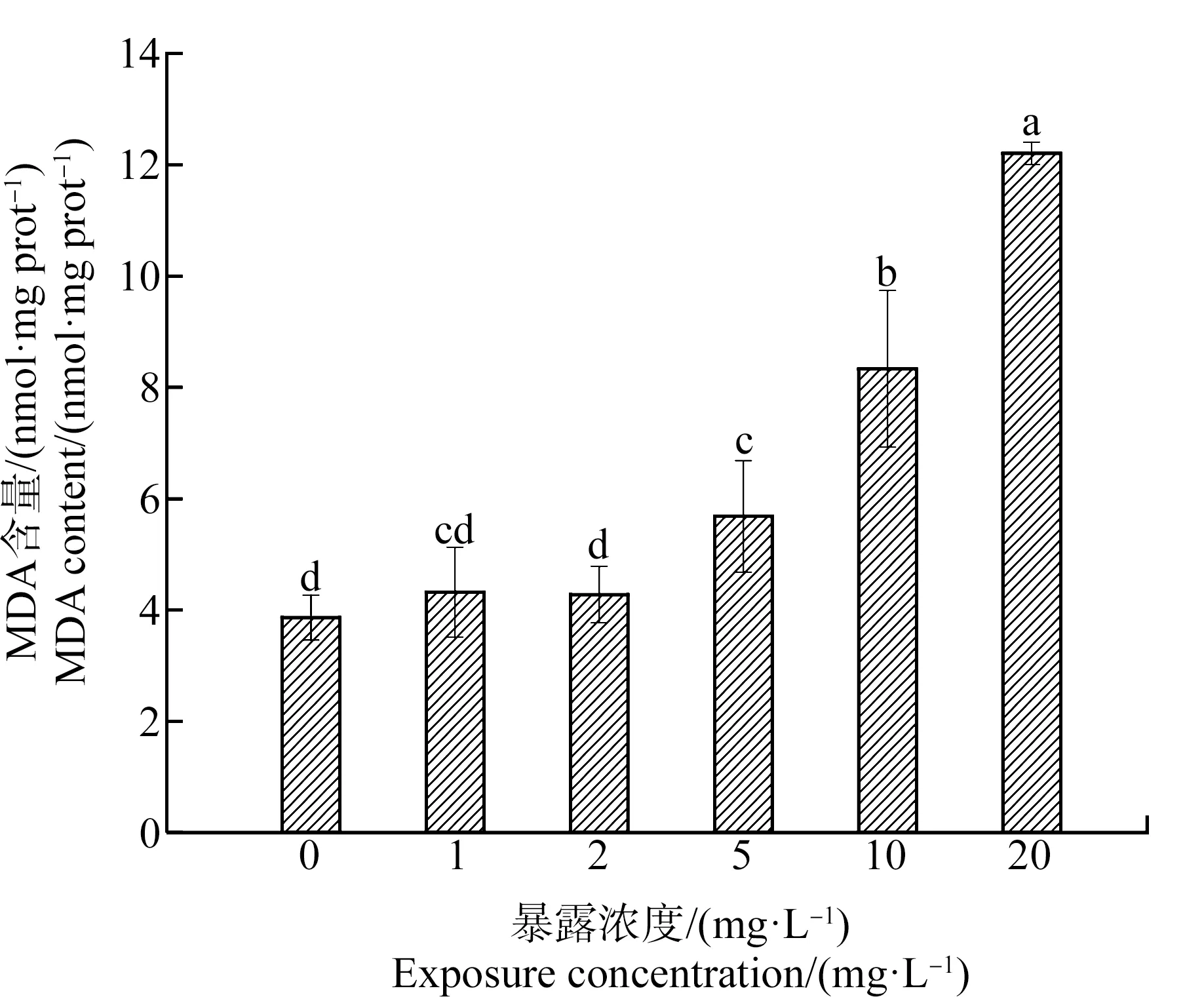
图4 土霉素对斜生栅藻丙二醛(MDA)含量的影响Fig. 4 Effects of oxytetracycline hydrochloride on the malondialdehyde (MDA) content of Scenedesmus obliquus
2.5 土霉素对斜生栅藻ROS的影响
ROS是分子氧在还原过程中的一系列中间产物,其生成和清除在正常生命过程中维持着动态平衡,细胞内的ROS被控制在很低水平,在抗菌消炎方面起着重要作用[34]。但当外源污染物入侵时,ROS生成快速增加,导致氧化应激和抗氧化系统平衡失调,造成细胞氧化损伤[35]。土霉素对斜生栅藻ROS的影响如图5所示。1 mg·L-1和2 mg·L-1浓度组与对照组相比ROS无显著性变化(P>0.05),表明细胞内抗氧化酶大量合成,抵消了大部分过量的ROS;5 mg·L-1浓度组与对照组相比ROS受到显著抑制(P<0.05),可能是由于藻细胞内抗氧化酶为抵消氧化应激,过量消耗了ROS;10 mg·L-1浓度组与对照组相比无显著性差异,但ROS水平略微偏高;20 mg·L-1浓度组与对照组相比ROS受到显著性诱导(P<0.01),ROS水平为对照组的1.2倍,表明土霉素在藻细胞膜内产生了大量的ROS,并对藻细胞造成氧化损伤,藻细胞无法合成足够的抗氧化酶来清除过量ROS。
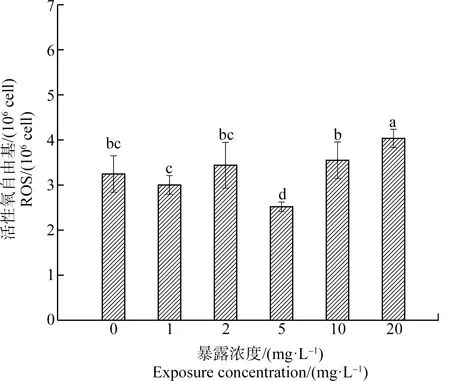
图5 土霉素对斜生栅藻活性氧(ROS)的影响Fig. 5 Effects of oxytetracycline hydrochloride on the reactive oxygen species (ROS) of Scenedesmus obliquus
3 讨论(Discussion)
在本实验中,不同浓度的土霉素暴露对斜生栅藻表现出了一定的“剂量-效应”和“时间-效应”关系。本实验所设定土霉素浓度对斜生栅藻均表现出抑制作用,并且随着时间的延长,土霉素对斜生栅藻的抑制作用越明显,余彬彬等[36]将玉米幼苗暴露于土霉素时发现了同样的现象,各浓度组中土霉素对玉米幼苗总根长均表现为抑制作用;刘永涛等[37]用不同浓度的强力霉素处理斜生栅藻时发现,在2 mg·L-1浓度组表现为促进作用,高于2 mg·L-1浓度组表现为抑制作用,许多学者发现抗生素具有“Hormesis”现象[38],本研究未发现此现象可能是因为土霉素毒性比强力霉素强,只有当土霉素浓度非常低时才会出现“促进”现象发生。本实验结果表明,随着土霉素浓度的增加,斜生栅藻受到的生长抑制作用越明显,20 mg·L-1土霉素表现为显著性抑制,张迪等[7]研究金霉素及其异构体降解产物对斜生栅藻毒性时,也发现了明显的“剂量-效应”关系,抗生素对细胞壁、细胞膜结构具有一定的破坏能力[39-40],可能土霉素浓度越高对斜生栅藻细胞壁和细胞膜会造成更大的损伤。已有报道显示,土霉素对铜绿微囊藻的96 h-EC50为7.2 mg·L-1 [41],对小麦种子的EC50为54.2 mg·L-1 [42],本研究中土霉素对斜生栅藻96 h-EC50为21.3 mg·L-1。
叶绿素a是叶绿素中的重要组成部分,叶绿素a的含量可以直接反映藻细胞的光合作用效率,并且与藻细胞量呈正相关[43]。吴妹英[16]在研究土霉素对铜绿微囊藻繁殖的影响时发现,铜绿微囊藻的叶绿素a含量与生长量变化一致。鲍洁等[44]研究盐酸恩诺沙星对斜生栅藻的影响时,也发现叶绿素a含量与生物量有相同的关系,且叶绿素a在污染物胁迫下受到抑制作用。本研究得到了相似的结果,斜生栅藻在土霉素的胁迫下,叶绿素a受到了明显的抑制作用,对比生长曲线可知,叶绿素a含量与藻细胞浓度呈现正相关关系;这可能是由于土霉素损害了藻细胞膜结构及胞内叶绿体等细胞器,从而影响了光合色素的合成,斜生栅藻光合作用降低,从而抑制藻细胞繁殖[45]。
图6为机体氧化指标关系图,正常机体内自由基的代谢处于动态平衡状态[46],但当受到污染物入侵时,机体内ROS会大量生成,SOD是避免机体受到氧化损伤的第一道防线,SOD可以催化氧自由基反应生成H2O2和O2[47],之后再经过其他抗氧化酶作用进一步消除,当机体的抗氧化系统无法清除过量ROS时,就会造成机体的氧化损伤,发生脂质过氧化反应生成MDA。本研究中,斜生栅藻在土霉素的胁迫下,ROS水平随着浓度增加而升高,藻细胞抗氧化系统无法完全清除高浓度土霉素(10 mg·L-1和20 mg·L-1)胁迫下机体产生的自由基,造成SOD活性降低,这也可能是藻细胞受到氧化损伤导致无法正常合成SOD;因此,过量的ROS造成了斜生栅藻MDA含量的升高;张迪等[7]研究金霉素对斜生栅藻的影响时发现了同样的规律,并得出SOD与ROS呈现正相关关系,沈洪艳等[48-49]分别用诺氟沙星和环丙沙星处理锦鲤,也同样发现了随着暴露浓度的升高,SOD活性受到了抑制,而随着暴露浓度的升高,MDA受到了诱导作用。喻燚等[50]研究4-壬基酚对拟柱胞藻影响时,发现SOD活性变化规律与本研究相反,这可能是由于4-壬基酚对拟柱胞藻毒性较小,未造成胞内损伤,为应对氧化应激,促进了藻细胞合成SOD。
综上所述,土霉素对斜生栅藻生长及光合作用水平具有明显抑制作用;10 mg·L-1和20 mg·L-1土霉素造成藻细胞ROS水平升高,大量消耗SOD,且造成了细胞氧化损伤,导致SOD合成受阻,从而活性降低,过量ROS也造成了细胞生物膜的膜脂质过氧化,使得MDA含量升高。因此,10 mg·L-1和20 mg·L-1土霉素会对斜生栅藻造成氧化损伤,具体致毒机制需要进一步研究。
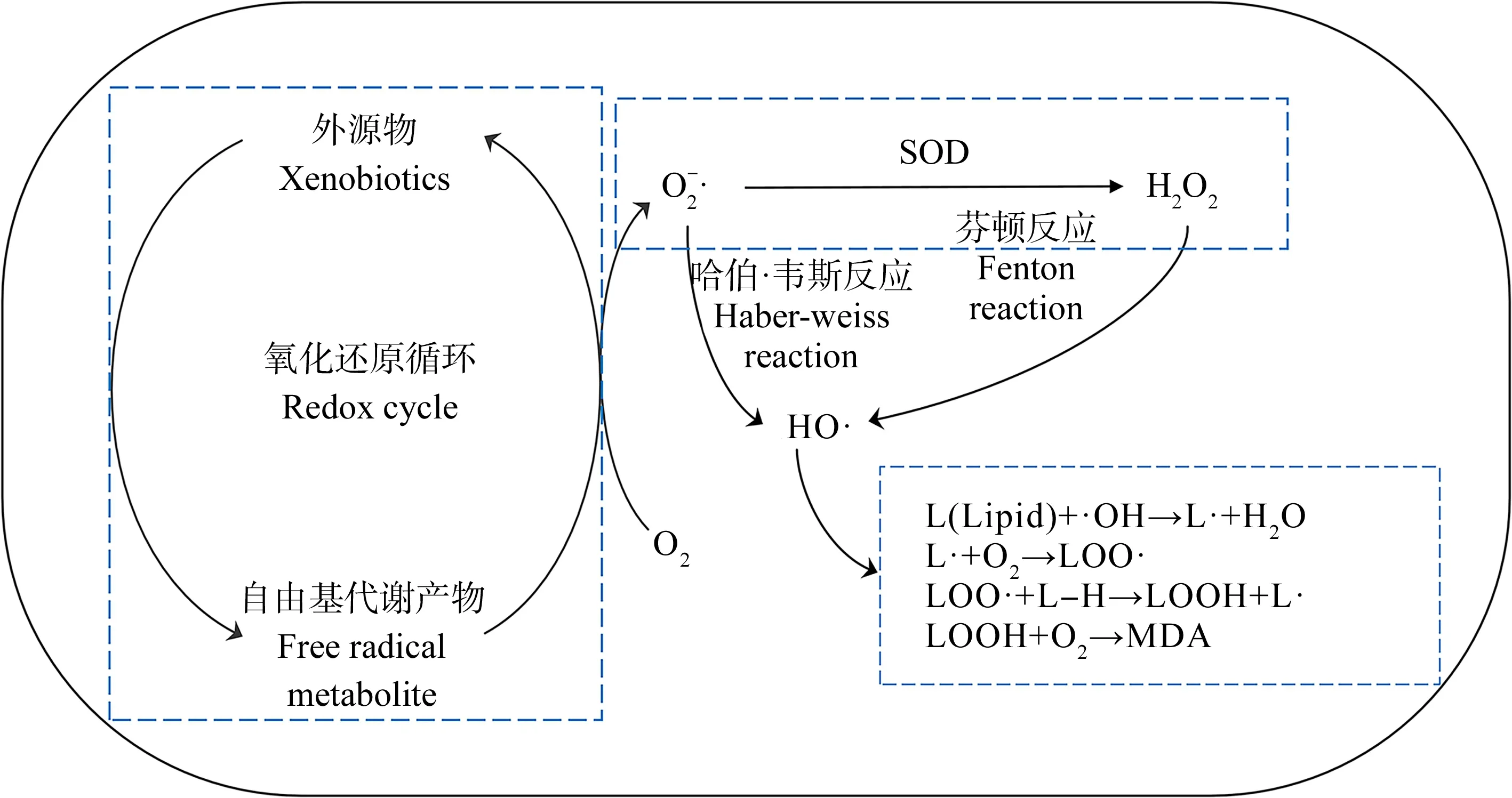
图6 氧化指标关系图Fig. 6 Relationship diagram of oxidation index
◆

