c-kit在原发性女性生殖道恶性黑色素瘤治疗及预后中的作用:现状与展望
复旦大学附属肿瘤医院妇瘤科,复旦大学上海医学院肿瘤学系,上海200032
原发性女性生殖道恶性黑色素瘤(primary female genital tract malignant melanoma,PFGMM)是一种罕见的且预后较差的疾病,其年发病率为1.6/105~1.8/105[1-2],占恶性黑色素瘤的1%~2%[3],占黏膜恶性黑色素瘤的18%[4-5]。该疾病76.7%起源于外阴,5.0%~20.0%起源于阴道,较少起源于宫颈[6],宫颈恶性黑色素瘤目前报道的不足100例[7-9]。与皮肤恶性黑色素瘤相比,女性生殖道恶性黑色素瘤预后较差,外阴恶性黑色素瘤5年生存率为30%~58%[6,9],阴道恶性黑色素瘤为10%~27%[6,9-11],宫颈恶性黑色素瘤约为10%[12]。
由于该疾病较为罕见,目前尚无推荐的治疗方案。早期患者主要以手术治疗为主,晚期或复发转移的患者可考虑化疗,但疗效欠佳[12],新的靶向治疗及免疫治疗方案值得探索。前期研究表明,包括PFGMM在内的黏膜恶性黑色素瘤与皮肤恶性黑色素瘤发病机制显著不同,前者c-kit基因改变较多,而后者主要发生BRAF基因V600E区域突变[6]。c-kit基因突变或扩增可能与恶性黑色素瘤发生、发展、增殖和迁移相关[13]。因此,c-kit有望成为PFGMM治疗的新靶点。
在皮肤恶性黑色素瘤中,针对BRAF基因V600E 区域突变靶向抑制剂威罗非尼(vamurafenib、达拉非尼(dabrafenib)以及下游分子MEK的抑制剂曲美替尼(trametinib)、考比替尼(cobimetinib)在晚期/复发转移患者中已取得良好的治疗效果,并已获美国食品药品管理局(Food and Drug Administration,FDA)批准上市[14]。但令人遗憾的是,PFGMM相关靶向治疗的临床试验尚未开展。本文将简要介绍c-kit基因改变对PFGMM发生、发展、预后的影响并简要总结c-kit抑制剂在黏膜恶性黑色素瘤中靶向治疗的研究现状。
1 c-kit基因的结构和功能
c-kit基因定位于人染色体4q12-13,其编码产物为Ⅲ型跨膜受体酪氨酸激酶(receptor tyrosine kinase,c-kit),1937年由Yarden和Woodman首次发现。c-kit蛋白包括5个结构域:糖基化细胞外配体结合域,包含5个免疫球蛋白样重复序列,由外显子1~9编码;疏水性跨膜结构域,由外显子10编码,一个由细胞内片段组成的近膜结构域,由外显子11编码;两个细胞内酪氨酸激酶结构域,被激酶插入片段隔开,由外显子12~21编码。近膜结构域起到自身抑制的作用,在无配体结合时,可阻止c-kit蛋白自身活化。当干细胞生长因子等配体与细胞外糖基化配体结合位点结合时,通过跨膜信号传递,c-kit细胞内酪氨酸激酶结构域发生自体二聚化及自身磷酸化,激活MAP/MEK/ERK、PI3K/AKT、JAK/STAT等细胞生长通路。功能性研究表明,c-kit蛋白所介导的生长通路在生殖细胞、肥大细胞、造血干细胞、黑色素母细胞及分化的黑色素细胞的生长中发挥着重要作用[15-17]。
2 c-kit基因与恶性黑色素瘤
c-kit基因在黑色素瘤发生、发展过程中的作用尚存在争议。早期研究认为,c-kit基因可能是一种抑癌基因。1994年,Gutman等[18]在异种移植的黑色素小鼠模型中证实c-kit基因缺失与黑色素瘤的迁移能力有关。在c-kit缺陷黑色素瘤的裸小鼠中,外源性c-kit蛋白过表达可减慢肿瘤生长的速度并促进细胞凋亡。同时,体外细胞实验表明c-kit可抑制黑色素瘤细胞系A375SM的增殖和转移[19]。2015年,Dahl等[20]从表观遗传学的角度揭示了c-kit基因启动子高度甲基化可能是皮肤恶性黑色素瘤中c-kit蛋白表达缺失的原因。
分子水平研究揭示了黑色素瘤中可能存在c-kit基因改变。Went等[21]对39例原发性黑色素瘤患者进行c-kit蛋白免疫组织化学分析及基因突变分析,63%黑色素瘤患者c-kit蛋白正常表达,并对其中2例患者进行c-kit基因突变分析,发现有1例存在c-kit基因点突变。Curtin等[22]对126例不同部位的黑色素瘤进行大样本测序,结果显示,c-kit基因突变可能与黑色素瘤的部位有关,非皮肤恶性黑色素瘤发生c-kit基因扩增的概率高于皮肤恶性黑色素瘤。随后,Curtin等[23]对100多例不同部位的黑色素瘤患者进行二代测序,结果显示,c-kit基因点突变在黏膜恶性黑色素瘤中的概率为39%,在肢端恶性黑色素瘤为36%,在慢性光损伤的皮肤恶性黑色素瘤为28%,而在非慢性光损伤的恶性黑色素瘤为0%。他们发现皮肤恶性黑色素瘤中也可能存在c-kit基因突变,而不仅仅是c-kit蛋白表达缺失,c-kit基因突变频率与发病部位有关,相较而言,黏膜恶性黑色素瘤中c-kit基因突变频率较其他部位高。
为进一步探索c-kit基因突变在黑色素瘤发生、发展及迁移中的作用,Alexeev等[13]对黑色素瘤细胞中c-kit基因位点D814Y进行定点突变后发现,该位点突变对黑色素瘤细胞的形成和细胞增殖无明显影响,仅对黑色素瘤的迁移有作用。Monsel等[24]研究发现,c-kit基因K642E和L576P点突变主要激活PI3K通路,但对Ras/Raf/MEK/ERK生长通路的激活较弱。而在低氧环境或缺氧诱导因子1α(hypoxia-inducible factor 1α,HIF1α)共表达时,可显著激活生长通路,促进黑色素瘤细胞的增殖,提示c-kit基因突变在黑色素瘤中的作用可能与肿瘤微环境有关。目前未见c-kit基因改变与PFGMM发病机制研究的报道,尚需进一步的研究揭示两者之间的关系。
3 c-kit基因突变情况
研究表明黏膜恶性黑色素瘤c-kit基因突变频率约为21.8%,且突变位点主要集中于外显子11和外显子13区域,以外显子11的L576P区域和外显子13的K642E最为常见。在PFGMM中,c-kit基因突变频率约为18.5%。值得注意的是,部分黏膜恶性黑色素瘤患者虽未检测出c-kit基因突变,但仍存在c-kit基因异常扩增或拷贝数增加,该特点在黏膜恶性黑色素瘤研究中的意义尚不明确(表1)。有研究认为c-kit基因突变多与黑色素瘤雀斑样生长模式有关,可呈垂直浸润生长[25],这可能是导致其预后较差的原因。
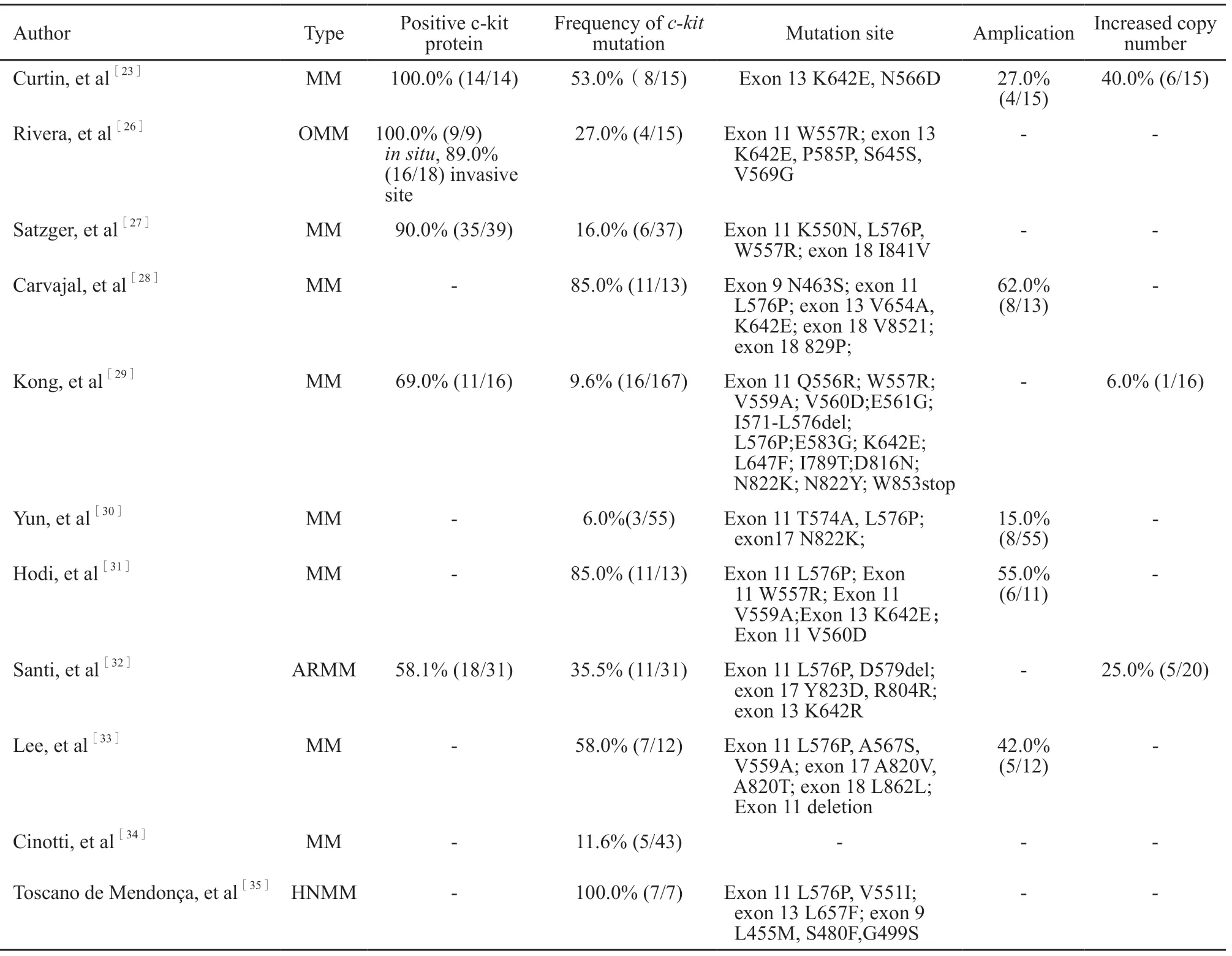
表1 不同亚型黏膜恶性黑色素瘤c-kit基因改变情况Tab.1 C-kit gene alterations in different subtypes of mucosal melanoma
同时,研究发现,PFGMM中外阴恶性黑色素瘤与阴道恶性黑色素瘤c-kit基因突变频率也有所不同。外阴恶性黑色素瘤c-kit基因突变频率约为22.7%(35/154),而阴道恶性黑色素瘤c-kit基因突变频率约为7.7%(4/52),两者突变位点主要集中于外显子11 L576P和外显子13 K642E区域,但由于研究所纳入的样本数较少,尚不足以得出结论(表2)。
4 c-kit抑制剂靶向治疗研究进展
c-kit抑制剂伊马替尼(imatinib)用于治疗黑色素瘤的早期临床研究效果并不理想。两项分别纳入了26例和28例恶性黑色素瘤患者的Ⅱ期临床试验,伊马替尼400 mg bid治疗后,总反应率均为0%且治疗毒性较大,甚至有40%的患者因不良反应而减量[31,43]。分析后,我们认为失败的可能原因在于靶向治疗前未对患者进行c-kit基因检测且未区分黑色素瘤亚型。
目前黏膜恶性黑色素瘤c-kit靶向治疗的临床研究较少,且大多研究未区分黑色素瘤的亚型,仅有少量的病例报道或小样本临床研究可供参考。针对女性生殖道恶性黑色素瘤靶向治疗的临床试验尚未开展[44]。Lutzky等[45]报道了1例69岁c-kit基因K642E点突变的肛管黏膜恶性黑色素瘤患者在接受伊马替尼200~600 mg qd治疗后达完全缓解(complete response,CR)。Rapisuwon等[46]报道了1例外显子8突变的鼻腔黏膜恶性黑色素瘤患者在给与伊马替尼治疗后达CR。一项单中心Ⅱ期临床试验纳入了295例恶性黑色素瘤,51例患者检测出c-kit基因突变,其中28例患者口服伊马替尼400 mg bid,2例患者达CR,2例患者达部分缓解(partial response,PR),总反应率为16%[28]。
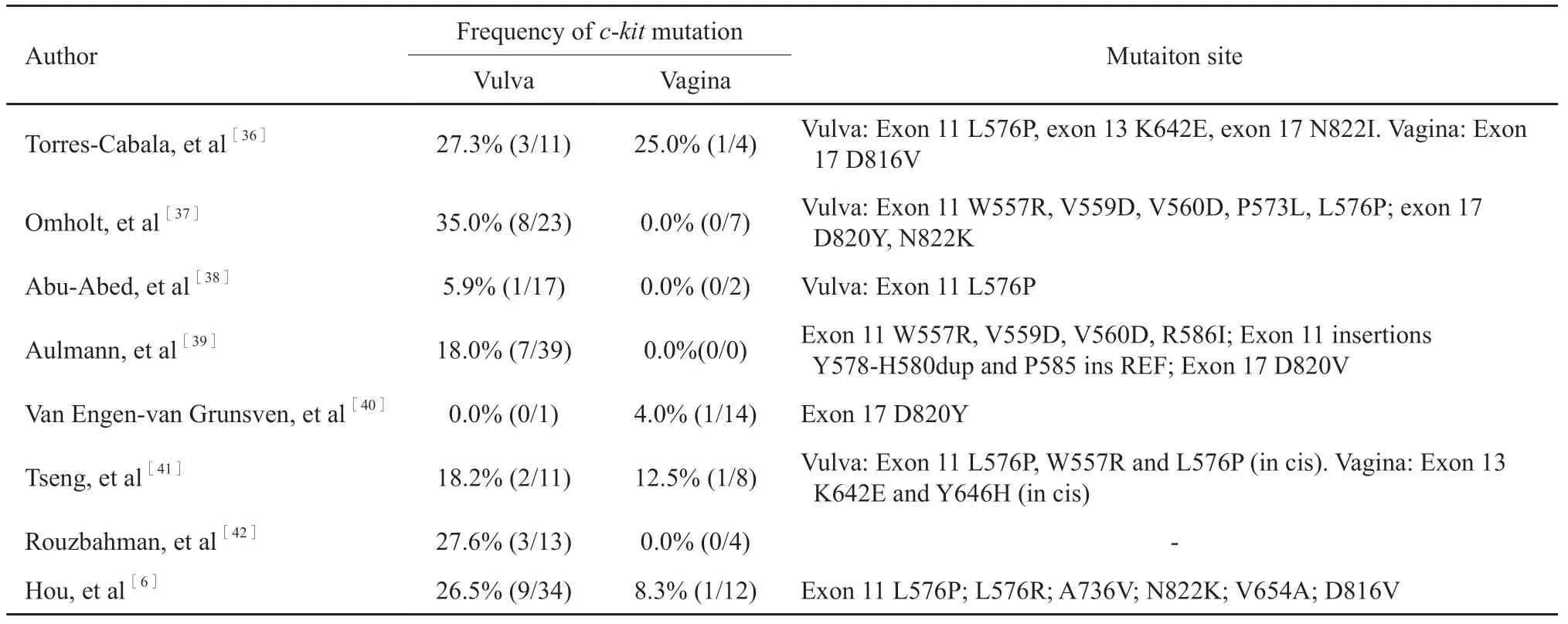
表2 外阴与阴道恶性黑色素瘤中c-kit基因改变情况Tab.2 C-kit gene alterations in vulvar and vaginal melanoma
其他c-kit抑制剂如达沙替尼(dasatinib)、舒尼替尼(sunitinib)在黏膜恶性黑色素瘤中的治疗也有相关报道。Woodman等[47]报道了3例c-kit基因外显子11区域L576P突变的黏膜恶性黑色素瘤的患者,经达沙替尼400 mg qd后,1例在3个月内达PR,2例在4个月内达PR。达沙替尼治疗Ⅳ期黏膜、肢端和外阴阴道黏膜恶性黑色素瘤的E2607Ⅱ期临床试验中[48],Ⅰ期有5.9%(3/51)的患者达PR,Ⅱ期有18.2%(4/22)患者达PR,31.8%达疾病稳定(stable disease,SD),27.7%疾病进展(progressive disease,PD),但c-kit突变组与c-kit阴性组在无进展生存期(progression-free survival,PFS)和总生存期(overall survival,OS)上无明显差异。c-kit突变组中有18%达PR而阴性组仅5.9%。具体而言,c-kit外显子11/13突变的患者中,20%可达PR。在该临床研究中,有12%的患者因毒性反应而退出,考虑到达沙替尼的反应率较低而毒性较高,因此在c-kit基因突变的晚期恶性黑色素瘤仍考虑将伊马替尼作为首选用药。在舒尼替尼用于治疗肢端恶性黑色素瘤和黏膜恶性黑色素瘤的Ⅱ期临床试验中[49],c-kit突变组和c-kit阴性组的总反应率和OS率无明显差异,疾病控制率可达44%,但药物毒性反应较高,耐受性较差。
就现有研究来看,c-kit基因突变的患者较c-kit基因扩增的患者对于c-kit抑制剂的反应较好,不同的突变位点对药物的反应性有所不同,对药物反应性较好的突变位点主要集中于外显子11和外显子13区域。c-kit抑制剂用于黏膜恶性黑色素瘤靶向治疗的总反应率为16%~20%,但目前临床研究纳入的样本较少,且不同亚型黏膜恶性黑色素瘤c-kit基因突变频率不同,因此,更多的针对不同亚型的黏膜恶性黑色素瘤c-kit靶向治疗单药或联合用药的临床试验值得期待。
5 c-kit基因突变与预后
c-kit基因突变与恶性黑色素瘤预后的关系报道不一,在女性生殖道恶性黑色素瘤中的研究有限。Cinotti等[34]报道的85例黏膜恶性黑色素瘤中c-kit基因突变组与非突变组总生存率无明显差异,但该研究中样本较少,且外阴阴道恶性黑色素瘤中均未检测出c-kit基因突变。Cui等[54]报道了706例黏膜恶性黑色素瘤的大规模研究,不同分期的黏膜恶性黑色素瘤中c-kit基因突变与生存率无明显相关性(P=0.210)。在Toscano等[35]报道的28例原发性头颈部黏膜恶性黑色素瘤的研究中,7例检测出c-kit基因突变,但c-kit基因突变对无疾病生存期(diseasefree survival,DFS)及OS无明显影响。相反,在中国一项502例的大规模黑色素瘤患者研究中,黏膜恶性黑色素瘤中c-kit基因突变频率为9.6%,c-kit基因异常(包括突变及扩增)的患者总体生存率显著降低[29]。同时,Minor等[53]发现Ⅳ期恶性黑色素瘤中,c-kit基因突变的患者生存时间较短(P<0.000 1)。Bai等[55]研究发现c-kit基因突变的黏膜恶性黑色素瘤患者OS率降低(P=0.006)。不同亚型恶性黑色素瘤c-kit基因突变频率不同,c-kit基因突变对PFGMM预后的影响尚需进一步探索。
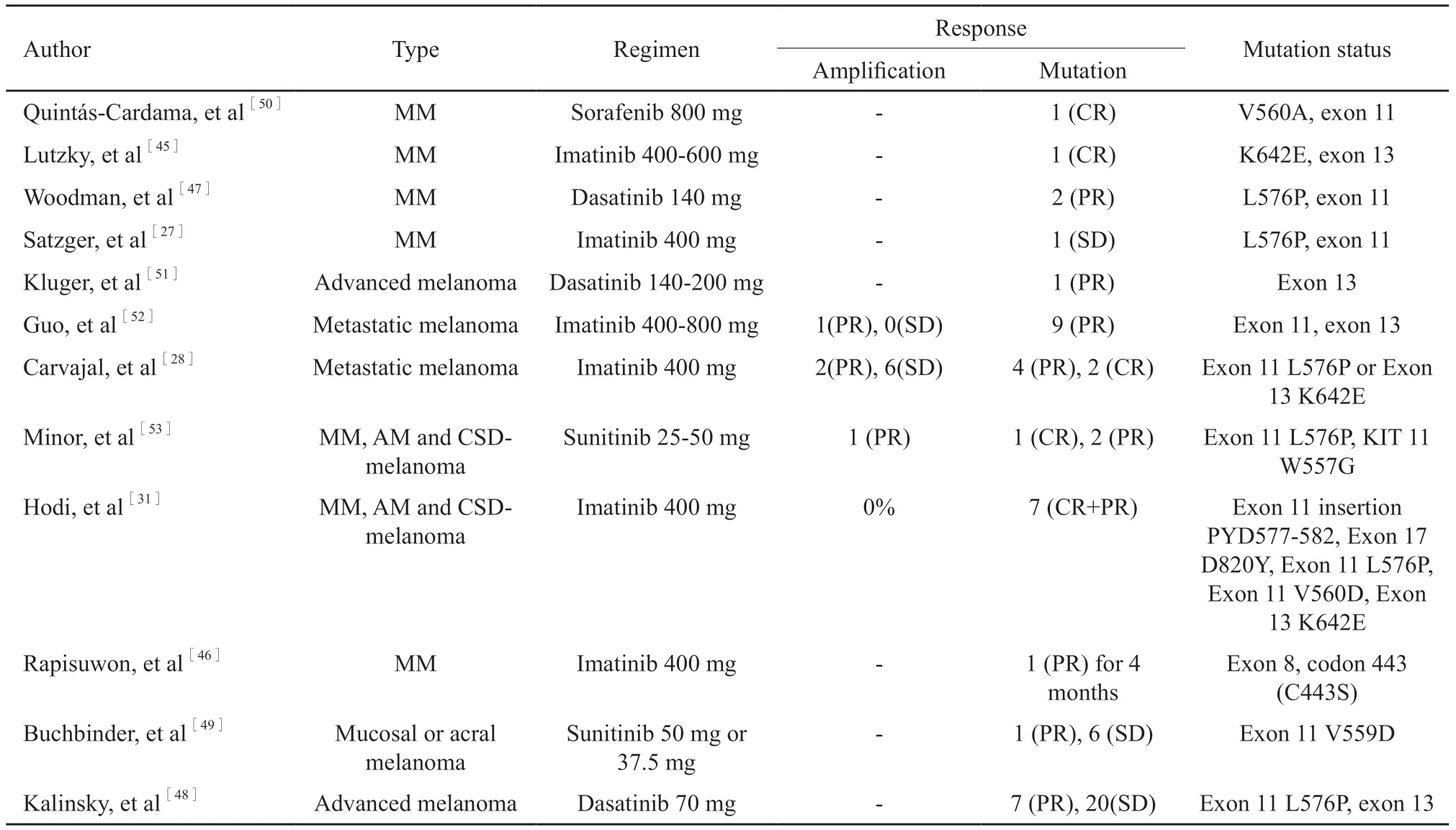
表3 黏膜恶性黑色素瘤c-kit突变的靶向治疗研究进展Tab.3 Treatment outcomes of targeted therapy for c-kit mutations in mucosal melanoma
6 结语
c-kit是一种Ⅲ型跨膜受体酪氨酸激酶,其配体干细胞生长因子所介导的生长通路是黑色素细胞、黑色素母细胞等增殖的重要通路,而c-kit基因改变可能与黑色素瘤的发生、发展及转移有关。PFGMM作为黏膜恶性黑色素瘤的一种,其发病率较低,预后较差。晚期及复发转移患者尚无良好的治疗方案,达卡巴嗪联合替莫唑胺化疗方案的效果不显著,放疗对生存无明显影响[12]。研究发现,PFGMM中c-kit突变频率约为18.5%。因此,c-kit基因有望成为新的治疗靶点。但目前黏膜恶性黑色素瘤的c-kit靶向治疗研究较少,针对PFGMM的靶向治疗临床试验尚未开展。现有数据表明,c-kit抑制剂单药或联合用药在黏膜恶性黑色素瘤的治疗中有较好的应用前景。从现有研究中我们发现,c-kit基因不同位点突变对药物的敏感性不同,以c-kit基因外显子11 L576P位点或外显子13 K624E位点突变的患者反应较好,但这些研究的样本量较小不足以下结论。不同的c-kit抑制剂的反应率及不良反应也存在较大差异,因此,如何选择c-kit基因突变位点及选择何种c-kit抑制剂以提高反应率降低毒性反应,同时联合免疫治疗药物能否提高OS率,这些都是今后临床研究的重要方向。

