Fe3O4磁性微球制备技术的研究进展
杜逸纯 刘治华 孙维凯
1 概述
磁性微球(Magnetic Microspheres)是纳米材料研究的一个重要的研究方向,其直径通常在10~100nm之间,在室温下具有超顺磁性,通过外加磁场即可将微球与液相快速的分离开来,能够实现重复使用。由于其具有较为优异的磁响应性、生物相容性及化学稳定性,因此在医学、药学[1]、催化化学[2]、分离纯化[3]及废水处理[4,5]等领域具有较为广阔的应用前景。随着研究人员的不断深入研究,其在医学及药学领域的应用潜力也在不断被挖掘,目前,已在核磁共振成像造影剂[6]、细胞标记[7]、肿瘤磁热疗[8]、药物控释[9]及蛋白分离[10]等方面得到了应用。磁性微球主要可以分为有机磁性微球和无机磁性微球2种。有机磁性微球是一种由金属有机络合物所构成的高分子纳米复合材料。无机磁性微球有很多的种类,常见的有二氧化铬(CrO2)、铁氧体(CoFe2O4)、金属单质〔铁(Fe)、钴(Co)、镍(Ni)〕、氮化铁(Fe4N)和氧化铁(Fe3O4、γ—Fe2O3)等[11],其中以Fe3O4磁性微球最为常用。与有机磁性微球相比,无机磁性微球具有许多优势,因此,研究人员对无机磁性微球进行了深入的研究,开发出了许多种制备的方法。磁性微球可控合成的关键在于控制晶体的成核及生长过程,以此来调控磁性微球的形貌、尺寸、表面性质、粒径分布及带隙等。由于在实际应用中使用最多的磁性微球是Fe3O4磁性微球,所以本文主要对Fe3O4磁性微球进行介绍。目前,Fe3O4磁性微球主要通过共沉淀法、溶胶—凝胶法、水热法、高温热分解法和微乳液法这5种方法进行制备。本文介绍了Fe3O4磁性微球的5种主要的制备方法,并回顾了近年来Fe3O4磁性微球的研究进展,分析了不同制备方法的优缺点,指出了目前Fe3O4磁性微球仍存在的一些问题,并展望了其未来的发展方向。
2 主要制备方法
2.1 共沉淀法
共沉淀法是磁性微球合成的最为常用的方法之一,在高温或室温条件下将铁离子(Fe3+)和亚铁离子(Fe2+)按照2∶1的物质的量比进行混合,添加氨水(NH3·H2O)或氢氧化钠(NaOH)作为沉淀剂,使Fe3+和Fe2+以水合氧化物或氢氧化物的形式生成沉淀,最后得到磁性微球的方法[17],其反应方程式见式(1)-(4):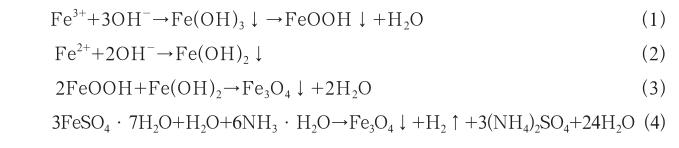
但由于Fe2+在反应过程中易被氧化生成Fe3+,所以在实际制备过程中,一般会适量增加Fe2+的量。
Sun等[12]使用经过改进的化学共沉淀法,在碱性介质中从亚铁/铁混合盐溶液中制备了粒径为8~20nm的Fe3O4磁性微球,他们选择油酸钠作为表面活性剂,制得了粒径较小、近球形、分散性良好且磁性良好的Fe3O4磁性微球,其饱和磁化强度可以达到49.24emu/g。用粒度分析仪测定磁性微球的粒径和粒径分布,并用X射线粉末衍射(XRD)、透射电子显微镜(TEM)、电子衍射(ED)、傅立叶变换红外光谱仪(FT—IR)、振动样品磁强计(VSM)对其进行了表征。研究反应温度、溶液pH值、搅拌速度和油酸钠浓度等因素对纳米Fe3O4微球的影響,并用5—二甲基噻唑—2—基—2,5—二苯基四唑溴化法(MTT)评价了磁性纳米颗粒的生物相容性。此外,他们还对油酸钠和聚乙二醇(PEG)这2种表面活性剂进行了研究,并将制得的磁性微球的性能进行了对比。结果表明,与PEG包覆的Fe3O4磁性微球相比,油酸钠包覆的Fe3O4磁性微球的生物相容性更好、磁性能更强、更容易清洗、成本更低且分散性更好。Ananth等[13]采用微波辐射共沉淀法合成了不同尺寸的Fe3O4纳米颗粒。用XRD和SEM对合成的粉体样品进行了表征,证实了磁性纳米颗粒会在立方相中形成。TEM图像显示其粒径分别为40nm、31nm和27nm。FT-IR谱图在574~580/cm范围内含有Fe-O的特征谱带。用振动样品磁强计测量了样品的磁性能,经测试,Fe3O4磁性微球饱和磁化强度可以达到59emu/g。从目前的研究中可以看出,微波辐射法是一种能够大量制备各种生物医学所需的新型磁性纳米颗粒的简便方法。
Surowiec等[14]以六水合氯化铁(FeCl3·6H2O)和四水合氯化亚铁(FeCl2·4H2O)为铁源,采用共沉淀法分别制备了直径为7.5nm、13.4nm和14.1nm的小颗粒Fe3O4磁性微球,并使用二巯丁二酸(DMSA)对Fe3O4磁性微球进行了包覆,其TEM图像如图1所示。用透射电子显微镜和X射线衍射仪测定了其晶体结构和尺寸分布,并利用穆斯堡尔谱测试了纳米粒子在3K到室温范围内的磁性能。Qu等[15]以三氯化铁(FeCl3)为原料,采用还原沉淀法,在氨碱化前用亚硫酸钠(Na2SO3)将其部分还原为亚铁盐,制备了平均粒径小于或等于10nm的球形磁性纳米颗粒。经测试表明,微球的性质与SO32-和Fe3+的浓度之比的关系非常大,其最佳配比为3∶1。随着FeCl3水溶液浓度从0.075mol/L逐渐增加到0.45mol/L,产物的粒径从约3nm增大到约11nm。这种制备方法的优点在于在还原过程中会形成红色中间体,可以在还原反应结束时加入沉淀剂来防止亚铁离子的二次氧化,而不需要通氮气或氩气进行保护。
2.2 溶胶—凝胶法
溶胶-凝胶法通常被用于金属氧化物(如Fe3O4等)的制备。这种方法首先将Fe3+和Fe2+按一定比例进行配制得到混合溶液,再添加一定量的酸,使溶液的pH达到一个合适的值,再使溶液经历水解、缩聚、成核、长大等过程,逐渐减少水分待其形成凝胶后,通过热处理去除多余的酸及水分制得Fe3O4磁性微球[16]。
Cui等[17]采用低温溶胶—凝胶法,以相同的工艺和原料合成了均匀分散的α—Fe2O3、γ—Fe2O3和Fe3O4磁性纳米粒子,其TEM图及粒径分布图如图2所示。制备过程首先是使FeCl2在沸腾的乙醇溶液中与环氧丙烷反应形成溶胶,再经过干燥得到了磁性微球。溶胶干燥条件的改变能够改变纳米氧化铁的结构。与其他制备α—Fe2O3、γ—Fe2O3和Fe3O4纳米粒子的方法相比,该方法具有非常多的优点。环氧丙烷与[Fe(H2O)6]2+的反应能够促进金属离子的水解和缩合,使氧化铁在溶液中均匀成核。因此,这个方法能够解决其他合成方法(如沉淀法)无法均匀放大的问题。用完全相同的工艺和原料,可以在一次反应中制备出60g左右的氧化铁纳米颗粒,其最大产量仅受限于准备的设施的数量。另一方面,该反应是在温和的反应条件下进行的,操作简便,可以在同一台设备上很容易地制备各种类型的氧化铁。这些优点使该合成方法在氧化铁的大规模生产中拥有很好的应用前景。
Basith等[18]以硝酸铁和极性溶剂(如水)为原料,研究出了一种低成本且简便的利用溶胶—凝胶法制备纳米Fe3O4微球的工藝,在该反应过程中会产生的大量气体,可以避免Fe3O4团聚,并有助于使最终的产物拥有高比表面积的气孔和较小的粒径。此外,他们还研究了柠檬酸等螯合剂对于Fe3O4结构的影响。用粉末X射线衍射(XRD)、高分辨扫描电子显微镜(HR—SEM)、高分辨透射电子显微镜(HR—TEM)、光致发光(PL)和振动样品磁强计(VSM)对合成产物进行了表征。磁性分析表明,Fe3O4纳米粒子在室温下具有铁磁性,饱和磁化强度为20.83emu/g。此外,他们还测试了通过柠檬酸溶胶—凝胶法制备的Fe3O4纳米粒子对苯甲醇氧化的催化活性。
2.3 水热/溶剂热法
水热/溶剂热法是以水/溶剂作为反应介质,首先将一定量的Fe3+和Fe2+混合,添加一定量的碱,调节pH值至合适的范围,将其倒入高温高压反应釜中进行反应,再通过分离、洗涤及热处理等一系列流程制备磁性微球的方法[19]。以添加尿素为例,其反应方程式见式(5)-(9):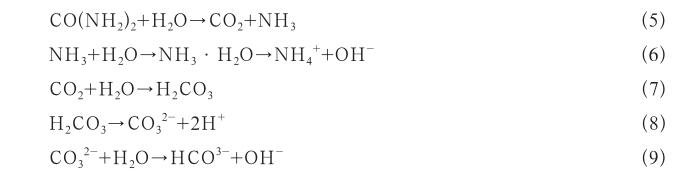
Su等[20]系统地研究了200℃水/溶剂热法合成α—Fe2O3和Fe3O4的工艺,其合成原理如图3所示。此外,他们还考察了反应介质和尿素的用量对于磁性微球的影响。用XRD、FT—IR、扫描电子显微镜(SEM)、TEM对产物进行了表征。结果表明,水和乙二醇等反应介质在形成不同类型的氧化铁中起着重要的作用。以乙二醇为反应介质,使用水热法制备了纯晶态的α—Fe2O3,通过溶剂热法合成了Fe3O4磁性微球。随着尿素用量的增加,α—Fe2O3和Fe3O4的粒径从几百纳米减小到几十纳米。随着尿素的加入,α—Fe2O3的形貌由橄榄状演变为菱形,Fe3O4磁性微球由空心球状演变为松果状,最终形成裂隙状纳米结构。产物比表面积的变化主要取决于氧化铁颗粒的微观结构和本征特性。通过对机理的研究发现,尿素原位热分解生成的CO2和NH3是形成α—Fe2O3和Fe3O4磁性微球微观结构的关键。将合成的α—Fe2O3和Fe3O4作为催化剂,在含有H2O2的条件下降解亚甲基蓝,其中α—Fe2O3具有较高的降解效率。他们的研究为开发设计具有合理结构的氧化铁提供了一种很好的思路。
Meng等[21]采用微波辅助乙二醇溶剂热法,在3h内成功合成了在水中具有良好分散性和超顺磁性的高度可调的Fe3O4纳米晶和纳米团簇。他们在实验中系统考察了FeCl3·6H2O与NaAc·3H2O的质量比、反应温度和反应时间等主要反应条件对产物尺寸和形貌的影响,并选择性地制备了高度可调的超顺磁性F e3O4纳米晶(12~25n m )和纳米团簇(40~90nm)。此外,对这些Fe3O4纳米材料的形貌、结构、磁性能和T2磁共振(MR)对比能力进行了研究。优化后的超顺磁性纳米氧化铁(SPION)晶体和SPION团簇的饱和磁化强度分别为78.4emu/g和75.2emu/g,r2弛豫系数分别为101.05/(Mm·s)和100.68/(Mm·s)。因此,制备得到的Fe3O4纳米材料显示出作为磁共振成像(MRI)造影剂的巨大潜力。这种简单、高效的方法也可以用来合成尺寸和形貌可调、重现性好、产品收率高的其他水分散纳米材料。
Wang等[22]在二甘醇(DEG)和乙二醇(EG)混合溶剂体系中,以柠檬酸钠作为表面改性剂,采用简单的溶剂热法合成了具有高度水分散性和尺寸可控的超顺磁性Fe3O4纳米团簇。Fe3O4纳米团簇是经过小分子接枝的,通过改变DEG与EG的体积比,可以在几十纳米到数百纳米之间有效地控制Fe3O4纳米团簇的尺寸。柠檬酸钠不仅在颗粒表面起到功能性配体锚定的作用,提高了Fe3O4纳米团簇的分散性,而且还能在反应中控制团簇的大小。磁性测试表明磁性微球团簇具有超顺磁性,没有矫顽力和剩磁,在室温下的磁化饱和度高达68.0emu/g。这些单分散的Fe3O4纳米团簇具有很强的磁响应性,可用于生物医学领域中的彩色显示和热疗。在交变磁场作用下,20mg/mL的Fe3O4(168nm)水分散液在242s内温度可提高46.7℃。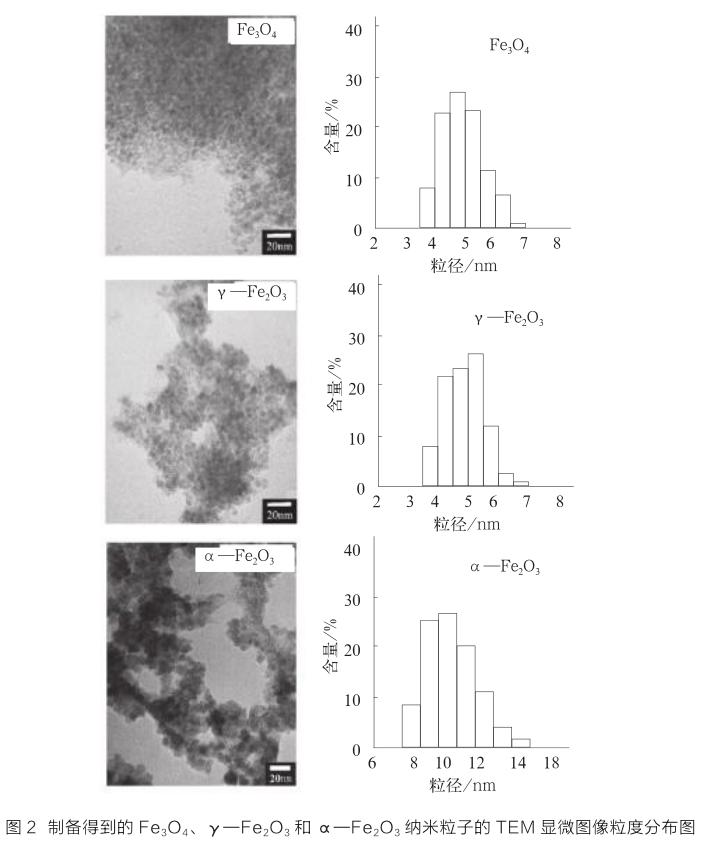

2.4 高温热分解法
高温热分解法首先是将油酸铁、五羰基铁[Fe(CO)5]、二茂铁[Fe(C5H5)2]、乙酰丙酮铁[Fe(acac)3]等铁的有机前驱体与表面活性剂在沸点较高的有机溶剂中进行混合,再进行加热回流得到Fe3O4磁性微球,通过高温热分解法制备Fe3O4磁性微球的流程示意图如图4所示。此外,可以通过添加一定量的稳定剂(如十四碳烯、油酸、油胺、十八碳烯等)来制备单分散的Fe3O4磁性微球。
Sun等[23]以乙酰丙酮铁
[Fe(Acac)3]和1,2—十六二醇为原料,在油酸和油胺存在的条件下,高温液相反应生成了单分散的磁铁矿(Fe3O4)纳米粒子。同样,Fe(Acac)3可以与Co(Acac)2或Mn(Acac)2一起与相同的二元醇反应得到单分散的CoFe2O4或MnFe2O4纳米颗粒。颗粒直径可以通过改变反应条件或通过种子介导的生长使其在3~20nm之间调节。用HRTEM、选区电子衍射(SAED)和XRD对合成的氧化铁纳米颗粒进行了表征,结果表明,合成的氧化铁纳米颗粒具有立方尖晶石结构。此外,XRD、NEXAFS光谱和SQUID磁测量表明,Fe3O4可以被氧化成Fe2O3。加入双极性表面活性剂可以将疏水性纳米粒子转变为亲水性纳米粒子,并易于制备水性纳米粒子分散体。这些氧化铁纳米粒子及其所具有的可以在各种介质中进行分散的能力在磁性纳米器件和生物磁性应用方面具有巨大的潜力。
Ge等[24]以FeCl3为原料,在添加表面活性剂的条件下进行高温水解,可以得到尺寸可调(30~180nm)的单分散超顺磁性胶体纳米晶团簇(CNCS)。超顺磁性、高磁化強度和高水分散性的优势使其成为药物输送和生物分离的理想候选材料之一。Yu等[25]使用该方法制备的磁性纳米粒子的产率可达95%。通过简单的放大投料量,可以制得数克的磁铁矿Fe3O4纳米晶体。Fe3O4纳米晶分散液(在氯仿或正己烷中)非常稳定,2个月内没有明显的团聚或沉淀。室温下测量了直径为7nm的磁铁矿纳米晶体的磁性能,如预期的那样,这种材料具有超顺磁性。
Chen等[26]采用快速微波辅助法制备了由羟基磷灰石(HAP)超薄纳米片(UNS)和Fe3O4磁性纳米颗粒(MnS)组成的磁性纳米复合材料。将Fe3O4磁性纳米颗粒与HAP超薄纳米片进行杂化,自组装形成具有层次的纳米磁性复合材料(HAPUN/MnS)。以血红蛋白(Hb)和多西紫杉醇为模型药物,对所制备的HAPUN/MNS纳米复合材料作为药物纳米载体进行了表征和研究。HAPUN/MnS纳米复合材料对Hb的吸附量随Hb初始浓度的增加而增加。HAPUN/MnS纳米复合材料中Hb的释放基本上是由扩散过程控制的。HAPUN/MNS纳米复合材料对多西紫杉醇具有良好的缓释特性,并表现出良好的pH响应性药物释放性能,这主要是因为HAP会在较低的pH值环境中逐渐溶解。负载多西紫杉醇后的HAPUN/MnS纳米复合材料具有较高的生物相容性和较高的体外抗癌效果。因此,在生物医学等方面具有非常广阔的应用前景。
2.5 微乳液法
微乳液法首先是通过添加助表面活性剂和表面活性剂来使原本不相溶的水相与油相自发形成较为稳定的油包水型乳液或水包油型乳液[27],再通过控制乳液中反应物的浓度及水的含量来控制磁性微球的成核及生长过程,最后得到具有所需要特性的磁性微球。
Lu等[28]以不同类型的表面活性剂作为表面活性剂相,正庚烷作为油相,正己醇作为助表面活性剂相,设计了一种通过油包水微乳液法制备纳米磁铁矿(Fe3O4)粒子的方法。他们采用X射线衍射(XRD)、透射电子显微镜(TEM)和57Fe穆斯堡尔技术对纳米粒子进行了表征。透射电镜观察表明,不同微乳液制备的Fe3O4粉末平均球形粒径为13~15nm。57Fe—M ssbauer谱结果表明,表面活性剂结构对纳米Fe3O4的微观结构起着重要的调节作用。此外他们还从头基电荷、疏水链长、头基大小3个方面讨论了晶格缺陷(空位参数)与表面活性剂结构之间的关系,研究了温度对于颗粒大小和缺陷的影响。他们发现表面活性剂结构对晶格缺陷的最显著影响。
Liang等[29]采用两步微乳液法制备纳米Fe3O4粒子,此外还讨论了碱浓度、温度、初始总铁浓度、陈化时间等因素对纳米粒子形貌和尺寸的影响。结果表明,制备的纳米磁铁矿颗粒大小均匀,形貌良好。当R值为6.0,碱浓度为2.5mol/L,温度为30℃,初始总铁浓度为1.75mol/L时,通过长时间陈化可诱导生成100~400nm的立方Fe3O4纳米材料。通过分析SAED和XRD图谱,发现合成的纳米粒子的晶体结构属于立方晶系。
3 结语
Fe3O4磁性微球主要可以通过共沉淀法、溶胶—凝胶法、水热/溶剂热法、高温热分解法及微乳液法这五种方法进行制备,这5种方法各有其优缺点。目前,共沉淀法及水热/溶剂热法在实际工业应用中使用的较多。共沉淀法由于成本较低,且能够进行大规模生产,因此在工厂中进行大规模生产时均使用这种方法。通过水热/溶剂热法制备F e3O4磁性微球可控性较强,可以通过改变反应条件来改变磁性微球的晶型及粒径,此外制备成本也较低。因此当需要合成粒径分布较窄,纯度较高的高要求磁性微球时,可以选择采用水热/溶剂热法进行制备。
磁性微球在很多领域都显现出非常广阔的应用前景,但目前仍存在着一些问题:第一,还缺少一种能够制备同时满足稳定性好、尺寸形貌可控性强、分散度高的磁性微球的方法;第二,目前很多制备的方法都存在着环境污染的问题,这也限制了磁性微球的大规模应用。相信通过科研人员的不断努力,一定能克服这些问题,让这种材料为我们的生活带来便利。
参考文献
[1] Gupta A K,Gupta M.Synthesis and surface engineering of iron oxide nanoparticles for biomedical applications[J].Biomateri als,2005,26(18):3995—4021.
[2] Zhang Hui,Zhang Guoyan,Bi Xue,et al.Facile assembly of a hierarchical core@shell Fe3O4@CuMgAl—LDH (layered double hydroxide)magnetic nanocatalyst for the hydroxylation of phenol[J].Journal of Materials Chemistry A,2013,1(19):5934—5942.
[3] Kokate M,Garadkar K,Gole A.One pot synthesis of magnetite–silica nanocomposites: applications as tags, entrapment matrix and in water purification[J].Journal of Materials Chemistry A,2013,1(6):2022—2029.
[4] Zhang Di,Niu Hongyun,Zhang Xiaole,et al.Strong adsorption of chlorotetracycline on magnetite nanoparticles[J].Journal of Hazardous Materials,2011,192(3):1088—1093.
[5] 譚丽莎,孙明洋,胡运俊,等.功能化纳米Fe3O4磁性材料的制备及其对水中重金属离子的去除[J].化学进展,2013,25(12): 2147—2158.
[6] Sanjeeb K S,inod L.Nanotech approaches to drug delivery and imaging[J].Drug Discovery Today,2003,8(24):1112—1120.
[7] Laurent S,Forge D,Port M,et al.Magnetic iron oxide nanoparticles:synthesis,stabilization,vectorization,physicochemical characterizations,and biological applications[J].Chemical Reviews,2008,108(6):2064—2110.
[8] Jordan A,Scholz R,Wust P,et al.Magnetic fluid hyperthermia(MFH):Cancer treatment with AC magnetic field induced excitation of biocompatible superparamagnetic nanoparticles[J].Journal of Magnetism and Magnetic Materials,1999,201(1—3): 413—419.
[9] Liong M,Lu J,Kovochich M,et al.Multifunctional Inorganic nanoparticles for imaging, targeting, and drug delivery[J]. ACS Nano,2008,2(5):889—896.
[10] Bao Jie,Chen Wei,Liu Taotao,et al.Bifunctional Au—Fe3O4 nanoparticles for protein separation[J].Acs Nano,2007, 1(4):293—298.
[11] Jiang Chengbao,An Shizhong.Recent progress in high temperature permanent magnetic materials[J].Rare Metals,2014, 32(5):431—440.
[12] Sun Jing,Zhou Shaobing,Hou Peng,et al.Synthesis and characterization of biocompatible Fe3O4 nanoparticles[J].Journal of Biomedical Materials Research Part A,2007,80(2):333—341.
[13] Ananth K P,Jose S P,Venkatesh K S,et al.Size Controlled Synthesis of Magnetite Nanoparticles Using Microwave Irradiation Method[J].Journal of Nano Research,2013,24:184—193.
[14] Surowiec Z,Budzyński M,Durak K,et al.Synthesis and characterization of iron oxide magnetic nanoparticles[J]. Nukleonika,2017,62(2):73—77.
[15] Qu Shengchun,Yang Haibin,Ren Dawei,et al.Magnetite nanoparticles prepared by precipitation from partially reduced ferric chloride aqueous solutions[J].Journal of Colloid and Interface Science,1999,215(1):190—192.
[16] 王焆,李晨,徐博.溶胶—凝胶法的基本原理、发展及应用现状[J].化学工业与工程,2009,26(3):273—277.
[17] Cui Hongtao,Liu Yan,Ren Wanzhong. Structure switch between α—Fe2O3,γ—Fe2O3 and Fe3O4 during the large scale and low temperature sol—gel synthesis of nearly monodispersed iron oxide nanoparticles[J].Advanced Powder Technology, 2013,24(1):93—97.
[18] Basith N M,Raj R A,Alsalhi M S,et al.Structural,magnetic, optical,and catalytic properties of Fe3O4 nanoparticles by the Sol—Gel method[J].Journal of Superconductivity & Novel Magnetism,2016,29(8):2053—2058.
[19] 高美娟,杨菊香.磁性纳米四氧化三铁颗粒的制备及应用进展[J].西安文理学院学报(自然科学版),2011,14(2):34—37.
[20] Su Minhua,He Chun,Shih K.Facile synthesis of morphology and size—controlled α—Fe2O3 and Fe3O4 nano—and microstructures by hydrothermal/solvothermal process:The roles of reaction medium and urea dose[J].Ceramics International,2016, 42(13):14793—14804.
[21] Meng Lingjie,Jing Xunan,Liu Tianhui,et al.Controlled synthesis of water—dispersible and superparamagnetic Fe3O4 nanomaterials by microwave—assisted solvothermal sethod:From nanocrystals to nanoclusters[J].CrystEngComm,2017, 19(34):5089—5099.
[22] Wang Wentao,Tang Bingtao,Ju Benzhi,et al.Size—controlled synthesis of water—dispersible superparamagnetic Fe3O4 nanospheres and its magnetic responsiveness[J].RSC Advances,2015,5(92):75292—75299.
[23] Sun Shouheng,Zeng Hao,Robinson D B,et al.Monodisperse MFe2O4(M=Fe,Co,Mn) nanoparticles[J].Journal of the American Chemical Society,2004,126(1):273—279.
[24] Ge Jianping,Hu Yongxing,Maurizio B,et al.Superparamagnetic magnetite colloidal nanocrystal clusters[J].Angewandte Chemie International Edition,2007,46(23):4342—4345.
[25] Yu W W,Falkner J C,Yavuz C T,et al.Synthesis of monodisperse iron oxide nanocrystals by thermal decomposition of iron carboxylate salts[J].chemical communications,2004,10(20):2306—2307.
[26] Chen Feng,Li Chao,Zhu Yingjie,et al.Magnetic nanocomposite of hydroxyapatite ultrathin nanosheets/Fe3O4 nanoparticles: microwave—assisted rapid synthesis and application in pH—responsive drug release[J].Biomaterials Science,2013,1(10):1074.
[27] 李成魁,祁紅璋,严彪.磁性纳米四氧化三铁颗粒的化学制备及应用进展[J]上海金属,2009,31(4):54—58.
[28] Lu Ting,Wang Junhu,Yin Jie,et al.Surfactant effects on the microstructures of Fe3O4 nanoparticles synthesized by microemulsion method[J].Colloids & Surfaces A Physicochemical & Engineering Aspects,2013,436(35):675—683.
[29] Liang Xiaojuan,Jia Xiangchen,Cao Lei,et al.Microemulsion synthesis and characterization of Nano—Fe3O4 particles and Fe3O4 nanocrystalline[J].Journal of Dispersion ence and Technology,2010,31(8):1043—1049.

