基于高通量测序分析四川辣椒酱自然发酵过程中细菌群落结构演替规律
刘 洋,丁 悦,孙劲松,潘 攀,刘力嘉,张雅琳,王新惠
(成都大学药学与生物工程学院,四川成都 610106)
辣椒酱作为一种深受人们喜爱的调味品,在我国具有广泛的市场,我国辣椒酱的年产量和年消费量均达500万吨以上,且每年市场的规模仍稳定增长[1]。传统辣椒酱的制作一般采用自然发酵,自然发酵指将新鲜辣椒去梗破碎后加入蒜、姜等配料,利用高盐腌制或高油腌制罐装发酵而成[2]。自然发酵辣椒酱由自然环境中的多菌种长时间发酵,形成特有的风味物质,但与此同时辣椒本身和加工处理过程都会带来许多杂菌,导致其品质稳定性不佳,食用安全性得不到保障[3]。因此,研究辣椒酱自然发酵过程中细菌群落演替规律,有利于提高自然发酵辣椒酱的经济效益和提升辣椒酱的食用安全性。
利用高通量测序技术分析环境样品中细菌群体基因组,弥补了传统微生物研究方法不能分离出环境中所有微生物的缺陷[4-5]。近年来,高通量测序技术在发酵食品行业中的运用越来越多。Hao等[6]通过对中国东北农家大豆酱发酵过程中细菌多样性的探究,确定大豆酱在发酵过程中存在有害菌为四联球菌(Tetragenococcus)和葡萄球菌(Staphylococcus),并确定乳杆菌为主要的菌群。利用高通量测序技术能够探究细菌的多样性,赵玲艳[7]通过对辣椒酱中细菌16S rRNA基因测序,发现线椒和米椒所制的辣椒酱在发酵过程中的细菌多样性差别不大,且细菌多样最大值均出现在发酵的中间时期。武亚婷等[8]采用高通量测序技术筛选出新疆不同地区的自然发酵辣椒酱的主要优势菌,筛选出链形植物属(Streptophytaspp.)和乳杆菌属(Lactobacillusspp.)等新疆地区自然发酵辣椒酱的优势菌属。大量的研究表明,高通量测序技术检测发酵食品中的微生物的技术已经比较成熟,通过此技术研究辣椒酱中的微生物具有一定的合理性。
川渝地区人们酷爱辣味,辣椒酱需求量巨大,研究该地区自然发酵辣椒酱中细菌群落结构的演替对于辣椒酱产业的发展具有重大意义。本研究以四川地区辣椒酱为材料,通过高通量测序技术,探究其在自然发酵过程中的细菌群落多样性以及菌落结构变化规律,以期锚定发酵过程中的功能菌和有害菌,为提高自然发酵辣椒酱的安全性,优化辣椒酱的发酵工艺提供理论依据。
1 材料与方法
1.1 材料与仪器
新鲜二荆条红辣椒、盐、味精等 购自十陵友谊综合市场;M2327-01Mag-Bind Plant DNA Kit(50)试剂盒 美国Omega Biotek Inc公司;无水乙醇 98%,成都科隆化学品有限公司。
Miseq测序仪 Illumina公司;5810R型高速冷冻离心机 德国Eppendorf公司;My Cycler型聚合酶链式反应仪(polymerase chain reaction,PCR)、琼脂糖凝胶电泳仪 美国Bio-Rad公司;GR-500 型姜蒜切粒机 山东高然食品机械厂。
1.2 实验方法
1.2.1 辣椒酱的工艺 新鲜二荆条辣椒→洗净去梗→捣碎→添加辅料、调料→拌匀→装坛发酵。
1.2.1.1 操作要点 辣椒选用辣度适中、辣椒红色素丰富的双流二荆条辣椒。
感官指标:呈鲜红色、质地硬朗,个头均匀、辣味强;椒把保留长度不得超过5 mm,不能脱帽。利用姜蒜切粒机对姜、蒜等进行切粒,粒径均控制在2~3 mm左右。
1.2.1.2 取样 利用无菌袋,分别对发酵期间第0、5、10、15、20、25、30、35、40 d的样品进行取样,每次在发酵缸内不同的位置取3个样品作为重复,一个样品10 g,共9次,取样的样品分别命名为CPS-1、CPS-2、CPS-3、CPS-4、CPS-5、CPS-6、CPS-7、CPS-8、CPS-9。
1.2.2 DNA提取 称取适量辣椒酱样品,严格按照M2327-01Mag-Bind Plant DNA Kit(50)试剂盒要求提取DNA。DNA浓度测定采用0.8%琼脂糖凝胶电泳,检测合格后进行进一步实验。
1.2.3 PCR扩增以及测序 采用细菌16S rDNA V3~V4扩增通用引物:341F(5′-CCTACGGGRSGC AGCAG-3′)和806R(5′-GGACTACVVGGGTATC TAATC-3′)。
PCR反应体系为:10×KAPA Library Amplification ReadyMix 15 μL,引物(10 μmol/L)F和R各为1 μL和100 ng NDA模板,最后加ddH2O补足至40 μL。
细菌PCR反应条件:94 ℃预变性4 min;94 ℃变性1 min,50 ℃退火30 s,72 ℃延伸30 s,反应重复 30个循环;72 ℃最终延伸 5 min,-20 ℃保存[9]。对得到的PCR产物用2%琼脂糖凝胶电泳检验,对符合要求的产物进行后续实验。
1.3 数据处理
利用UPARSE软件对所有样本的全部Effective Tags进行聚类,默认以97%的一致性将序列聚类成为OTUs(Operational Taxonomic Units),筛选出现频率最高的OTUs序列作为代表序列[10]。使用UCLUST分类法与SILVA数据库进行注释分析;使用Mothur软件计算Alpha指数、稀释曲线,使用Vegan package计算Beta多样性距离矩阵,并对样品进行PCA 3D主成分分析[11]使用R软件(Version 2.15.3)和OriginPro 2018作图。
2 结果与分析
2.1 Shannon稀释曲线
用Shannon稀释性曲线来表征测序方法的可行性,该曲线采用随机抽样的方法,以抽到的序列数和它们所能代表的OTU的数目构建稀释性曲线。如图1所示,曲线变得平坦,说明随着序列数的增加,不会出现更多的OTU,表明测序量足够[12]。

图1 自然发酵辣椒酱9个样本的Shannon稀释曲线

表1 辣椒酱自然发酵过程中细菌多样性指数
2.2 主成分分析
主成分分析(Principal component analysis,PCA)是对样本中微生物多样性相似性和差异性可视化的方法。样本的PCA 3D如图2所示,百分比表示该成分对样品差异的贡献值,样本间的距离越近说明样本之间越相似。样品CPS-1、CPS-2和CPS-3在图中较聚集,说明这三个样品的相似度较高。同理,样本CPS-4、CPS-5和CPS-6相似度较高,CPS-7、CPS-8和CPS-9相似度较高。根据发酵期间样本的相似度的特点,将样品CPS-1、CPS-2和CPS-3对应的发酵第0~10 d作为发酵前期,将CPS-4、CPS-5和CPS-6对应的发酵第10~25 d作为发酵中期,将CPS-7、CPS-8和CPS-9对应的发酵第25~40 d作为发酵后期。

图2 9个自然发酵辣椒酱样本的PCA 3D图
2.3 Alpha多样性分析
Alpha多样性反应了样品中微生物的丰富度和多样性,在表1中,Chao1指数和ACE指数用于表示微生物的丰富度,其值随着微生物丰富度的升高而增大;Shannon指数和Simpson指数用于表示微生物群落的多样性,Shannon指数随着群落多样性的升高而增大,Simpson指数则随着群落多样性的升高而减小。Coverage值代表各样品文库的覆盖率,测出的值越接近1,说明各样品的覆盖率也高,测序的结果越能代表真实的情况[13]。
如表1所示,所有样本的Coverage指数都大于或等于0.99,说明测序的结果能够真实反映样本细菌丰度及细菌群落多样性;通过OTU、Chao1指数、ACE指数、Shannon指数和Simpson指数的变化情况可以发现:在发酵过程中,细菌的丰富度和多样性呈现先增大再减小的趋势,细菌的丰度在15 d达到最大值,多样性在20 d达到最大值。说明辣椒酱制作完成后存在多种细菌,由于辣椒酱中营养物质丰富,各种微生物在发酵的初期大量繁殖,产生大量的酸性物质并消耗发酵体系中的氧气,这使不适应环境的微生物逐渐消减,适应环境的厌氧和耐酸能力好的细菌得到很好的生长,最后又由于细菌之间的竞争关系造成发酵后期细菌群落多样性和丰富度减小。除此之外,温度的变化、氧气含量变化和取样时带入的外来细菌的影响等,对多样性也存在一定的影响[14]。
2.4 自然发酵的细菌OTU花瓣图
根据获得的OTU丰度矩阵,使用R软件计算样品中共有的OTU的数量,并通过OTU花瓣图直观的展示出样品的OTU数目组成相似性和重叠情况。如图3所示,9个样本中共有OTU数目仅为10,从样本CPS-1~CPS-9中特有的OTU数分别为19、26、22、31、30、26、33、24、27,说明辣椒酱在发酵的整个过程中细菌群落变化较大。

图3 辣椒酱自然发酵过程中的细菌OTU花瓣图
2.5 细菌群落结构分析
2.5.1 门水平上的细菌群落结构分析 由图4可知,发酵过程中的9个样本中,门水平上相对丰度大于0.01%的菌门类有厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、拟杆菌门(Bacteroidetes)、放线菌门(Actinobacteria)、酸杆菌门(Acidobacteria)5种。其中变形菌门是发酵前期的优势菌门,厚壁菌门是辣椒酱发酵中、后期的优势菌门。厚壁菌门在发酵1~10 d其含量有小幅度增加的趋势,但总量依然较小,相对丰度浮动范围为0.52%~2.59%,发酵中期相对丰度的波动范围为18.71%~28.56%,发酵后期相对丰度维持在75.30%~82.99%之间,对辣椒酱的发酵处于主导作用。变形菌门是前期的主要菌门,其在发酵前期的含量浮动在15.36%~18.04%之间,远远高于其他菌门,而发酵中期其生长受到抑制,相对丰度波动范围为8.56%~12.02%,后期相对丰度波动范围为2.57%~3.24%。相比之下拟杆菌门和放线菌门等含量较低,在整个发酵过程中相对丰度小于0.4%,且随着发酵的进行,其生长更加受到抑制。除此之外在发酵前期还有少量醋杆菌门,平均相对丰度为0.09%,在发酵的中、后期样本中均未检测出。
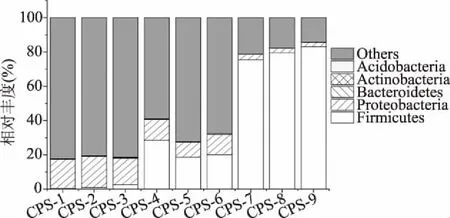
图4 门水平下自然发酵辣椒酱的细菌群落结构分布图
2.5.2 属水平上的细菌群落结构分析 在属水平上辣椒酱发酵过程中细菌群落结构如图5所示,发酵过程中相对丰度大于0.01%的分别为:乳杆菌属(Lactobacillusspp.)、片球菌属(Pediococcusspp.)、魏斯氏菌属(Weissellaspp.)、肠杆菌属(Enterobacterspp.)、葡萄球菌属(Staphyloccoccusspp.)、泛杆菌属(Pantoeaspp.)、朗斯代拉菌属(Lonsdaleaspp.)、假单胞菌属(Pseudomonasspp.)、新根瘤菌属(Neorhizobiumspp.)9种。其中肠杆菌属、魏斯氏菌属和乳杆菌属分别为发酵前期、中期、后期三个阶段的优势菌。肠杆菌属在发酵前、中、后期平均相对丰度分别为7.95%、4.24%、1.37%,一般肠杆菌属在发酵食品中属于条件致病菌,其致病性不可忽略[15]。魏斯氏菌属在样本中的丰度呈现先增加后减少的波动,在发酵前、中、后期平均相对丰度分别为0.73%、21.86%和3.66%。魏斯氏菌属可以发酵蔗糖、葡萄糖、麦芽糖等产酸,是形成风味的重要菌属。乳杆菌属在发酵前期含量较少,在第30 d时相对丰度达到68.24%。这可能是因为随着发酵的进行,发酵体系中理化性质如氧含量、酸含量等,达到乳杆菌属生长的最佳值,因此其在短时间内快速增长,并在发酵后期占主导地位。乳杆菌属在辣椒酱的风味物质形成方面起到主要的作用,此外乳杆菌属还能减少真菌毒素的积累、降解农药、阻止生物胺的积累、降低蛋白质过敏风险[16-18],还可以通过降解肌醇六磷酸来增加矿物质的利用率[19-20],是辣椒酱发酵的主要功能菌。除此之外,在发酵的后期出现少量的片球菌属(平均相对丰度0.79%),它能有效的抑制食源性致病菌[21]、加快产酸和风味物质形成的速度等[22-23],对提高发酵速率、提升风味和提高安全性具有重要意义;泛杆菌属、朗斯代拉菌属、假单胞菌属等都是可能引起疾病和食物腐败的细菌[24],在发酵的初期和中期均存在于样本中,但这几种致病菌和致腐菌随着发酵的进行,其生长受到环境因素和其他微生物的抑制,在发酵后期的样本中基本未检测出。

图5 属水平下自然发酵辣椒酱的细菌群落结构分布图
对于整个发酵过程,发酵的前、中期细菌种类较多的同时杂菌也较多,随着发酵的进行,发酵体系中理化性质的发生改变,对发酵罐中环境耐受能力差的细菌生长受到抑制,最后演替为乳杆菌属为主导,少量的魏斯氏菌属和片球菌属共同发酵的形式。此外,各种致腐致病菌随着发酵的进行,其生长受到抑制,最后仅剩小部分肠杆菌属存在。但即使存在少量肠杆菌属,说明自然发酵辣椒酱在整个发酵过程中均存在着安全隐患。
2.6 功能丰度热图分析
KEGG(Kyoto Encyclopedia of Genes and Genomes)是一个对基因组、化学以及系统功能信息加以整理合并的数据库。对样品进行KEGG分析,利用R语言绘制热图。由图6可知,在发酵整个过程中细菌较为活跃的功能基因有复制与修复(Replication and Repair)、翻译(Translation)、膜转运(Membrane Transport)、能量代谢(Energy Metabolism)、碳水化合物代谢(Carbohydrate 0Metabolism)、氨基酸代谢(Amino Acid Metabolism)、脂肪代谢(Lipid Metabolism)和转录(Transcription)等。发酵前期和中期,转录、脂肪代谢、氨基酸代谢、能量代谢、DNA复制、修复和翻译等细菌的生命活动相关功能较为活跃,到发酵的后期则变得较弱。说明发酵前、中期,样本中细菌的生长状况较好,代谢活动较旺盛,后期无论是细菌的丰度还是物种多样性都明显减小,细菌的一系列生命活动变弱。发酵后期厚壁菌门占据主导地位,且厚壁菌门细菌的糖酵解的能力很强,这可能是发酵后期碳水化合物的代谢依然维持在很高水平造成的,同时碳水化合物代谢过程中需要膜转运的参与,所以后期细菌膜转运的丰度仍然很高[25]。发酵后期细菌能量代谢丰度较低,由此推测此阶段细菌主要的膜转运方式为易化扩散,此膜转运方式为一种不需要消耗能量被动运输方式[26]。

图6 自然发酵辣椒酱中细菌功能丰度热图
3 结论
通过对自然发酵辣椒酱进行高通量测序,研究辣椒酱在发酵过程中的细菌群落结构演替规律。发现整个发酵过程中辣椒酱的细菌群落多样性和丰度呈先增加后减少的趋势,并且最终低于初始值。由细菌群落的演替变化表明,自然发酵辣椒酱在发酵30 d左右成熟。整个发酵过程中,辣椒酱中的细菌群落变化较大。在门水平上,变形菌门(Proteobacteria)、厚壁菌门(Firmicutes)分别为发酵前期和中后期的优势菌;属水平上肠杆菌属(Enterobacterspp.)、魏斯氏菌属(Weissellaspp.)和乳杆菌属(Lactobacillusspp.)分别为发酵前、中、后期的优势菌,其中乳杆菌属为主要功能菌属,肠杆菌属为主要致病菌属。通过KEGG功能分布热图,表明在发酵过程中细菌的生命活动逐渐减弱,但碳水化合物代谢和膜转运强度变化较小且丰度较高。
在辣椒酱的自然发酵的过程中,细菌群落多样性的变化较大,随着发酵的进行,其中主要功能菌在发酵过程的丰度增加非常明显,主要致病菌生长受到抑制,但还有少量致病菌的存在,其隐藏的风险仍然不可忽视。如何做到既不影响辣椒酱风味,又能优化发酵工艺和提高食用安全性,是未来辣椒酱行业研究的重点方向。
—— 8品牌辣椒酱测评报告

