娄彻氏链霉菌SR-1102对番茄枯萎病的防效及根际微生物的影响
刘琴 徐健 祁建杭 刘怀阿 李传明 韩光杰 徐彬 陆玉荣 孙俊

摘要:为明确娄彻氏链霉菌对番茄枯萎病的防效及根际微生物类群的影响,采用室内盆栽灌根法测定娄彻氏链霉菌SR-1102菌株对番茄枯萎病病菌的防治效果,分析SR-1102对番茄根围、根表土壤及根系微生物类群、数量的影响。结果表明,SR-1102 50倍液、100倍液灌根处理对番茄枯萎病的防治效果达69.10%~72.84%。SR-1102能促进番茄根际微生物的增长,根围、根表微生物数量较对照分别增加0.6倍和2.1倍以上。根际土壤微生物增殖以细菌、放线菌为主,而真菌增殖受到抑制,根围、根表真菌数量较对照减少了24.9%~42.2%。SR-1102灌根处理可显著改变番茄根际微生物类群结构,根围、根表的放线菌/真菌、细菌/真菌较对照分别提高了7.8~9.0倍和2.8~3.5倍。定殖试验结果进一步表明,SR-1102在番茄根围、根表和根系都能定殖,根表定殖率较高,不同浓度SR-1102处理的定殖率达69.05%~75.57%。
关键词:娄彻氏链霉菌;番茄枯萎病;防效;微生物类群
中图分类号:S436.412文献标识码:A文章编号:1000-4440(2020)05-1133-06
Abstract: To explore the control effect of Streptomyces rochei SR-1102 on Fusarium wilt of tomato and the impact on rhizosphere microorganisms, the root-irrigating method was used in this study. The results indicated that the control effect of SR-1102 diluted with 50 and 100 times solution on Fusarium wilt of tomato ranged from 69.10% to 72.84%. SR-1102 could promote the growth of rhizosphere microorganisms, and the number of microorganisms in rhizosphere and root surface increased 0.6 times and 2.1 times. Bacteria and actinomycetes were the main microorganisms in rhizosphere soil, while fungi group was inhibited. Compared with the control, the number of fungi in rhizosphere and root surface decreased by 24.9%-42.2%. SR-1102 could significantly change the microbial community structure of tomato rhizosphere. The actinomycetes/fungi and bacteria/fungi in rhizosphere and root surface were increased by 7.8-9.0 times and 2.8-3.5 times, respectively. The results of colonization test revealed that SR-1102 could be colonized in the rhizosphere, root surface and root system of tomato. The colonization rate was high in root surface, and the colonization rate of SR-1102 ranged from 69.05% to 75.57%.
Key words:Streptomyces rochei;tomato Fusarium wilt;control effect;microbial group
番茄枯萎病是危害番茄生長的土传真菌病害,其病原为半知菌亚门番茄专化型尖镰孢菌(Fusarium oxysporum f.sp.lycopersici Snyder et Hansen)[1]。土壤中的病原菌通过番茄根部侵染并在维管束繁殖,引起维管束阻塞,导致植株萎蔫、枯死,成为番茄栽培中危害损失大、防治困难的重要病害[2]。设施番茄栽培技术的推广及连茬种植,加重了番茄枯萎病的发生和危害,制约了番茄产业的高效、可持续发展[3]。长期以来包括番茄枯萎病在内的土传病害主要依赖化学防治,但大量农药的使用并未从根本上有效控制番茄枯萎病的危害,同时造成病原菌抗药性增强、蔬菜农药残留增加及土壤微生物生态的恶化。植物根围土壤中广泛存在的能产生拮抗性物质、抑制病原菌侵染、促进植物生长的微生物,是经济有效的生防资源[4-6]。分离筛选广谱、高效拮抗菌,探索利用根际有益微生物防治土传病害的生物防治途径,对推进农业可持续发展具有重要作用[7-9]。娄彻氏链霉菌(Streptomyces rochei)是自然界广泛存在的一种生防放线菌,在番茄、辣椒、印楝等多种植物组织内被分离获得[10-12]。江苏里下河地区农业科学研究所从黄瓜根茎分离获得的内生放线菌(Actinomycete)娄彻氏链霉菌 SR-1102菌株,表现出对黄瓜枯萎病病菌、茄子黄萎病病菌、番茄灰霉病病菌等多种靶标真菌的拮抗活性[13]。本研究采用盆栽试验法,研究娄彻氏链霉菌SR-1102灌根对番茄枯萎病的生防效果及番茄根际微生物区系的影响,为应用娄彻氏链霉菌防治番茄枯萎病、改善连作土壤种植生态、克服土传病害危害提供依据。
1材料与方法
1.1试验材料
1.1.1供试菌株和培养基供试娄彻氏链霉菌(Streptomyces rochei)SR-1102菌株由江苏里下河地区农业科学研究所从黄瓜根际分离获得,实验室鉴定并保存[13]。病原菌番茄枯萎病病菌(Fusarium oxysporum f.sp.lycopersici Snyder et Hansen)由江苏省农业科学院植物保护研究所提供,实验室活化、摇瓶培养后供盆钵接种。
培养基包括高氏一号琼脂培养基(GA)、马铃薯蔗糖琼脂培养基(PSA)、马铃薯蔗糖培养液(PSB)、牛肉膏蛋白胨琼脂培养基(BPA)。培养基配制参照方中达[14]的方法。
1.1.2供试材料供试番茄(Solanum lycopersicum)品种为苏粉14号,选取长势相同的2叶1心穴盘番茄幼苗作为供试植株。
娄彻氏链霉菌SR-1102发酵液:娄彻氏链霉菌SR-1102菌株在高氏一号斜面培养基活化5 d后,接种到50 ml发酵培养基(1 L配方:玉米粉30.0 g、K2HPO4 2.0 g、MgCl2 2.0 g和NaCl 1.0 g,蒸馏水1 000 ml)中,30 ℃振荡培养4 d,收集菌液,孢子浓度为1 ml 2×109 CFU。
番茄枯萎病病菌接種液:将保存在PDA斜面培养基上的番茄枯萎病病菌接种于100 ml PSB液体培养液中,28 ℃振荡培养5 d产生孢子。培养液用纱布过滤、离心去除上清液后,用无菌水稀释成孢子浓度为1 ml 1×107 CFU的病菌接种液。
1.2试验方法
1.2.1娄彻氏链霉菌SR-1102对番茄枯萎病的防效试验取蔬菜田15~25 cm土层,去除石子、草根,105 ℃烘干2 h后装入塑料盆钵(d=14.0 cm)中。将2叶1心番茄幼苗根部用清水洗净,放入番茄枯萎病病菌孢子接种液中浸泡20 min,每盆移栽1株,温室内培养。移栽1 d后分别用SR-1102发酵液50倍液、100倍液50 ml灌根,另以等量清水灌根为对照。3次重复,每个重复30株。
番茄幼苗SR-1102发酵液灌根30 d后调查番茄枯萎病发病株数,计算病株率,参考番茄枯萎病分级标准[15],调查病情指数,计算相对防效。
1.2.2娄彻氏链霉菌SR-1102对番茄根际微生物类群的影响方法1.2.1中番茄盆钵SR-1102灌根60 d后,各处理随机选择4盆植株。抖落附着在番茄根系上的土,定量称取土样,以无菌水定容作为根围土样;剪取上述取过根围土的根系,用无菌水洗涤根表土壤,以洗涤前后根质量差值计算土样并定容作为根表土样;洗涤番茄根系经75%乙醇浸泡30 s、1 g/L氯化汞处理1.5 min、无菌水洗涤后,于无菌研钵中加无菌水研磨后定容作为根系样品[16]。不同样品以无菌水稀释成不同浓度梯度,采用稀释平板测数法进行土壤微生物分离和计数[17]。真菌用PSA培养基(含0.3%链霉菌)28 ℃培养4 d计数;细菌用BPA培养基30 ℃培养3 d计数;放线菌用GA培养基(含80 μg/ml K2Cr2O7)30 ℃培养4 d计数。SR-1102的确认主要通过与SR-1102菌株同步纯培养的菌落形态比较和16S rDNA鉴定后计数。
2结果与分析
2.1娄彻氏链霉菌SR-1102对番茄枯萎病的防治效果
盆栽接种番茄枯萎病病菌试验结果表明,番茄枯萎病病菌对番茄幼苗具有较强的侵染能力,番茄枯萎病病菌接种30 d后,盆钵番茄都有不同程度的感染,清水对照的病指为73.61,病株率达100.00%。放线菌 SR-1102 灌根处理对番茄枯萎病具有较好防效,50倍液、100倍液处理30 d后,病指分别为20.00、22.78,病株率分别为66.67%、68.89%,显著低于清水对照,相对防治效果分别达72.84%、69.10%。不同浓度SR-1102处理间病指、病株率、相对防效的差异不显著(表1)。
2.2娄彻氏链霉菌SR-1102对番茄根际微生物类群的影响
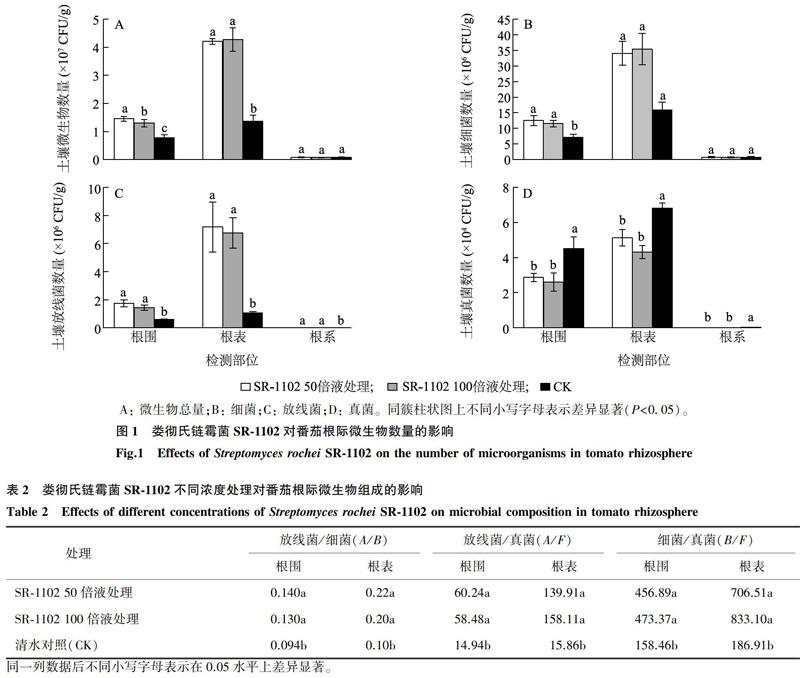
2.2.1娄彻氏链霉菌SR-1102对番茄根际微生物数量的影响番茄根际土壤微生物主要分布在根围和根表土壤中,其中根表微生物数量最大(图1A)。不同浓度SR-1102灌根处理都显著促进了番茄根围、根表微生物的增长,根围微生物数量较对照增加了0.6~0.9倍,根表微生物数量增加了2.1倍以上,与对照差异显著。细菌是根际土壤微生物的主要类群,根系内定殖的微生物也以细菌为主。SR-1102灌根处理后,番茄根围、根表土壤中细菌数量显著增加,但对根系内细菌定殖量无明显影响(图1B)。SR-1102灌根处理后番茄根际放线菌增长量主要集中根围和根表,较对照增加了137.3%~562.2%,同时提高了番茄根系内放线菌定殖量(图1C)。相反,番茄根际土壤中真菌增殖受到抑制,SR-1102灌根处理后根系内未检测到真菌定殖,根围、根表真菌数量较对照显著减少了24.9%~42.2%(图1D)。
2.2.2娄彻氏链霉菌SR-1102对番茄根际微生物类群的影响娄彻氏链霉菌不仅促进了番茄根际微生物数量的增长,而且对根际土壤微生物类群的结构产生影响,与对照相比,SR-1102灌根处理的土壤中A/B(放线菌/细菌)、A/F(放线菌/真菌)、B/F(细菌/真菌)的变化明显,表现为放线菌与细菌类群相对提高、真菌类群相对降低(表2)。番茄根际不同区域微生物类群测定结果表明,SR-1102灌根处理后根表土壤中微生物类群结构变化较大,A/F、B/F较对照分别提高了7.8~9.0倍和2.8~3.5倍。放线菌类群在根表土壤中的增长比例明显高于根围土壤,不同浓度SR-1102灌根处理根表土壤中A/B、A/F较根围土壤分别提高了0.5~0.6倍和1.3~1.7倍。不同浓度SR-1102灌根处理间微生物类群结构A/B、A/F、B/F差异不显著
2.3娄彻氏链霉菌SR-1102在番茄根际的定殖作用
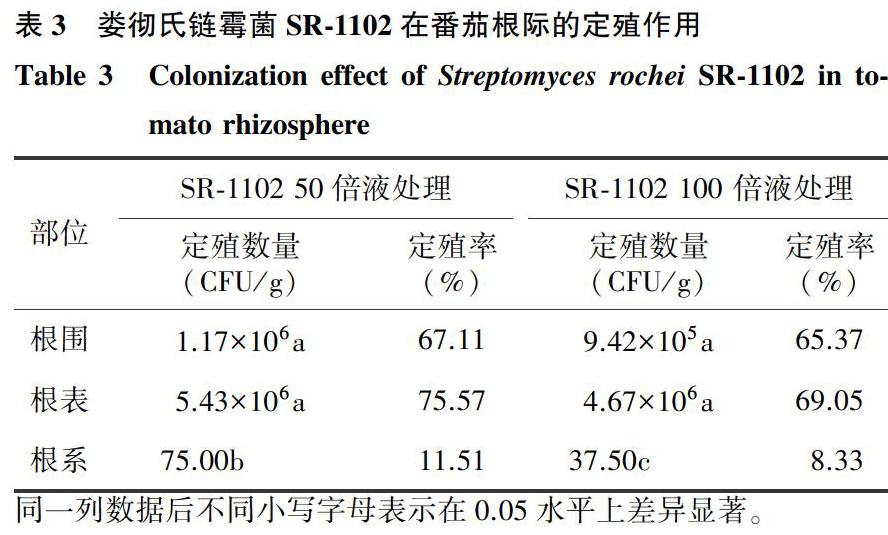
与SR-1102菌株同步纯培养形态比较结合16S rDNA验证结果表明,从娄彻氏链霉菌SR-1102灌根处理的番茄植株根围、根表和根系普遍分离获得娄彻氏链霉菌SR-1102,说明娄彻氏链霉菌SR-1102在番茄根际具有较强的存活、定殖能力。根围、根表土壤是SR-1102增殖和优势菌群形成的主要区域,不同浓度SR-1102灌根处理60 d后,从土壤中分离的SR-1102数量分别达到9.42×105 ~1.17×106 CFU/g和4.67×106 ~5.43×106CFU/g,根表定殖率较高,为69.05%~75.57%,与根围定殖率无明显差异,但显著高于根系的定殖率。根系内SR-1102定殖数量较少,仅37.50~75.00 CFU/g,定殖率为8.33%~11.51%。SR-1102表现为随SR-1102处理浓度的提高,定殖量相对增加,但方差分析差异不显著(表3)。
3讨论
大量研究结果表明,放线菌能通过代谢抗生素、诱导植物抗性来抑制病原菌对植物的侵染,在蔬菜土传病害生物防治上具有广泛的应用潜能[18]。灰绿链霉菌K61是从泥炭藓中分离的放线菌,能显著抑制康乃馨枯萎病病菌的侵染和扩展,同时诱导植株增强系统抗性[19]。西北农林科技大学筛选的生防放线菌Act11、Act12在植物根部具有较好的定殖稳定性,能够促进根际微生物类群结构的改善,形成以放线菌、拮抗细菌为优势菌群的抵抗病原菌侵染的生物屏障[20]。娄彻氏链霉菌是植物根际及土壤中广泛分布的生防放线菌。笔者的前期研究结果表明,分离获得的SR-1102菌株具有广谱拮抗活性,对黄瓜枯萎病病菌、西瓜枯萎病病菌、茄子黄萎病病菌等多种植物病原真菌具有较好的抑菌效果[13],田间试验结果表明,SR-1102对番茄立枯病、黄瓜立枯病等土传病害有较好的防效[21]。本试验结果进一步表明,娄彻氏链霉菌SR-1102对番茄枯萎病同样具有较好的拮抗作用,能够显著降低感病株率、病情指数,不同浓度SR-1102灌根处理对番茄枯萎病的相对防治效果达69.10%~72.84%。同时SR-1102是植物内生放线菌,能够在植物根际形成有效定殖,在接种番茄枯萎病病菌的土壤中灌根60 d后,番茄根围、根表、根系中都普遍检测到SR-1102菌株,根围、根表土壤表现出较高的定殖率,这对娄彻氏链霉菌SR-1102在番茄根际占据生态位、竞争抑制枯萎病病菌的侵染具有重要作用。
土壤微生物是土壤的重要组成部分,不仅直接影响植物的生长状况,而且是反映土壤生态活性的指标[22]。土壤微生物的区系组成、生物量及其生命活动与土壤的质量和植物生长密切相关 [16,23]。江苏设施蔬菜连作土壤理化性状分析研究结果表明,连作种植土壤中微生物类群的变化是造成设施蔬菜连作障碍的主要生物因素之一 [24]。番茄枯萎病是一种土壤带菌侵染的土传病害,设施连茬栽培加重了包括番茄枯萎病在内的多种土传病害危害,致使设施番茄种植产生连作障碍 [25-27]。长期连作直接影响微生物在土壤中的消长和活性,表现为细菌数量下降和放线菌增长变缓,而病原真菌数量持续上升,导致土传病害加重[28-29]。通过向土壤中添加有益微生物可以显著改变微生物类群的结构,减少土传病害的发生和危害,克服连作障碍的影响[30]。本试验结果表明,番茄根际娄彻氏链霉菌SR-1102的引入对土壤微生物生态产生显著影响,在促进番茄根际微生物的数量增长的同时,改变了微生物的类群结构,根围、根表微生物数量分别较对照增加了0.6倍、2.1倍。根际土壤微生物数量增加的主要类群是细菌、放线菌,而真菌增殖受到抑制,根围、根表真菌数量较对照减少了24.9%~42.2%,使得A/B、A/F、B/F显著提高。在应用植物内生放线菌SR-1102防治番茄枯萎病的同时,可以通过放线菌的定殖调控作用,优化土壤微生物结构,提高根际土壤微生态质量,降低多种土传真菌危害风险,说明植物内生放线菌防治方法是蔬菜土传病害标本兼治的生物治理途径。
参考文献:
[1]梁雪杰. 番茄土传病害拮抗菌的筛选、鉴定及其防病机理初探[D]. 南京: 南京农业大学,2013.
[2]王静,宁燕夏,李黄维,等. 解淀粉芽孢杆菌B6在番茄根部定殖及对番茄枯萎病盆栽防效初步研究[J]. 中国植保导刊, 2018, 38(3): 19-22.
[3]徐艳辉,李烨,许向阳.番茄枯萎病的研究进展[J].东北农业大学学报, 2008,39(11): 128-134.
[4]陈雪丽,王光华,金剑,等. 多粘类芽孢杆菌BRF-1和枯草芽孢杆菌BRF2对黄瓜和番茄枯萎病的防治效果[J]. 中国生态农业学报, 2008, 16(2): 446-450.
[5]刘琴,王艳,徐健,等. 枯草芽孢杆菌Bs-1013的抑菌活性及其包衣对黄瓜发芽生长的影响[J]. 江苏农业科学, 2013, 41(11): 117-119.
[6]邱德文. 微生物蛋白农药研究进展[J]. 中国生物防治,2004, 20(2): 91-94.
[7]周文杰,呂德国,秦嗣军. 植物与根际微生物相互作用关系研究进展[J]. 吉林农业大学学报, 2016, 38(3): 253-260.
[8]BAKKER PETER A H M, DOORNBOS R F, ZAMIOUDIS C, et al. Induced systemic resistance and the rhizosphere microbiome [J]. The Plant Pathology Journal, 2013, 2(2): 136-143.
[9]葛晓颖,孙志刚,李涛,等.设施番茄连作障碍与土壤芽胞杆菌和假单胞菌及微生物群落的关系分析[J].农业环境科学学报, 2016, 35 (3): 514- 523.
[10]孙佳瑞,胡栋,张翠绵,等. 链霉菌S506对番茄生长和冷害生理生化的影响[J]. 中国农学通报, 2012, 28(31):167-171.
[11]韦坤逢,王丽,李灿灿,等. 辣椒根际链霉菌WKFF34的分离鉴定及拮抗作用[J]. 江西农业大学学报, 2018, 40(1):78-88.
[12]张丽,纪明山,谷祖敏,等. 印楝内生放线菌鉴定及对稻瘟病菌拮抗作用研究[J]. 中国生物防治学报, 2014, 30(4): 534-53.
[13]刘琴,徐健,刘怀阿,等. 黄瓜内生放线菌SR-1102的分离及对枯萎病菌的拮抗活性[J]. 扬州大学学报(农业与生命科学版), 2015, 36(2): 83-88.
[14]方中达.植病研究方法[M].北京:中国农业出版社, 1998.
[15]张琴芳,代光辉,顾振芳,等. 非致病性镰刀菌 Fusarium oxysporum菌株47(FO47) 对番茄枯萎病的防治效果[J]. 上海交通大学学报(农业科学版), 2004, 22(1): 17-21.
[16]梁军锋,薛泉宏,牛晓磊,等.7株放线菌在辣椒根部定殖及对辣椒叶片的PAL与PPO活性的影响[J]. 西北植物学报, 2005, 25(10): 2118-2123.
[17]程丽娟,薛泉宏.微生物学实验技术[M]. 西安:世界图书出版社, 2000.
[18]关晔晴,张宝俊,韩巨才,等. 植物内生放线菌在农业上的应用研究进展[J]. 农业技术与装备, 2011(6): 54-58.
[19]LAHDENPERA M L. The control of Fusarium wilt on carnation with a Streptomyces preparation [J]. Acta Hortic, 1987, 216: 85-92.
[20]孙敬祖,薛泉宏,唐明,等. 放线菌制剂对连作草莓根区微生物区系的影响及防病促生作用[J]. 西北农林科技大学学报, 37(12): 153-158.
[21]黄金金. 内生菌Streptomyees rochei的抗菌活性及对蔬菜土传病害的控制作用[D]. 扬州: 扬州大学, 2018.
[22]周德平,褚长彬,刘芳芳,等. 种植年限对设施芦笋土壤理化性状、微生物及酶活性的影响[J]. 植物营养与肥料学报, 2012, 18(2): 459-466.
[23]王守正,王海燕,李洪连,等.瓜类植物诱导抗病性研究[J].河南农业科学, 2001(10): 28-30.
[24]徐彬,徐健,祁建杭,等. 江苏省设施蔬菜连作土壤理化及生物特征[J]. 江苏农业学报, 2019, 35(5): 1124-1129.
[25]周义苏. 蔬菜连作障碍产生原因与生物防治[J]. 农业与技术, 2018, 38(22): 9-10.
[26]王志春,孙星星. 防治番茄土传病害拮抗微生物的筛选与应用效果[J]. 江苏农业科学,2018,46(3):86-88.
[27]张秀,刘蕾,王辉,等. 山东省番茄尖孢镰刀菌的分离及鉴定[J]. 山东农业科学,2019,51(12):78-81.
[28]孙艳艳,蒋桂英,刘建国,等. 加工番茄连作对农田土壤酶活性及微生物区系的影响[J]. 生态学报, 2009, 30(13): 3599-3607.
[29]ZHENG S J, GARCABASTIDAS F A, LI X, et al. New geographical insights of the latest expansion of Fusarium oxysporum f. sp. Cubense Tropical race 4 into the Greater Mekong subregion [J]. Frontiers in Plant Science, 2018, 9: 457-466.
[30]LIU H A, COMINO J R, WU H S, et al. Assessment of a new bio-organic remediation as a biofungicide in fusarium-infested soils of watermelon culture areas from China [J]. Journal of Soil Science and Plant Nutrition, 2018, 18(3): 735-751.
(責任编辑:陈海霞)

