基于RNA-Seq挖掘玫瑰冠鸡与科宝鸡胚胎期胸肌组织差异表达基因
张蕾 任嵩 杨娴婧 孙杰 廖和荣

摘要:本研究旨在挖掘玫瑰冠鸡与科宝鸡胚胎期胸肌组织中差异表达基因,探讨2种鸡肌肉发育及肌内脂肪(IMF)沉积的分子遗传机理。本研究利用RNA-Seq技术对玫瑰冠鸡和科宝鸡胚胎期胸肌组织中差异表达基因(Differentially expressed genes, DEGs)进行筛选,通过GO富集和KEGG数据库对DEGs的功能进行注释与分析。结果显示:4个文库共鉴定到4 643个差异表达基因,其中玫瑰冠公鸡胸肌和科宝公鸡胸肌中有1 909个显著表达的基因,以科宝鸡为参照,929个上调,980个下调;玫瑰冠母鸡胸肌和科宝母鸡胸肌中有2 734个显著表达的基因,其中1 444个上调,1 290个下调。经荧光定量PCR验证,选取的12个差异基因的表达趋势与测序结果一致。GO富集结果表明,MYL2调控骨骼肌的生长发育,MYOG参与肌细胞的形成与分化;ACACA、ACOX2和ACOX3参与脂肪酸代谢过程;Notch1参与了胚胎发育及脂肪分化相关过程。此外,KEGG通路分析结果显示,能量代谢相关的信号通路(mTOR)与肌肉发育相关的信号通路相互作用影响肌纤维的发育。细胞连接相关通路(局部粘附、ECM-受体互作)参与了肌肉脂肪代谢过程。本研究结果为进一步解析鸡优质肉质性状相关的遗传机制奠定了基础。
关键词:玫瑰冠鸡;科寶鸡;胚胎期;胸肌;差异表达基因;RNA-Seq
中图分类号:S831.2文献标识码:A文章编号:1000-4440(2020)05-1237-10
Abstract:This study aimed to identify differentially expressed genes (DEGs) in the embryonic breast muscle tissue of Rose-crowned chicken and Cobb broilers, and to explore the molecular genetic mechanism in muscle development and intramuscular fat (IMF) deposition. RNA-Seq technology was used to screen differentially expressed genes in the embryonic breast muscle tissues of Rose-crowned chicken and Cobb broilers. GO enrichment and KEGG database were used to annotate the functions of DEGs. The results showed that a total of 4 643 differentially expressed genes were identified in the four libraries. Among them, 1 909 genes were significantly expressed in the breast muscle of Rose-crowned cocks and Cobb cocks. Taking Cobb broilers as reference, 929 genes were up-regulated and 980 genes were down-regulated. There were 2 734 significantly expressed genes in the breast muscle of Rose-crouned henes and Cobb hens, 1 444 genes were up-regulated and 1 290 genes were down-regulated. The results of real-time PCR indicated that the expression trend of 12 differential genes was consistent with the sequencing results. Go enrichment analysis results showed that MYL2 regulated the growth and development of skeletal muscle. MYOG was involved in the formation and differentiation of muscle cells. ACACA, ACOX2 and ACOX3 were involved in the fatty acid metabolism. Notch1 was involved in embryo development and adipogenesis-related processes. In addition, KEGG pathway analysis results indicated that the interaction between the energy metabolism-related signaling pathway (mTOR) and muscle development-related signaling pathways affected the development of muscle fibers. Cell junction-related pathways (focal adhesion, ECM-receptor interaction) were involved in IMF metabolism. The results of this study lay the foundation for further analysis of genetic mechanisms associated with high-quality meat quality traits in chickens.
Key words:Rose-crowned chicken;Cobb broilers;embryonic period;breast muscle;differentially expressed genes;RNA-Seq
鸡是具有重要经济意义的食用动物,同时广泛用作胚胎发育研究的模式动物。肌肉中的肌纤维直径和横截面积与肉品质呈负相关,肌纤维密度与肉品质呈正相关,而肌内脂肪(IMF)含量影响鸡肉的风味、多汁性和嫩度[1-3]。肌肉的发育取决于肌细胞的发生,在某种程度上还取决于脂肪的形成[4]。肌肉质量和肌内脂肪含量均由细胞数量和单位细胞大小决定,胚胎期是肌肉和脂肪组织发育的关键时期,而肌肉中肌纤维和脂肪细胞的数目在胚胎期及发育早期就被确定,在生长后期仅表现为细胞的增大和质量的增加[5-6]。有研究结果表明,在鸡胚胎发育的7~10 d,脂肪细胞成脂标志基因PPARα表达水平逐渐增加,此时肌内脂肪快速沉积[7]。Pax基因家族与肌纤维生长发育密切相关,廖菁等[8]研究发现Pax-3在胸肌中的表达高峰期出现在胚胎期 8~20 d,此后迅速下降并保持稳定。本课题组前期研究结果表明,玫瑰冠鸡与科宝鸡腿肌均在7胚龄开始出现脂肪沉积,胸肌则在8胚龄开始出现脂肪沉积[9]。也有研究结果表明胚胎期肌肉发育和肌内脂肪沉积对出雏后家禽产肉量和肉品质具有决定性作用[10]。Velleman研究发现火鸡在25胚龄时胸肌肌纤维已存在品种和性别的差异,表明胚胎期肌纤维发育对出生后肌肉发育潜力有极大影响[11]。Charrin等研究了麻鸭1~98 d IMF的沉积规律,发现第1 d胸肌组织中总脂肪含量较高,表明胚胎期脂肪沉积对早期阶段的生长和能量需求是必要的[12]。
玫瑰冠鸡具有地方鸡种良好的肉品质及独特的风味,其桑葚状冠型巨大鲜艳,肉质细嫩,香气浓郁,极具食用和观赏价值[13],科宝鸡具有生长速度快、饲料转化率高、屠宰率高等优点,尤其是其胸肌肌肉产量,在28 d后可达到活体质量的20%以上,但两者在生长速度、肌肉品质等方面存在显著差异 [14]。因此,这2个品种是研究鸡肌肉生长发育及肉品质遗传机理的理想动物模型。
鸡胚胎期肌肉发育及脂肪形成受多种基因的影響和调控,但其潜在的分子机制仍不明确。本研究采用RNA-Seq技术挖掘和筛选影响玫瑰冠鸡、科宝鸡胚胎期肌肉发育及脂肪形成的候选基因和信号通路,以期为阐明鸡肉品质性状差异的遗传机理奠定基础。
1材料与方法
1.1样品采集
玫瑰冠鸡种蛋由石河子大学动物科技学院实验站提供,科宝鸡种蛋由新疆泰昆种鸡场提供。所有种蛋均按常规程序进行孵化,胚胎期第8 d分别采集玫瑰冠鸡(M)、科宝鸡(K)的胸肌组织(X),置于Trizol试剂中,并迅速放入液氮中保存。将采集的样品分为4组:玫瑰冠公鸡(MGX)、科宝公鸡(KGX)、玫瑰冠母鸡(MMX)、科宝母鸡(KMX),每组3个生物学重复。
1.2RNA提取、转录组文库构建与测序
使用Trizol法提取玫瑰冠鸡和科宝鸡胸肌组织的总RNA,接着采用1%的琼脂糖凝胶电泳,然后纳米分光光度计、Qubit和Bioanalyzer 2 100分别检测RNA的质量、浓度以及完整性。样品检测合格后,使用NEBNext UltraTM Directional RNA Library Prep Kit构建文库。最后,使用Agilent Bioanalyzer 2100对文库质量进行评估,库检验合格后,使用Illumina Hiseq 4000平台对文库进行RNA-Seq。
1.3测序数据处理与分析
原始序列(Raw reads)中去除低质量、带接头的序列,获得高质量序列(Clean reads),同时计算Clean reads的Q20、Q30(分别表示 Phred 数值大于20、30的碱基占总碱基的百分比)和C+G含量。使用Bowti2和 HISAT2 将过滤后的序列定位到鸡的参考基因组(http://asia.ensembl.org/Gallus_gallus/Info/Index)上,比对过程中不容许错配,后续分析都基于比对结果进行。
1.4SNP及可变性剪切分析
通过Samtools和Picard-tools等工具对比对结果进行染色体坐标排序、序列去重复等处理,然后通过变异检测软件GATK2统计每个样品的单核苷酸多态性位点(SNP)和插入缺失突变(Indel)。使用rMATS (http://rnaseq-mats.sourceforge.net/index.html)对样品中的可变剪切事件(外显子跳跃、第一个外显子可变剪切、最后一个外显子可变剪切、外显子选择性跳跃、内含子滞留)进行分类和差异分析。
1.5差异表达基因分析
使用Cuffdiff (http://cole-trapnell-lab.github.io/cufflinks/cuffdiff/index.html)软件进行定量分析,以FPKM(Fragments per Kilobase Million)来表示基因的表达量。通过计算皮尔逊相关系数(Pearson product-moment correlation coefficient)评估品种内重复样品的相关性。以差异倍数值(Fold change)及P<0.05进行差异基因筛选。
1.6差异表达基因GO和KEGG分析
基于非中心超几何分布算法,采用GOseq 对差异表达基因进行GO注释。采用Kobas 2.0(http://kobas.cbi.pku.edu.cn/help.do)找出差异基因参与的显著性富集的通路。GO注释及KEGG通路分析均以P<0.05为差异显著判断标准。
1.7测序结果的实时荧光定量PCR验证
随机挑选了12个差异表达基因进行荧光定量PCR,使用primer5設计特异性引物,选择U6作为相对定量的内参基因,委托上海生工生物工程有限公司合成,引物信息见表1。反应体系(20 μl):染料10 μl,ddH2O 7 μl,上下游引物各1 μl,cDNA 1 μl。反应条件:95 ℃预变性5 min;95 ℃变性10 s,最佳退火温度20 s,72 ℃延伸10 s,共45个循环;95 ℃ 5 s,65 ℃ 1 min,97 ℃ 1 s 。使用2 -△△Ct法对基因的表达量进行标准化计算。差异性分析使用SPSS 22软件,以P<0.05为差异显著判断标准。
2结果与分析
2.1测序数据质量
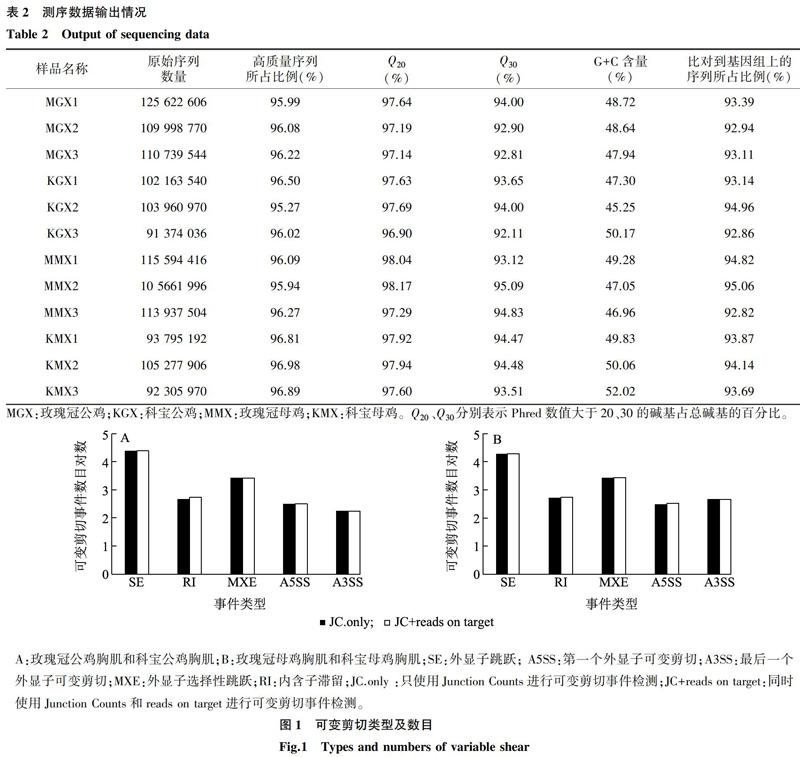
测序结果显示,每个样品产出的原始序列数量均在91 374 036以上,所得高质量的序列所占比例均在95.27%以上。Q20和Q30是衡量测序准确率的一个重要指标,Q20的含量均在96.9%以上,Q30的含量均在92.11%以上,所有样品中G+C含量集中分布在45.25%~52.02%。Total mapped是比对到参考基因组的高质量序列的数量,所有样品比对到鸡基因组上的高质量序列数量均在92.62%以上,统计结果见表2。
2.2SNP及其可变剪接
所有样品中检测到的SNP数量为993 778~1 619 033个,从理论上来看,每一个SNP 位点都可以有4 种不同的变异形式,但实际上发生的只有2种,即转换和颠换,二者之比为1∶2。SNP在CG序列上出现最为频繁,而且多是C转换为T。所有样品中发生插入缺失突变事件的数目为84 008~138 470个,且均位于染色体上。
由图1可知,2个比较组合中均包含了5类可变剪切事件,且2种方法检测的结果相似,均是外显子跳跃(SE)和外显子选择性跳跃(MXE)最多。
2.3差异表达基因
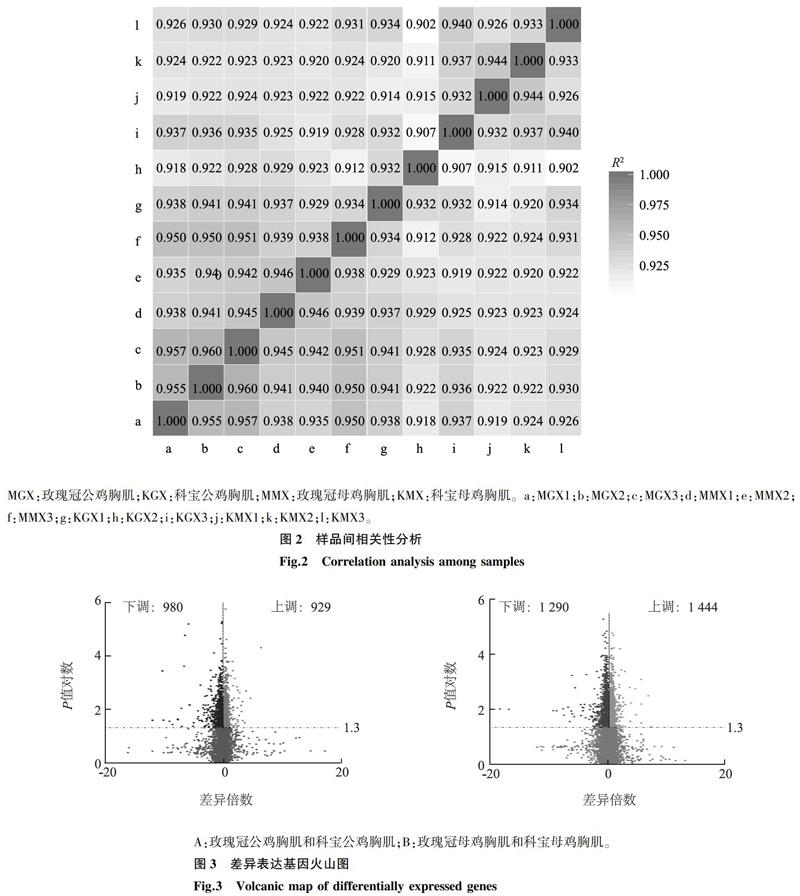
Pearson相关分析结果表明,样本间相关系数均在0.902以上(图2),相关性高,说明样品表达模式相似度高。通过与参考基因组序列进行比对,4个文库共鉴定到4 643个差异表达基因,其中,玫瑰冠公鸡胸肌和科宝公鸡胸肌中有1 909个显著表达基因,以科宝鸡为参照,其中929个上调,980个下调(图3A);玫瑰冠母鸡胸肌和科宝母鸡胸肌中有2 734个显著表达基因,其中1 444个上调,1 290个下调(图3B)。通过对差异表达基因分析,其中有367个基因在4个文库中共表达(图4A),对其进行聚类分析,显示玫瑰冠鸡与科宝鸡表达的基因分别聚类到2个不同的类群,表明2个品种鸡表达的基因存在一定的差别(图4B)。
2.4差异表达基因GO富集
利用GOseq对两品种鸡胸肌组织中差异表达基因进行富集分析,结果显示在玫瑰冠公鸡胸肌和科宝公鸡胸肌中共显著(P<0.05)富集到1 016个GO条目,包括675个生物过程 (Biological process, BP),171个细胞组分 (Cellular component, CC)和170个分子功能 (Molecular function, MF)。在玫瑰冠母鸡胸肌和科宝母鸡胸肌中共显著(P<0.05)富集到813个GO条目,包括498个BP,185个CC和128个MF。主要涉及到生物代谢过程、细胞组分、生物合成过程、细胞增殖和分化及骨骼肌发育等过程的调控,其中显著富集到脂肪酸代谢过程的差异表达基因包括ACOX2、ACOX3、ACSL1、ACACA等;MSC、SIX1、MYOG、MYL2、MYF6等被显著富集到骨骼肌发育相关的生物学过程中;TWIST1、NOTCH1、WNT3等差异表达基因被显著富集到胚胎发育相关的生物学过程中(表3)。这些差异表达基因在两品种鸡胚胎期细胞的增殖分化、肌肉发育及脂肪形成过程中存在一定差异,是造成鸡肉品质性状差异的重要影响因素。
2.5差异表达基因的KEGG通路
在 GO 注释分类的基础上,对差异表达基因进行通路显著性富集分析,KEGG通路分析是可以更清楚地了解基因间相互作用,共同行使生物学功能的途径。结果显示,玫瑰冠公鸡胸肌和科宝公鸡胸肌中差异表达基因显著富集到10条信号通路,包括ECM-受体互作、核糖体、mTOR信号通路、 RNA降解、RNA转运和mRNA监测途径等。玫瑰冠母鸡胸肌和科宝母鸡胸肌中差异表达基因显著富集到11个信号通路,包括核糖体、碳代谢、氧化磷酸化、RNA转运和mRNA监测途径等。KEGG富集结果与GO富集结果相似(图5),这些差异表达基因显著富集的信号通路多与细胞器、RNA加工和修饰及细胞的生物学过程相关。
2.6实时荧光定量PCR验证结果
选取12个差异表达基因进行荧光定量PCR,结果显示,差异表达基因荧光定量结果与RNA-Seq结果的差异倍数存在偏差,但两者在上调和下调的表达趋势相同(图6),表明RNA-Seq所得数据较为准确,可进行后续分析。
3讨论
RNA-Seq转录组学研究方法,可用于快速生长肉鸡与优质肉鸡在肉质性状基因差异表达、调控等方面的研究。Zhang等[15]对固始鸡肌内脂肪细胞和腹部脂肪细胞进行了转录组测序,分别获得了4 403和4 693个差异基因,并显著富集到PPAR、ECM-受体相互作用、局部粘附及Ca2+等信号通路。束婧婷[16]等利用基因芯片技术对清远麻鸡和科宝肉鸡的比目鱼肌进行分析,筛选到20个可能影响肌纤维生长发育及分化的候选基因。本试验采取玫瑰冠鸡和科宝鸡胚胎期第8 d的胸肌组织,使用RNA-Seq技术探讨了2个品种的鸡胸肌组织在转录组水平上的差异,筛选到多个差异表达基因,并被富集到骨骼肌发育、脂肪酸代谢过程、细胞增殖和分化等过程中,这些差异表达基因可能在胚胎期的发育过程中发挥关键作用。
肌肉发育过程中,大量基因的特异性表达形成了复杂的调控网络和信号转导通路。本研究筛选到部分与肌肉发育相关的差异表达基因 ,其中快肌肌球蛋白輕链2基因(MYL2)在动物心肌和骨骼肌的生长和发育过程中发挥重要作用,可能是调节骨骼肌发育和影响家畜肉品质的候选基因[17-18]。肌细胞生成素(MYOG)是成肌调节因子(MRFs)家族的成员之一,在肌肉细胞的形成与分化过程中有重要的调控作用[19-20]。本研究显著富集到在骨骼肌代谢中发挥关键作用的mTOR信号转导通路,mTOR是动物生长的重要调控因子,在细胞的增殖、生长和分化过程起到重要的调控作用[21]。研究结果表明,能量代谢相关的信号通路与肌肉发育相关的信号通路相互作用从而调控肌肉的生长发育,这与束婧婷等[16]的研究结果相似。
肌内脂肪是决定肉质的重要因素[22-24],它的沉积和分化受到众多的基因调控。本研究发现大量的差异表达基因参与了 PPAR 信号转导通路,如乙酰辅酶A羧化酶(ACACA)基因通过促进脂肪酸生物合成在脂质代谢中发挥重要作用[25]。脂酰辅酶A氧化酶2(ACOX2)基因催化支链、长链脂肪酸和胆汁酸的前体分子,并参与脂肪酸代谢、脂蛋白代谢和胆汁酸合成以及过氧化物脂类代谢等过程。脂酰辅酶A氧化酶3(ACOX3)基因则催化2-甲基支链脂肪酸脱氢氧化生成烯脂酰辅酶A和降植烷酸,它们对脂肪酸氧化均具有正调节作用[26-27]。此外,有研究结果表明,Notch1在成脂过程中表达量持续降低,在成熟脂肪细胞分化末期的表达量显著低于分化前[28],表明Notch1可能抑制脂肪细胞的分化。GO富集结果表明,Notch1基因被显著注释到多个与胚胎发育相关的生物学过程中,提示其在胚胎期脂肪分化过程中可能发挥重要作用。KEGG 通路分析结果表明,鸡胚胎期IMF 的沉积不仅受到脂质代谢相关基因和通路的调节,还受到维持组织和细胞信号转导完整性相关通路(局部粘附、ECM-受体互作)的调节和介导,这与Cui等[29]的研究结果一致。
综上所述,本研究采用RNA-Seq技术挖掘了玫瑰冠鸡与科宝鸡胚胎期胸肌组织中大量差异表达的基因,其中MYL2调控骨骼肌的生长发育,MYOG参与肌细胞的形成与分化;ACACA、ACOX2和ACOX3参与脂肪酸代谢过程;Notch1可能参与了与胚胎期脂肪分化相关的生物学过程。KEGG分析结果表明,mTOR信号通路与肌肉发育相关信号通路相互作用从而影响肌纤维的发育,细胞连接相关通路(局部粘附、ECM-受体互作)参与了 IMF 代谢过程,这些信号通路形成了一个调控网络,影响鸡胚胎期肌肉组织的发育及脂肪的沉积。本研究初步揭示了影响玫瑰冠鸡与科宝鸡肌肉发育和脂肪代谢的差异表达基因及信号通路,为家禽肉品质性状的改善奠定了基础。
参考文献:
[1]WANG Y, HUI X, WANG H, et al. Association of H-FABP gene polymorphisms with intramuscular fat content in Three-yellow chickens and Hetian-black chickens[J]. Journal of Animal Science and Biotechnology, 2016, 7(1): 9.
[2]WU G, SHI X, ZHOU J, et al. Differential expression of meat quality and intramuscular fat deposition related genes in Hanjiang black pigs[J]. Acta Biochim Biophys Sin, 2014, 46(12): 1087-1090.
[3]BONNY S P, HOCQUETTE J F, PETHICK D W, et al. The variation in the eating quality of beef from different sexes and breed classes cannot be completely explained by carcass measurements[J]. Animal, 2016,10(6): 987-995.
[4]LIU R, WANG H, LIU J, et al. Uncovering the embryonic development-related proteome and metabolome signatures in breast muscle and intramuscular fat of fast-and slow-growing chickens[J]. BMC Genomics, 2017, 18(1): 816.
[5]SMITH J H. Relation of body size to muscle cell size and number in the chicken[J]. Poultry Science, 1963, 42(2): 283-290.
[6]SPORER K R B, TEMPELMAN R J, ERNST C W, et al. Transcriptional profiling identifies differentially expressed genes in developing turkey skeletal muscle[J]. BMC Genomics, 2011, 12(1): 143.
[7]AL-MUSAWI S L, STICKLAND N C, BAYOL S A M. In ovo temperature manipulation differentially influences limb musculoskeletal development in two lines of chick embryos selected for divergent growth rates[J]. Journal of Experimental Biology, 2012, 215(9): 1594-1604.
[8]廖菁. 鸡肌纤维生长发育规律及Pax基因遗传效应的研究[D].扬州:扬州大学,2010.
[9]任嵩,张蕾,杨娴婧,等. 鸡胚发育早期肌肉中脂肪沉积规律的研究[J]. 中国家禽, 2019(23): 9-14.
[10]YAN X, ZHU M J, DODSON M V, et al. Developmental programming of fetal skeletal muscle and adipose tissue development[J]. Journal of Genomics, 2013, 1: 29.
[11]VELLEMAN S G. Muscle development in the embryo and hatchling[J]. Poultry Science, 2007, 86(5): 1050-1054.
[12]CHARTRIN P, BERNADET M D, GUY G, et al. Do age and feeding levels have comparable effects on fat deposition in breast muscle of mule ducks?[J]. Animal, 2007, 1(1): 113-123.
[13]秦玉梅,任嵩,李佳玉,等. 鸡FSHβ、ESRα基因多态性及其合并基因型与产蛋性能的关联性分析[J]. 江苏农业学报, 2017,33(4): 854-862.
[14]杨娴婧,韩雨轩,王海亮,等. 不同品种鸡肌肉营养价值及风味的研究[J]. 中国家禽, 2018(2): 9-14.
[15]ZHANG M, LI F, MA X, et al. Identification of differentially expressed genes and pathways between intramuscular and abdominal fat-derived preadipocyte differentiation of chickens in vitro[J]. BMC Genomics, 2019, 20(1): 1-15.
[16]束婧婷,章明,宋迟,等. 基于表达谱芯片挖掘清远麻鸡和科宝肉鸡比目鱼肌差异表达基因[J]. 畜牧兽医学报, 2016, 47(1): 25-33.
[17]刘瑞莉,吴磊,袁玮,等. MYL2基因在肌肉生长过程中的研究[J]. 黑龙江畜牧兽医, 2018 (3): 10-14.
[18]CUI H X, LIU R R, ZHAO G P, et al. Identification of differentially expressed genes and pathways for intramuscular fat deposition in pectoralis major tissues of fast-and slow-growing chickens[J]. BMC Genomics, 2012, 13(1): 213.
[19]WRIGHT W E, SASSOON D A, LIN V K. Myogenin, a factor regulating myogenesis, has a domain homologous to MyoD[J]. Cell, 1989, 56(4): 607-617.
[20]BERGSTROM D A, TAPSCOTT S J. Molecular distinction between specification and differentiation in the myogenic basic helix-loop-helix transcription factor family[J]. Molecular and Cellular Biology, 2001, 21(7): 2404-2412.
[21]宫克城. mTOR 信号转导通路在运动后骨骼肌的生长代谢中的作用[J]. 首都体育学院学报, 2009 (4): 449-453.
[22]肖俊,华国洪,李华,等. 海康鸡屠宰性能及肉质特性分析[J]. 江苏农业科学,2019,47(17):196-200.
[23]陆宇哲,潘红平,王帅,等. 3种不同来源中华乌塘鳢成鱼肉质比较分析[J]. 南方农业学报,2018,49(10):2047-2054.
[24]邝良德,谢晓红,郭志强,等. 鲜喂饲用苎麻对肉兔生产性能、肉质及经济效益的影响[J]. 江苏农业科学,2018,46(19):174-176.
[25]BARBER M C, PRICE N T, TRAVERS M T. Structure and regulation of acetyl-CoA carboxylase genes of metazoa[J]. Biochimica et Biophysica Acta (BBA)-Molecular and Cell Biology of Lipids, 2005, 1733(1): 1-28.
[26]JOHANSSON , CURRAN J E, JOHNSON M P, et al. Identification of ACOX2 as a shared genetic risk factor for preeclampsia and cardiovascular disease[J]. European Journal of Human Genetics, 2011, 19(7): 796.
[27]VAN VELDHOVEN P P, VANHOVE G, ASSSELBERGHS S, et al. Substrate specificities of rat liver peroxisomal acyl-CoA oxidases: palmitoyl-CoA oxidase (inducible acyl-CoA oxidase), pristanoyl-CoA oxidase (non-inducible acyl-CoA oxidase), and trihydroxycoprostanoyl-CoA oxidase[J]. Journal of Biological Chemistry, 1992, 267(28): 20065-20074.
[28]袁偉,李作农,曾瑞霞,等. Notch 信号在人脂肪源间充质干细胞成脂中的作用[J]. 解剖科学进展, 2017, 23(6): 626-629.
[29]CUI H, ZHENG M, ZHAO G, et al. Identification of differentially expressed genes and pathways for intramuscular fat metabolism between breast and thigh tissues of chickens[J]. BMC Genomics, 2018, 19(1): 55.
(责任编辑:陈海霞)

