20%菜籽粕和谷氨酰胺添加对黔东南小香鸡肠道指数及免疫机能的影响
张柏林 刘宁 杨乾 谢宇潇 王庆容 宋培勇 曹珍 廖世永

摘要:为研究日粮中添加20%菜籽粕及20%菜籽粕日粮中添加不同水平谷氨酰胺(Glutamine,Gln)对黔东南小香鸡肠道指数及免疫机能的影响,将120只1 日龄体质量相近的黔东南小香鸡随机分为4组,分别为对照组(饲喂基础日粮)、菜籽粕组(菜籽粕等量替代基础日粮中20%豆粕)及菜籽粕组日粮中分别添加0.5%、1.0% Gln的试验组,每组5个重复,每个重复6只鸡,试验期为21 d。结果表明:与对照组相比,20%菜籽粕添加显著降低了采食量及体增质量(P<0.05),显著降低了十二指肠、空肠及回肠相对长度和相对质量(P<0.05)及脾脏、胸腺和法氏囊指数(P<0.05)。此外,20%菜籽粕添加还显著降低了血清免疫球蛋白A(Immunoglobulin A,IgA)、免疫球蛋白G(Immunoglobulin G, IgG)及免疫球蛋白M(Immunoglobulin M,IgM)含量(P<0.05),降低了空肠黏膜免疫分泌型免疫球蛋白A(Secretory immunoglobulin A,sIgA)含量以及空肠黏膜MUC1和MUC2 mRNA表达水平(P<0.05)。与20%菜籽粕组相比,20%菜籽粕日粮中添加0.5% Gln仅显著增加了回肠相对长度(P<0.05);而20%菜籽粕日粮中添加1.0% Gln显著增加了十二指肠、空肠及回肠相对长度和相对质量(P<0.05),显著增加了脾脏、胸腺和法氏囊免疫器官指数(P<0.05),显著增加了血清IgA、IgG和IgM含量(P<0.05),显著增加了空肠黏膜sIgA含量和空肠黏膜MUC1和MUC2 mRNA表达水平(P<0.05)。由此可见,日粮中20%菜籽粕添加显著降低了黔东南小香鸡肠道指数及肠道免疫机能,但在20%菜籽粕日粮中添加1.0% Gln则对菜籽粕产生的抑制作用具有较好的改善作用。
关键词:谷氨酰胺;菜籽粕;黔东南小香鸡;肠道指数;免疫机能
中图分类号:S816.11文獻标识码:A文章编号:1000-4440(2020)05-1255-10
Abstract: The aim of this study was to investigate the effects of 20% rapeseed meal and 20% rapeseed meal supplemented with different levels of glutamine (Gln) on intestine indices and immune function of Qiandongnan Xiaoxiang chicken. A total of 120 1-day-old Qiandongnan Xiaoxiang chicken with similar body weight were randomly divided into four groups (A, B, C and D), and there were five replicates in each group and six chickens per replicate. Group A was defined as control group and was fed with the basal diet, whereas group B was fed with diets supplemented with 20% rapeseed meal (equivalent amount of soybean meal was replaced by rapeseed meal in the basal diet), and group C and group D were separately supplemented with 0.5% Gln and 1.0% Gln on the basis of the basal diet. The duration of this experiment was 21 days. Compared with the control group, dietary supplemented with 20% rapeseed meal significantly decreased feed intake and body weight gain (P<0.05), decreased the relative length and relative weight of duodenum, jejunum and ileum (P<0.05) and decreased spleen index, thymus index and bursa index (P<0.05). Moreover, dietary supplemented with 20% rapeseed meal significantly decreased the contents of immunoglobulin A(IgA), immunoglobulin G(IgG) and immunoglobulin M(IgM) in serum (P<0.05), and decreased the secretory immunoglobulin A (sIgA) contents and mRNA expression levels of MUC1 and MUC2 in jejunal mucosa (P<0.05). Compared with 20% rapeseed meal supplementation group, 0.5% Gln supplementation only increased relative length of ileum (P<0.05), but 1.0% Gln supplementation significantly increased the relative length and relative weight of duodenum, jejunum and ileum and spleen index, thymus index and bursa index (P<0.05). Additionally, 1.0% Gln supplementation increased the contents of IgA, IgG and IgM in serum (P<0.05) and the content of sIgA in jejunal mucosa (P<0.05), and mRNA expression levels MUC1 and MUC2 in jejunal mucosa (P<0.05). Therefore, 20% rapeseed meal supplementation significantly reduced intestine indices and immune function of Qiandongnan Xiaoxiang chicken, however, 1.0% Gln supplementation could improve the inhibitory effect.
Key words:glutamine;rapeseed meal;Qiandongnan Xiaoxiang chicken;intestine index;immune function
黔东南小香鸡是贵州省极具特色的优质肉鸡品种,主要分布于贵州省黔东南及邻近地区,具有体型娇小、结实紧凑、结构匀称、适应能力强等特点[1]。但传统的黔东南小香鸡饲养主要是粗放式,没有统一的日粮配制标准。近年来随着小香鸡规模化养殖的推行,其日粮的科学配制也越来越受到关注。但随着中国畜牧业的快速发展,蛋白质饲料尤其是优质蛋白质饲料资源供应紧缺已成为限制中国饲料工业发展的重要因素。中国杂粕资源丰富,因而选择一定比例的杂粕来代替豆粕,对中国饲料行业的可持续发展具有深远意义[2]。
菜籽粕是榨取菜籽油后的副产物,并且菜籽粕含有较多的粗蛋白质,粗蛋白质含量为30.0%~39.7%,富含蛋氨酸,是优质的禽类饲料蛋白质来源[3-4]。然而,菜籽粕中含有硫代葡萄糖苷、植酸、芥子碱和单宁等抗营养因子,能够影响动物的肠道发育、养分消化利用率及免疫性能,这在一定程度上限制了其在饲料中的应用[5-6]。大多数研究结果表明,在早期肉鸡日粮中添加10%左右的菜籽粕并不影响肉鸡的生长性能[7-9]。然而随着菜籽粕添加量的增加,菜籽粕会对肉鸡产生不利影响。Rabie等[9]选用Cobb肉鸡为研究对象,分别在其日粮中添加0、10.0%、12.5%、15.0%及20.0%的菜籽粕,发现日粮中添加20.0%菜籽粕显著降低了21日龄肉鸡的平均日增质量,增加了料质量比,而其他菜籽粕添加水平对肉鸡平均日增质量及料质量比均没有显著影响。Min等[10]选用1日龄肉鸡为研究对象,分别在其日粮中添加0、5%、10%、15%、20%及25%水平的菜籽粕,试验期为18 d,发现日粮中添加25%菜籽粕显著降低了肉鸡平均日增质量及平均日采食量。Gopinger等[8]研究结果显示,日粮中菜籽粕含量达到或超过20%时,肉鸡的肠道形态受到破坏。尽管菜籽粕是优良的豆粕替代品,但以上结果均表明,日粮中添加高剂量的菜籽粕(达到或超过20%)会降低肉鸡生长性能,破坏肠道形态,进而影响肉鸡的生长及健康。然而,小肠是机体养分消化和利用的重要场所,具有重要的黏膜屏障功能。因此,尽早地促进幼禽肠道的功能完善将有利于提高雏鸡健康,进而更大程度地发挥其生长潜力和提高机体的抗病能力[11-12]。因此,为了尽可能地提高菜籽粕在日粮中的添加水平,我们设想在日粮中添加20%菜籽粕的基础上采取营养性干预措施对肉鸡肠道进行保护,进而为肉鸡发挥最大的生产潜能提供保障。
谷氨酰胺(Glutamine,Gln)是肠道细胞的“重要燃料”,具有促进肠上皮细胞增殖与分化的作用[13]。日粮中添加Gln有利于促进肠道生长及发育,促进免疫细胞增殖、免疫器官发育,增强机体免疫机能[14-16]。Bartell[17]研究结果表明,日粮中添加1% Gln 显著增加了肉鸡十二指肠及空肠绒毛高度。Wu等[13]的研究结果同样表明,日粮中添加1% Gln增加了肠道绒毛高度及绒毛高度与隐窝深度的比值。并且,日粮中添加Gln有利于维持肠道形态结构的完整性,提高肠道黏膜免疫水平[18]。王中华等[19]在肉鸡日粮中分别添加0、0.5%、1.0%及1.5% Gln,发现日粮中添加Gln显著增加了肉鸡胸腺指数及脾脏指数,并且以1.0% Gln添加效果最好。以上结果说明,日粮中添加Gln有利于促进肠道及免疫器官发育。因此,我们推测,日粮中添加Gln有可能降低高剂量菜籽粕添加对肉鸡肠道发育及健康的不利影响,但到目前为止,有关研究还未见报道。因此,本研究拟选取黔东南小香鸡为研究对象,通过在其日粮中添加20%菜籽粕及不同水平Gln,研究其对黔东南小香鸡免疫性能及肠道免疫机能的影响,从而为黔东南小香鸡早期日粮的科学配制及菜籽粕的合理利用提供参考依据。
1材料与方法
1.1试验设计及饲养管理
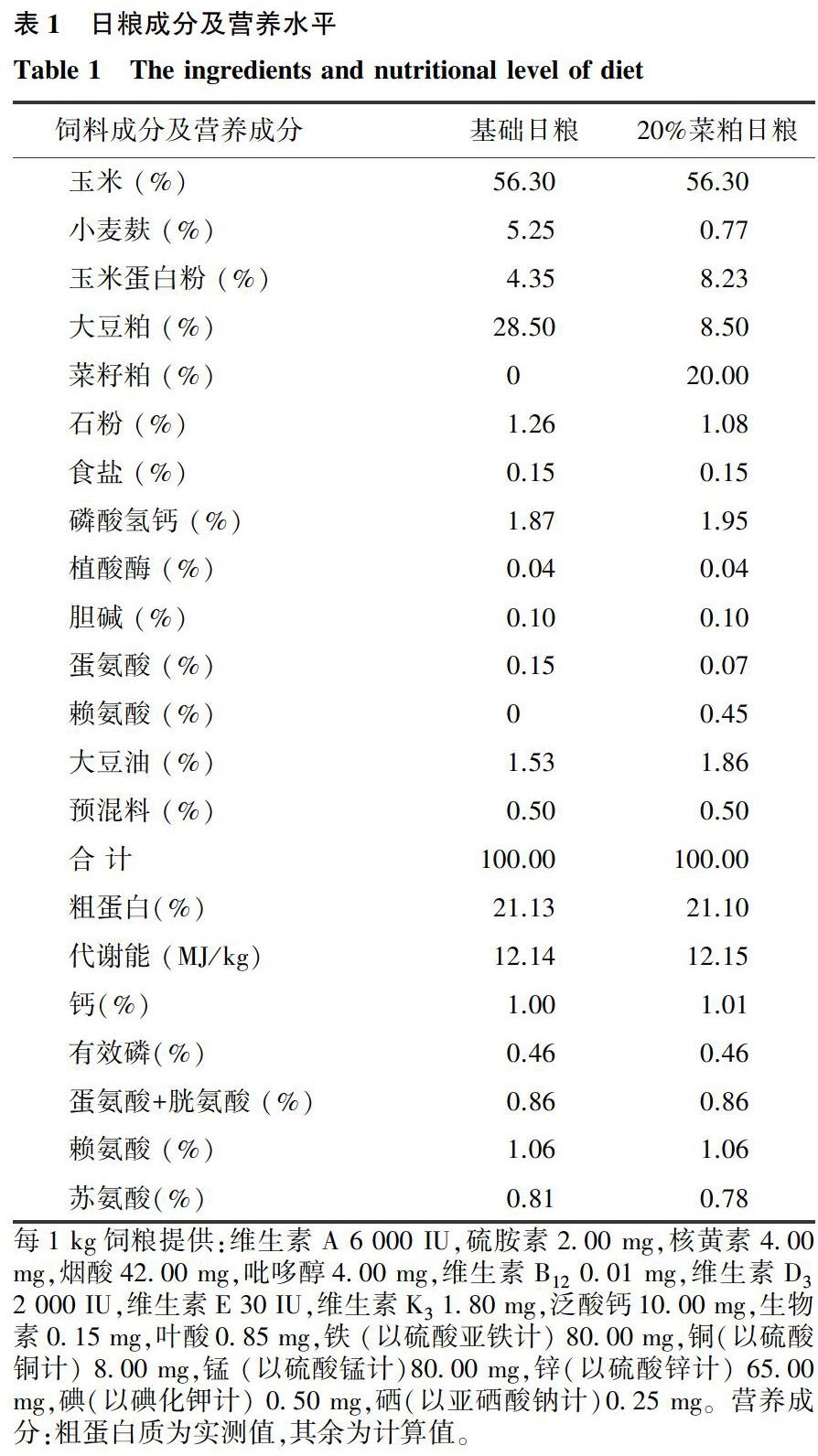
选用120只1日龄体质量相近且健康的雄性黔东南小香鸡,随机分为4组,分别为对照组(饲喂基础日粮)、菜籽粕组(菜籽粕等量替代对照组日粮中20%豆粕)及菜籽粕日粮组中分别添加0.5%和1.0% Gln试验组,每个处理组5个重复,每个重复6只鸡。基础日粮和菜籽粕组日粮为等能等氮日粮。日粮配制参照鸡饲养标准(2004)进行。日粮配方及营养成分如表1所示。
试验在贵州省榕江山农发展有限责任公司进行。试验鸡只采取离地笼养,6只/笼,早、中、晚各饲喂1次。整个试验期,鸡只自由采食及饮水。在试验1~3 d,鸡舍内温度保持在35 ℃左右,以后每2 d下降1 ℃,直到降至25 ℃左右,相对湿度维持在55%~65%左右。整个试验期,鸡只采用23 h光照和 1h黑暗的光照程序。保持鸡舍干燥清洁,按照常规免疫程序进行免疫,试验期为21 d。
1.2主要试验材料及来源
试验所用菜籽粕购自遵义金鼎农业科技有限公司(粗蛋白质含量为35.00%)。Gln购自上海斐雅科技发展有限公司,含量为99.10%。
1.3主要试验仪器
FA-1004型电子天平,上海精密科学仪器有限公司生产;VELP ZX3型旋涡混匀器,东南科创科技有限公司生产;BBS-SDC型超净工作台,济南鑫贝西生物技术有限公司生产;UVS-99型微量核蛋白测试仪,上海创萌生物科技有限公司生產;CFX Connect-三通道梯度荧光定量PCR仪,美国Bio-Rad公司生产)。
1.4样品采集
1.4.1小肠组织收集试验结束前1 d晚上6∶00,所有鸡只进行断料处理,但可自由饮水。第2 d早上8∶00,所有鸡只进行空腹称质量。每个处理组分别选择10只符合群体均质量的肉鸡进行称质量并宰杀。宰杀后立即打开腹腔,分别收集十二指肠、空肠及回肠,用于肠道指数的测定。
1.4.2免疫器官收集分别摘取脾脏、胸腺和法氏囊等免疫器官,并用精密电子天平称质量,用以免疫器官指数的测定。
1.4.3血清收集将方法1.4.1中每个处理选择的10只空腹称质量的黔东南小鸡进行宰杀,采集颈静脉血液至10 ml离心管中,倾斜放置以利于血清析出。在4 ℃、2 500 r/min条件下离心15 min,将收集到的血清进行分装,保存在-20 ℃冰箱中待测。
1.4.4空肠黏膜收集在空肠中部采集5 cm左右的肠段,纵向剖开肠段,用预冷的生理盐水冲掉食糜,用载玻片刮取肠黏膜后装入2 ml冻存管中,放入液氮中保存待测。
1.5测定指标及方法
1.5.1肠道指数测定将鸡只宰杀(每个处理10只,每个重复2只)后立即打开腹腔,分别采集十二指肠、空肠及回肠,除去肠系膜并轻轻挤出食糜,用精密天平和尺子分别测定各肠段的质量及长度,进行肠道指数计算。公式如下:肠道相对长度=各肠段长度(cm)/宰前活质量(kg)。肠道相对质量=各肠段质量(g)/宰前活质量(kg)。
1.5.2免疫器官指数测定纵向打开腹腔分别摘取脾脏、胸腺和法氏囊。用精密天平分别称取胸腺、脾脏和法氏囊质量进行免疫器官指数测定,具体计算公式如下:免疫器官指数(g/kg)=免疫器官质量(g)/宰前活质量(kg)。
1.5.3血清免疫球蛋白含量测定采用商品化试剂盒进行血清免疫球蛋白A(Immunoglobulin A,IgA)、免疫球蛋白G(Immunoglobulin G, IgG)及免疫球蛋白M(Immunoglobulin M,IgM)含量测定,试剂盒购自南京建成生物工程研究所。操作步骤严格按照试剂盒说明书进行。
每1 kg饲粮提供:维生素A 6 000 IU,硫胺素2.00 mg,核黄素4.00 mg,烟酸42.00 mg,吡哆醇4.00 mg,维生素B12 0.01 mg,维生素D3 2 000 IU,维生素E 30 IU,维生素K3 1.80 mg,泛酸钙10.00 mg,生物素0.15 mg,叶酸0.85 mg,铁 (以硫酸亚铁计) 80.00 mg,铜(以硫酸铜计) 8.00 mg,锰 (以硫酸锰计)80.00 mg,锌(以硫酸锌计) 65.00 mg,碘(以碘化钾计) 0.50 mg,硒(以亚硒酸钠计)0.25 mg。营养成分:粗蛋白质为实测值,其余为计算值。
1.5.4空肠黏膜分泌型免疫球蛋白A(Secretory immunoglobulin A,sIgA)含量测定空肠黏膜sIgA含量测定采用商品化试剂盒测定,具体操作按照试剂盒说明书进行。试剂盒购自南京建成生物工程研究所。
1.5.5空肠黏膜黏蛋白基因MUC1和MUC2 mRNA表达水平的测定称取一定质量的空肠黏膜样品,放入盛有1 ml预冷的 RNAiso Plus(产品编号:D9108A,TaKaRa)的DEPC预处理的5 ml离心管中,冰浴匀浆至液体澄清为止。然后经分相、RNA沉淀、RNA洗涤及RNA重溶,并用微量分光光度计测定所提取RNA的OD260/280值。利用PrimeScriptTM RT master Mix反转试剂盒进行RNA的转录,将转录后的cDNA置于-20 ℃保存。根据NCBI公布的基因序列设计目的基因引物并以β-actin基因作内参,所有引物由生工生物公司合成,内参及目的基因序列见表2。
利用TB Green Premix Ex Taq试剂盒(No. RR420A)进行RT-PCR试验,按试剂盒说明书操作。基因表达的相对定量计算参照Livak 等[20]的方法进行。
1.6数据统计与分析
应用SPSS 20.0中的一般线性模型进行方差分析,若差异显著则用Duncans进一步进行比较。结果以平均数及平均标准误表示,P<0.05表示差异显著。
2结果与分析
2.120%菜籽粕和Gln添加对黔东南小香鸡生长性能的影响
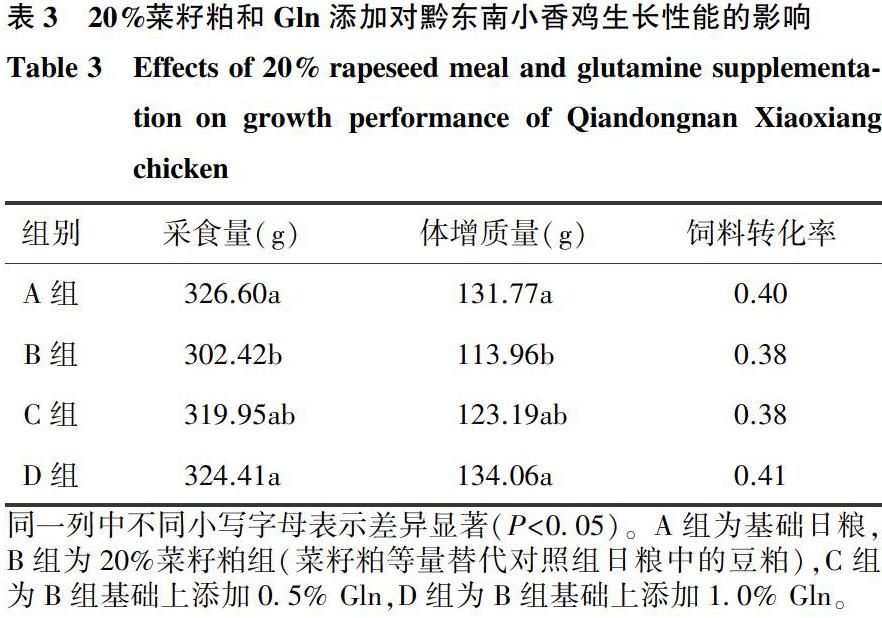
如表3所示,日粮中添加20%菜籽粕显著降低了黔东南小香鸡的采食量及体增质量(P<0.05),但对饲料转化率没有显著影响(P>0.05)。与20%菜籽粕组相比,日粮中添加0.5% Gln对采食量、体增质量及饲料转化率均没有显著影响(P>0.05)且与对照组差异不显著(P>0.05)。然而,日粮中添加1.0% Gln显著增加了体增质量及采食量(P<0.05),但对饲料转化率没有显著影响(P>0.05),且与对照组差异不显著(P>0.05)。
2.220%菜籽粕和Gln添加对黔东南小香鸡肠道指数的影响
如表4所示,日粮中添加20%菜籽粕显著降低了黔东南小香鸡十二指肠、空肠及回肠的相对长度和相对质量(P<0.05)。与20%菜籽粕组相比,日粮中添加0.5% Gln显著增加了回肠相对长度(P<0.05),但对十二指肠和空肠的相对长度及相对质量、回肠相对质量均没有显著影响(P>0.05),并且0.5% Gln添加组空肠相对质量与对照组差异不显著(P>0.05),但十二指肠和回肠相对长度及相对质量、空肠相对长度均显著低于对照组(P<0.05);日粮中添加1.0% Gln显著增加了十二指肠、空肠及回肠的相对长度和相对质量(P<0.05),并且与对照组差异不显著(P>0.05)。日粮中添加1.0% Gln组十二指肠相对长度及相对质量、回肠相对长度均显著高于0.5% Gln添加组(P<0.05)。
2.320%菜籽粕和Gln添加对黔东南小香鸡免疫器官指数的影响
如表5所示,与对照组相比,20%菜籽粕添加显著降低黔东南小香鸡胸腺指数、法氏囊指数和脾脏指数(P<0.05)。与20%菜籽粕組相比,日粮中添加0.5% Gln对胸腺指数、法氏囊指数和脾脏指数无显著影响(P>0.05),且与对照组差异不显著(P>0.05);日粮中添加1.0% Gln显著增加了胸腺指数、法氏囊指数和脾脏指数(P<0.05),且与对照组差异不显著(P>0.05)。1.0% Gln添加组脾脏指数和胸腺指数均显著高于0.5% Gln添加组(P<0.05),但法氏囊指数与0.5% Gln添加组差异不显著(P>0.05)。
2.420%菜籽粕和Gln添加对黔东南小香鸡血清免疫球蛋白含量的影响
如表6所示,与对照组相比,20%菜籽粕添加显著降低了黔东南小香鸡血清IgA、IgM和IgG含量(P<0.05)。与20%菜籽粕组相比,日粮中添加0.5% Gln对血清IgA、IgM和IgG含量没有显著影响(P>0.05),但显著低于对照组(P<0.05);日粮中添加1.0% Gln显著增加了血清IgA、IgM和IgG含量(P<0.05),且與对照组差异不显著(P>0.05)。日粮中添加1.0% Gln组血清IgA、IgM和IgG含量均显著高于0.5% Gln添加组(P<0.05)。
2.520%菜籽粕和Gln添加对黔东南小香鸡空肠黏膜sIgA含量的影响
如图1所示,与对照组相比,20%菜籽粕添加显著降低了黔东南小香鸡空肠黏膜sIgA含量(P<0.05)。与20%菜籽粕组相比,日粮中添加0.5% Gln对空肠黏膜sIgA含量的影响不显著(P>0.05),但显著低于对照组(P<0.05);日粮中添加1.0% Gln显著增加了空肠黏膜sIgA含量(P<0.05),且与对照组差异不显著(P>0.05)。日粮中添加1.0% Gln组空肠黏膜sIgA含量显著高于0.5% Gln添加组(P<0.05)。
2.620%菜籽粕和Gln添加对黔东南小香鸡空肠黏膜MUC1和MUC2 mRNA表达的影响
如图2所示,与对照组相比,20%菜籽粕添加显著降低了黔东南小香鸡空肠黏膜MUC1及MUC2 mRNA表达水平(P<0.05); 与20%菜籽粕组相比,添加0.5% Gln对MUC1和MUC2 mRNA表达水平没有显著影响(P>0.05),但显著低于对照组(P<0.05)。然而,日粮中添加1.0% Gln显著增加了MUC1和MUC2 mRNA表达水平(P<0.05),且与对照组差异不显著(P>0.05)。日粮中添加1.0% Gln组空肠黏膜MUC1及MUC2 mRNA表达水平均显著高于0.5% Gln添加组(P<0.05)。
3讨论
3.120%菜籽粕和Gln添加对黔东南小香鸡生长性能的影响
菜籽粕是家禽日粮中常用的蛋白质来源,是一种经济有效的大豆粕替代品[20-21]。然而,菜籽粕中含有大量抗营养因子,如葡萄糖硫甙、芥子酸、植酸和一些可溶性非淀粉多糖,这些抗营养因子的存在会影响家禽的生长性能[22]。Rabie等[9]研究结果表明,日粮中添加20%菜籽粕显著降低了1~21日龄肉鸡生长性能。Sina等[23]研究结果同样表明,日粮中添加20%菜籽粕显著降低了1~21日龄肉鸡体增质量。本研究也发现,日粮中添加20%菜籽粕显著降低了1~21日龄肉鸡采食量及料质量比。本研究中,20%菜籽粕添加对生长性能的抑制作用可能是由于菜籽粕中抗营养因子的存在降低了肉鸡生长性能。然而,日粮中添加1.0% Gln显著增加了肉鸡总采食量,增加了体增质量。Dai等[24]研究结果也显示,日粮中添加1.0% Gln显著增加了肉鸡生长性能。Bartell等[25]研究结果同样表明,与对照组相比,日粮中添加1.0% Gln显著增加了肉鸡体增质量,平均提高了11%。日粮中添加1.0% Gln对生长性能的改善作用可能是由于Gln添加提高了养分的消化率,进而改善了生长性能。
3.220%菜籽粕和Gln添加对黔东南小香鸡肠道指数的影响
本研究结果表明,日粮中添加20%菜籽粕显著降低了黔东南小香鸡十二指肠、空肠及回肠相对长度和相对质量。这表明,日粮中添加高剂量的菜籽粕影响了黔东南小香鸡的肠道发育。菜籽粕中抗营养因子可使肉鸡肠道产生过敏反应,使得肠道绒毛高度降低,造成肠道黏膜萎缩[26]。本研究中肠道指数的降低可能与高剂量菜籽粕添加使得日粮中抗营养因子水平较高有关。与20%菜籽粕组相比,日粮中添加0.5% Gln显著增加回肠相对长度,1.0% Gln添加则显著增加了十二指肠、空肠及回肠相对长度和相对质量。戴四发等[27]研究发现,日粮中添加0.4% Gln显著增加了3周龄AA肉鸡的回肠长度及相对质量,但对十二指肠和空肠的影响不显著。与本研究结果相似,黄晓亮等[28]研究结果同样表明,外源性Gln添加可以促进小肠的生长发育,表现为肉鸡十二指肠、空肠和回肠质量及长度的增加。以上结果表明,日粮中添加Gln对肠道生长发育具有促进作用,并且具有剂量依赖性。Gln可为肠道上皮细胞提供代谢燃料,促进细胞增殖和分化,从而促进肠道形态和黏膜发育[29]。以上结果表明高剂量菜籽粕日粮中添加1.0% Gln可能通过促进肠道上皮细胞增殖和发育,进而引起肠道指数的增加。
3.320%菜籽粕和Gln添加对黔东南小香鸡免疫器官指数的影响
免疫器官指数是反映免疫器官发育状况的指标,是评价机体免疫状态的重要指标。免疫器官的发育状况直接影响机体的免疫应答水平和抵抗外来病原菌入侵的能力[30]。脾脏、胸腺和法氏囊是禽类最重要的免疫器官。其中,胸腺主要参与细胞免疫,而脾脏具有参与免疫应答的功能,法氏囊是禽类所特有的中枢淋巴器官[31]。动物的免疫能力取决于免疫器官的生长发育状态及机能强弱,它的生长发育影响着肉鸡的免疫能力[32]。本试验结果表明,日粮中添加20%菜籽粕显著降低了黔东南小香鸡免疫器官指数。吴正可[33]研究结果表明,日粮中添加15%菜籽粕显著降低了21日龄肉鸡胸腺指数,但对脾脏指数和法氏囊指数没有影响。这意味着,日粮中添加高水平的菜籽粕在一定程度上影响了肉鸡免疫器官的发育,降低了机体免疫机能。在正常情况下,免疫器官的质量会随着器官细胞的增殖分化而升高,免疫器官指数的升高则意味着免疫系统的快速成熟[34]。本试验结果表明,日粮中添加1.0% Gln可增加免疫器官指数,说明Gln对免疫器官的生长发育具有促进作用,这与周联高等[31]的研究结果相似。日粮中添加Gln能够促进免疫器官的发育和成熟,提高机体免疫机能,具体表现为:胸腺内胸腺小叶数量增加,法氏囊内淋巴滤泡数量增多及脾脏内脾小结增多、增大[35-36]。此外,日粮中添加Gln为机体免疫器官的发育提供了丰富的嘌呤、嘧啶等活性前体物质,从而促进了免疫器官的生长发育[37-38]。以上结果表明,日粮中添加Gln可能通过加强免疫细胞增殖分化,促进胸腺、脾脏及法氏囊等免疫器官的发育,增强机体的细胞免疫和体液免疫功能,从而改善日粮中高剂量菜籽粕添加对免疫机能的不利影响。
3.420%菜籽粕和Gln添加对黔东南小香鸡免疫球蛋白含量的影响
免疫球蛋白IgA、IgG和IgM由浆细胞分泌,是一类结构相似并具有抗体活性的血清球蛋白,其含量的高低能反应机体免疫系统的状况,是评价免疫系统的一项重要指标[39-40]。本研究发现,20%菜籽粕添加显著降低了血清IgA、IgG和IgM含量。Aleksandra等[5]研究结果表明,日粮中添加15%菜籽粕显著降低了肉鸡IgM含量,但對IgA含量没有影响。这与本研究的结果不同,造成结果出现差异的原因可能是由于菜籽粕的添加量不同引起。本试验结果表明,在20%菜籽粕日粮中添加0.5% Gln对IgA、IgG和IgM含量并没有显著影响,但添加1.0% Gln显著增加IgA、IgM和IgG含量。这可能是由于Gln对血清免疫球蛋白含量的影响具有剂量依赖性。Bartell等[25]也得到了与本试验相似的结果,日粮中添加1.0% Gln显著增加了21日龄Cobb肉鸡血清 IgA 及IgG含量。Gln添加能够促CD4+(T-辅助细胞的一种)的增殖[41],而IgG及IgM是T辅助细胞依赖性抗体,是T辅助细胞响应的指示物[42]。这意味着Gln可能通过提高T-辅助细胞的增殖而增加了血清IgG或IgM含量。20%菜籽粕日粮降低了黔东南小香鸡的体液免疫水平,而在其日粮中添加1.0% Gln则有助于改善这种不利影响。
3.520%菜籽粕和Gln添加对黔东南小香鸡空肠黏膜sIgA含量的影响
sIgA是肠道淋巴细胞产生和分泌的一种IgA抗体,是机体发挥免疫作用的一道重要屏障,可以阻止细菌等病原微生物在黏膜表面的黏附,具有免疫清除、免疫屏障、中和病毒等功能[43-46]。但到目前为止,有关菜籽粕添加对肠道sIgA分泌的影响还未见报道。本试验结果表明,20%菜籽粕添加显著降低了空肠黏膜sIgA的含量。sIgA是肠道黏膜固有层浆细胞产生的主要免疫效应因子,是机体分泌量最多的免疫球蛋白。并且,sIgA为主的体液免疫在肠道免疫中起主要作用,对肠道黏膜起着重要的保护作用[47]。本研究中sIgA含量的降低与血清免疫球蛋白(IgA、IgG及IgM)含量降低的结果是相一致的,这意味着20%菜籽粕添加降低了机体体液免疫水平,这种效应可能与菜籽粕中含有大量的抗营养因子有关。然而,日粮中添加1.0% Gln显著增加了肉鸡空肠黏膜sIgA的含量。这与李虎等[32]的研究结果相似,其研究结果表明,日粮中添加Gln显著增加了肉鸡十二指肠sIgA含量。并且日粮中添加Gln能够显著增加肠黏膜中分泌sIgA浆细胞数量,增加肠道sIgA含量[18,48],而Gln缺乏或不足时,sIgA含量随之下降[49]。因此,我们推测,日粮中添加Gln可能通过增加空肠黏膜sIgA浆细胞数量,进而增加空肠黏膜sIgA含量,从而有效解除了高剂量菜籽粕添加对肠道免疫球蛋白分泌的抑制作用,在一定程度上增强了肠道黏膜的免疫屏障功能。
3.620%菜籽粕和Gln添加对黔东南小香鸡空肠黏膜MUC1和MUC2 mRNA表达水平的影响
黏蛋白是一类由组织上皮细胞分泌的糖蛋白,在不同组织中具有不同的功能,主要由杯状细胞和潘氏细胞分泌。在肠道组织中主要是膜结合型MUC1和分泌型MUC2 2种。其中,MUC2是构成肠黏液层的主要成分,而MUC1有保护和润滑作用,可促进上皮细胞的黏附,从而增强肠道免疫能力[50-51]。但就我们所知,到目前为止,有关Gln对肉鸡肠道黏膜MUC1及MUC2 mRNA表达水平的影响还未见报道。本试验结果显示,20%菜籽粕添加可显著降低空肠黏膜MUC1及MUC2 mRNA表达水平,而添加1.0% Gln则显著增加了MUC1和MUC2 mRNA表达水平。Gln是肠道黏膜细胞的重要能量来源,在肠道修复和肠道免疫系统方面发挥着重要作用[52-53]。Wang等[54]研究结果表明,含有Gln的肠外营养可提高小鼠小肠MUC2 mRNA表达水平。高玉琪等[55]研究结果表明,日粮中添加Gln显著增加了獭兔回肠黏膜MUC1 mRNA表达水平。这可能是由于日粮中添加Gln刺激了肠隐窝干细胞增殖并转化为杯状细胞,从而增加肠道黏蛋白的分泌,进而增强肠道的免疫性能[56]。
4结论
日粮中20%菜籽粕添加降低了黔东南小香鸡免疫性能及肠道免疫水平,在其日粮中添加1.0% Gln在一定程度上缓解了高含量菜籽粕添加对黔东南小香鸡免疫机能的不利影响,有利于提高机体的免疫机能和生长性能。
参考文献:
[1]廖飞,赵孝木,姜艳,等.黔东南小香鸡的品种遗传资源特点及开发利用[J]. 贵州畜牧兽医, 2015, 39(3):27-29.
[2]吴莹,樊振,马贵军.发酵蛋白饲料在畜牧养殖行业中的研究应用进展[J]. 饲料研究, 2018(6):1-3,13.
[3]刘丹丹,汝应俊,年芳,等.肉仔鸡对不同来源菜籽粕氨基酸消化率的比较研究[J]. 甘肃农业大学学报, 2014, 49(2):13-20.
[4]NEGA T, WOLDES Y. Review on nutritional limitations and opportunities of using rapeseed meal and other rape seed by-products in animal feeding[J]. Journal of Nutritional Health & Food Engineering, 2018, 8(1): 43-48.
[5]ALEKSANDRA D, KATARZYNA O, ANITA Z, et al. The effect of raw and fermented rapeseed cake on the metabolic parameters, immune status, and intestinal morphology of turkeys[J]. Poultry Science, 2018, 97(11): 1-11.
[6]GRELA E, CZECH A, KIESZ M, et al. A fermented rapeseed meal additive: Effects on production performance, nutrient digestibility, colostrum immunoglobulin content and microbial flora in sows[J]. Animal Nutrition, 2019, 5 (4):373-379.
[7]WOYENGO T A, KIARIE E, NYACHOTI C M. Growth performance, organ weights, and blood parameters of broilers fed diets containing expeller-extracted canola meal[J]. Poultry Science, 2011, 90 (11):2520-2527.
[8]GOPINGER E, XAVIER E G, ELIAS M C, et al. The effect of different dietary levels of canola meal on growth performance, nutrient digestibility, and gut morphology of broiler chickens[J]. Poultry Science, 2014, 93 (5):1130-1136.
[9]RABIE M H, HAYAM M A, ABO E M, et al. Nutritional and physiological effects of different levels of canola meal in broiler chick diets[J]. Asian Journal of Animal and Veterinary Advances, 2015, 10(4):161-172.
[10]MIN Y N, HANCOCK A, YAN F, et al. Use of combinations of canola meal and distillers dried grains with solubles in broiler starter diets[J]. Journal of Applied Poultry Research, 2009, 18 (4):725-733.
[11]GAO T, ZHAO M, ZHANG L, et al. In ovo feeding of l-arginine regulates intestinal barrier functions of posthatch broilers by activating the mTOR signaling pathway[J]. Journal of the science of food and agriculture, 2018, 98(4):1416-1425.
[12]UNI Z, TAKO E, GAL-GARBER O, et al. Morphological, molecular, and functional changes in the chicken small intestine of the late-term embryo[J]. Poultry Science, 2003, 82 (11):1747-1754.
[13]WU Q, LIU N, WU X, et al. Glutamine alleviates heat stress-induced impairment of intestinal morphology, intestinal inflammatory response, and barrier integrity in broilers[J]. Poultry Science, 2018, 97 (8):2675-2683.
[14]SAKAMOTO M I, MURAKAMI A E, SILVEIRA T G V, et al. Influence of glutamine and vitamin E on the performance and the immune responses of broiler chickens[J]. Brazilan journal of poultry science, 2006, 8 (4):243-249.
[15]賈海燕.谷氨酰胺在冷应激雏鸡肺损伤中保护作用的研究[D].哈尔滨:东北农业大学,2009.
[16]刘艳芬,马建升,黄银姬,等.谷氨酰胺对肉仔鸡免疫器官发育及免疫功能的影响[J]. 中国兽医学报, 2006, 26 (5):567-569.
[17]BARTELL S M. The effect of supplemental glutamine on growth performance, development of the gastrointestinal tract, and immune response of broiler chicks[D]. Georgia: The university of Georgia, 2003.
[18]XING S, ZHANG B, LIN M, et al. Effects of alanyl-glutamine supplementation on the small intestinal mucosa barrier in weaned piglets[J]. Asian-Australasian Journal of Animal Science, 2017, 30(2):236-245.
[19]王中华,黄修奇,杨艳玲. 谷氨酰胺对肉仔鸡生长、屠宰性能和免疫器官指数的影响[J]. 中国家禽, 2011, 33 (18):69-70.
[20]LIVAK K, SCHMITTGEN T. Analysis of relative gene expression data using real-time quantitative PCR and the 2-△△Ct method[J]. Methods, 2000, 25 (4):402-408.
[21]TOGHYANI M, RODGERS N, BAREKATAIN M R, et. al. Apparent metabolizable energy value of expeller-extracted canola meal subjected to different processing conditions for growing broiler chickens[J]. Poultry Science, 2014, 93(9):2227-2236.
[22]ULLAH Z, REHMAN Z U, YIN Y, et. al. Comparative ileal digestibility of amino acids in 00-rapeseed meal and rapeseed meal fed to growing male broilers[J]. Poultry Science, 2017, 96(8): 2736-2742.
[23]SINA P, PARVIZ F, NEGIN D. Growth performance, organ weights and, blood parameters of broilers fed diets containing graded levels of dietary canola meal and supplemental copper [J]. Journal of Poultry Science, 2013, 50:354-363.
[24]DAI S F, WANG L K, WEN A Y, et. al. Dietary glutamine supplementation improves growth performance, meat quality and colour stability of broilers under heat stress[J]. British Poultry Science, 2009, 50 (3):333-340.
[25]BARTELL S M, BATAL A B. The effect of supplemental glutamine on growth performance, development of the gastrointestinal tract, and humoral immune response of broilers[J]. Poultry Science, 2007, 86 (9):1940-1947.
[26]胡永娜. 微生物发酵菜籽粕营养价值的评定及其对肉仔鸡生长发育的影响[D].雅安: 四川农业大学, 2012.
[27]戴四发,王立克,金光明,等. 外源谷氨酰胺对AA肉鸡肠道早期生长发育的影响 [J]. 中国饲料, 2002(16):12-13.
[28]黄晓亮,刘艳芬,廖建财,等. 谷氨酰胺对肉鸡肠道发育及小肠消化酶活性的影响[J]. 中国饲料, 2009(14):38-41.
[29]XUE G, BAREKATAIN R, WU S, et al. Dietary L-glutamine supplementation improves growth performance, gut morphology, and serum biochemical indices of broiler chickens during necrotic enteritis challenge[J]. Poultry Science, 2018, 97 (4):1334-1341.
[30]胡永娜,王之盛,李愛科. 固态发酵菜籽粕对肉仔鸡生长性能、免疫功能及消化酶活性的影响[J]. 动物营养学报, 2012, 24(7):1293-1301.
[31]周联高,章世元,刘艳芬,等. 谷氨酰胺对肉仔鸡生产性能及免疫机能的影响[J]. 动物营养学报, 2008,20(3):305-310.
[32]李虎,李海英,李晓斌,等. 谷氨酰胺替代饲用抗生素对黄羽肉鸡免疫器官指数及小肠黏膜免疫的影响[J]. 中国畜牧兽医, 2012, 39 (12):82-88.
[33]吴正可. 多菌种固态发酵菜籽粕的工艺优化及其肉鸡的饲用价值评定[D].北京: 中国农业科学院, 2018.
[34]程强. 日粮中添加包被肉桂油对肉鸡免疫功能和肠黏膜屏障基因表达的影响[D].武汉:武汉轻工大学, 2018.
[35]张敏,邹晓庭,孙亚丽,等. 谷氨酰胺对1~3周龄肉仔鸡免疫功能的影响[J]. 畜牧兽医学报, 2009, 40 (10):1494-1498.
[36]李升和,王珏,范光丽,等. 谷氨酰胺对肉鸡免疫器官胚后发育的影响[J]. 中国兽医学报, 2006, 26(1):74-78
[37]WANG B, WU G, ZHOU Z, et al. Glutamine and intestinal barrier function[J]. Amino Acids, 2015, 47 (10):2143-2154.
[38]邓留坤. 胚胎注射谷氨酰胺对肉仔鸡早期生长发育的影响[D].杨凌:西北农林科技大学, 2010.
[39]邹晓庭. 谷氨酰胺对断奶仔猪生长、免疫的影响及其机理研究[D].杭州:浙江大学, 2007.
[40]王丽. 谷氨酰胺对断奶仔猪免疫应激调节作用及其分子机制的研究[D].沈阳:沈阳农业大学, 2017.
[41]BARTELL S M, BATAL A B. The effect of supplemental glutamine on growth performance, development of the gastrointestinal tract, and humoral immune response of broilers[J]. Poultry Science, 2007, 86 (9):1940-1947.
[42]YEH S L, YEH C L, LIN M T, et. al. Effects of glutamine-supplemented total parenteral nutrition on cytokine production and T cell population in septic rats[J]. Journal of Parenteral & Enteral Nutrition, 2001, 25 (5):269-274.
[43]MATHERS A R, CUFF C F. Role of Interleukin-4 (IL-4) and IL-10 in serum immunoglobulin G antibody responses following mucosal or systemic reovirus infection[J]. Journal of Virology, 2004, 78 (7):3352-3360.
[44]李欣,岳冬辉,毕岩. sIgA在黏膜免疫中的作用[J]. 河南中医, 2015, 35 (12):3212-3214.
[45]李成,尹莉莉,朱电锋,等. 党参多糖对仔猪小肠黏膜免疫功能的影响[J].江苏农业学报,2018,34(2):347-355.
[46]杨海峰,陈晓兰,邱树磊,等. 不同中药提取物的免疫调节作用比较[J]. 江苏农业科学,2018,46(23):158-162.
[47]梅林. 黏膜s-IgA免疫及其神经调节[J]. 国外医学(生理、病理科学与临床分册), 2002, 22(2):180-182.
[48]MANTIS N J, ROL N, CORTHSY B. Secretory IgAs complex roles in immunity and mucosal homeostasis in the gut[J]. Mucosal Immunology, 2011, 4 (6):603-611.
[49]刘涛. 谷氨酰胺对早期断奶仔猪肠道营养与免疫功能影响机理的研究[D].武汉:华中农业大学, 2002.
[50]康磊,李文立,姜建阳,等. 谷氨酰胺对热应激肉鸡s-IgA、血液内毒素和细胞因子的影响[J].中国兽医学报, 2012, 32(4): 609-614.
[51]冯奇. 日粮NDF水平对断奶獭兔肠MUC1、MUC2与FASN表达的影响[D].杨凌:西北农林科技大学, 2013.
[52]余晶仪,郝小燕,龙敏,等. MUC2基因表达对益生菌调节肠屏障作用的影响[J]. 南方医科大学学报, 2013, 33(2):197-201.
[53]陈国旺,黄大鹏. 谷氨酰胺对畜禽免疫及小肠黏膜基因的研究进展[J]. 饲料研究, 2015(20):5-8.
[54]WANG X, PIERRE J F, HENEGHAN A F, et al. Glutamine improves innate immunity and prevents bacterial enteroinvasion during parenteral nutrition[J]. Jpen Journal of Parenteral & Enteral Nutrition, 2014, 39 (6):688-697.
[55]高玉琪,任戰军,胡志刚,等. 日粮添加不同水平谷氨酰胺对幼龄獭兔免疫性能及回肠黏蛋白基因表达的影响[J]. 中国兽医学报, 2016, 36 (4):110-115.
[56]邢深. 日粮添加丙氨酰谷氨酰胺对仔猪小肠黏膜屏障功能的影响[D].南京:南京农业大学, 2016.
(责任编辑:张震林)

