超声波和TGase对重组草鱼肉形成过程中理化性质的影响
孟 粉,秦求思,董 烨,毛海萍,戴志远,2,3,*
(1.浙江工商大学海洋食品研究院,浙江杭州 310012;2.浙江省水产品加工技术研究联合重点实验室,浙江杭州 310012;3.海洋食品精深加工关键技术省部共建协同创新中心,大连工业大学,辽宁大连 116034)
超声波技术作为一种高效节能的加工技术,在食品加工中被广泛应用。与传统加工方式相比,超声波加工具有能耗低、可控制性强、营养成分损失小等特点[1]。近年来超声波技术在食品加工中主要用于改善或评估食品品质、超声提取、超声清洁等方面[2]。周建伟等[3]从感官品质、蛋白质性质、营养与安全性三个角度,研究发现超声波技术与其他加工技术结合可用于改善牛肉及其制品的色泽、风味、营养、安全性。Wang等[4]研究发现超声波处理可以调节蛋白酶活度和蛋白质降解来改善牛肉的嫩度。Yeung等[5]研究发现超声波可以通过降低肌肉纤维的剪切力来提高牛肉的嫩度。Annamaria等[6]研究发现超声波可以增强鱼糜制品的凝胶强度。李长乐[7]研究发现在一定的超声时间范围内,超声波处理会提高鲣鱼肌原纤维蛋白的溶解度与乳化性。
谷氨酰胺转氨酶(transglutaminase,TGase,EC.2.3.2.13)是一种生物类催化剂,被广泛运用于食品加工中,没有副产物生成,且不会使营养成分损失[8-9]。TGase可以催化蛋白质上的ε-氨基与谷氨酸的γ-羟酰胺形成蛋白质分子内或分子间交联,以增强蛋白质三维网络结构的形成[10]。娄忠纬[11]通过研究酶促交联技术在重组鱼肉开发中的应用,发现蛋白质分子在TGase作用下,高级结构首先会被打开,子链之间发生相互交联,从而提高重组鱼肉的凝胶强度;陈海华等[12]通过研究TGase对竹荚鱼鱼糜蛋白凝胶特性的影响,发现TGase能够促进鱼糜凝胶形成更加致密、均匀的凝胶网络结构;孙京新等[13]通过研究TGase对带鱼鱼糜制品质构特性的影响,发现可以通过适量添加TGase而达到要求的凝胶强度,且可有效改善低值鱼鱼糜制品特性;陈秋妹等[14]通过研究新型重组鱼排及其低温凝胶化作用,发现TGase可催化蛋白质交联,生成超大蛋白分子,从而改善重组鱼肉的凝胶强度。
目前国内外学者对超声波技术在鱼糜制品中的研究较多,且TGase在鱼糜加工中应用研究更为成熟,但两者在草鱼重组过程中的共同作用少见报道。本研究通过测定不同处理方式下重组鱼肉分子间作用力、巯基含量、浊度、溶解率等,分析重组过程中超声波和TGase对重组草鱼肉理化性质的影响,以了解超声波和TGase在重组草鱼肉过程中的作用机制,以期为草鱼肉产业生产提供一定的参考价值。
1 材料与方法
1.1 材料与仪器
新鲜草鱼(每条约2000 g,500 mm×100 mm) 购于杭州教工路物美超市;氯化钠 食品级,购于杭州教工路物美超市;谷氨酰胺转氨酶(TGase-B型) 食品级,江苏一鸣生物有限公司;考马斯亮蓝R250 电泳级,上海如吉生物科技有限公司;考马斯亮蓝G250 分析纯,碧云天生物科技有限公司;2-硝基苯甲酸、溴酚蓝 分析纯,国药集团化学试剂有限公司。
BSA124S-CW电子天平 赛多利斯科学仪器(北京)有限公司;恒温水浴锅(JOANLAB) 宁波市群安实验仪器有限公司;美的多功能电磁炉 美的集团有限公司;紫外可见分光光度计 赛默飞世尔科技(中国)有限公司;BIO-RAD垂直电泳仪 伯乐生命医学产品(上海)有限公司;FJ200-S均质机 上海力辰科技有限公司;SPECTRA MAX190酶标仪 美国Molecular Devices美国分子仪器有限公司。
1.2 实验方法
1.2.1 样品制备
1.2.1.1 鱼肉前处理 鲜鱼宰杀,去头、去皮、去尾、去内脏然后进行人工采肉。4 ℃冰水进行漂洗三次,再用0.15%盐水漂洗1次,以促进鱼肉脱水。吸干水分放入聚乙烯包装袋中存于-18 ℃冰箱,一周内使用。
1.2.1.2 制备重组鱼肉 对照组:向100 g草鱼碎肉中加入2 g NaCl(少量蒸馏水溶解);搅拌机混匀5 min,入模(4 cm×4 cm×2 cm),40 ℃下分别加热0、30、60、90、120、150、180 min,下同。NaCl+TGase组:向100 g草鱼碎肉中加入2 g NaCl和0.4 g TGase酶,混匀,入模,加热;NaCl+超声组:向100 g草鱼碎肉中加入2 g NaCl,混匀,300 W下冰水超声15 min,入模,加热;NaCl+TGase+超声组:向100 g草鱼碎肉中加入2 g NaCl和0.4 g TGase,混匀,300 W下冰水超声15 min,入模,加热。
1.2.2 分子间作用力测定 参照Tan、张洪超等[15-16]方法,稍作修改,步骤一:取重组鱼肉1 g加入20 mL的0.6 mol/L NaCl溶液,4 ℃静置1 h,8000 r/min离心10 min,分离出上清液;步骤二:向步骤一沉淀中加入20 mL的0.6 mol/L NaCl(含1.5 mol·L-1尿素)溶液,同样的方法静置、离心、取上清液;步骤三:向步骤二沉淀中加入20 mL的0.6 mol/L NaCl(含8 mol/L尿素)溶液,同样的方法静置、离心、取上清液;步骤四:向步骤三沉淀中加入20 mL的0.6 mol/L NaCl(含8 mol/L尿素和0.5 mol/Lβ-巯基乙醇)溶液,同样的方法静置、离心、取上清液;步骤五:向步骤四沉淀中加入20 mL的0.5 mol/L NaOH溶液溶解;最后用考马斯亮蓝法测定所有上清液蛋白质浓度,依次代表离子键、氢键、疏水相互作用、二硫键、非二硫键。每个样品平行三次。
1.2.3 肌原纤维蛋白提取 参照周逸等[17]方法,稍作修改,称取2 g重组鱼肉,加入20 mL蒸馏水(4 ℃)均质2 min并离心(8000 r/min、5 min),取沉淀加入20 mL 50 mmol/L KCl均质1 min并离心(8000 r/min、5 min),取沉淀加入20 mL 0.6 mol/L KCl-20 mmol/L Tris-马来酸(pH7.0),匀浆后于4 ℃静置1 h,离心(8000 r/min、10 min)取上清液。每个样品平行三次。
1.2.4 巯基和活性巯基测定 参照曹淑敏、仪淑敏等[18-19]方法,稍作修改,提取出的肌原纤维蛋白溶液用0.6 mol/L KCl-20 mmol/L Tris-马来酸(pH7.0)稀释至5 mg/mL。总巯基的测定:取此溶液1 mL,加入9 mL 0.2 mol/L的尿素缓冲溶液(pH6.8),混匀后加入0.1 mL 0.1%的2-硝基苯甲酸溶液,在40 ℃反应30 min后用紫外-可见分光光度计于412 nm波长处测定吸光度,用0.6 mol/L KCl溶液做空白。活性巯基的测定在不添加尿素的情况下进行。总巯基含量和活性巯基以蛋白质计,单位mol/g,其中分子消光系数取13600 L/mol·cm。计算公式如下,每个样品平行三次。
式中:A为412 nm处的吸光值;c为吸光系数,其值为13600 L/mol·cm;11为稀释倍数;M为肌原纤维蛋白含量,mg/mL。
1.2.5 表面疏水性测定 参照张洪超[20]、Chelh[21]等方法,稍作修改,表面疏水性可用溴酚蓝含量来表示。向1 mL肌原纤维蛋白液中加入200 μL 0.1%的溴酚蓝,对照组用1 mL磷酸盐缓冲液代替进行测定。25 ℃下反应10 min,然后4 ℃ 8000 r/min离心15 min。取500 μL上清液,用0.6 mol/L KCl-20 mmol/L Tris-马来酸(pH7.0)稀释10倍后,595 nm波长处测定吸光值。溴酚蓝在蛋白质中的含量(μg)按以下公式计算,每个样品平行三次。

1.2.6 浊度的测定 参照杨青[22]方法,用0.6 mol/L KCl-20 mmol/L Tris-马来酸(pH7.0)缓冲液将肌原纤维蛋白浓度调成2 mg/mL,然后在350 nm下测定吸光值,即为肌原纤维蛋白溶液的浊度,每个样品平行三次。
1.2.7 蛋白质溶解性测定 参照Benjakul等[23]的方法,取20 mL的 20 mmol/L的Tris-HCl缓冲液(含8 mol/L尿素、1%(W/V)SDS以及2%(V/V)β-巯基乙醇,pH8.0)加入1.2.1.2的样品1 g,8000 r/min均质2 min,均质后的样品沸水浴2 min,待冷却至室温后搅拌4 h,离心8000 r/min离心20 min。加入50%(W/V)的三氯乙酸(TCA)至10 mL上清液中,直至混合溶液浓度达到10%,4 ℃静置18 h后8000 r/min离心20 min,用10% TCA(W/V)溶液多次冲洗沉淀物,待沉淀风干后,用30 mL 0.5 mol/L的NaOH溶液溶解沉淀,然后用考马斯亮蓝法测定蛋白质含量。总蛋白含量是重组鱼肉直接溶于30 mL 0.5 mol/L NaOH溶液中的蛋白质含量,溶解度为溶解于混合溶剂中的蛋白占总蛋白的百分含量。每个样品平行三次。
1.2.8 SDS-PAGE电泳 参照Lin[24]方法进行蛋白质电泳,称取3 g左右的重组鱼肉样品及消化后样品,加入27 mL 5%(W/V)SDS和27 μL的β-巯基还原剂,均质2 min,在80 ℃水浴条件下作用1.5 h,8000 r/min离心20 min取上清液,进行SDS-PAGE电泳。选用10%分离胶和4%浓缩胶,上样量为10 μL,前30 min电压为70 V,之后调为110 V至电泳结束,用考马斯亮蓝R250染色30 min,回收染色液,加入适量脱色液,脱色40 min后,更换脱色液,继续脱色过夜。
1.3 数据分析
作图采用Oringin 8.0软件,平均值、标准差和显著性水平均采用SPSS 21.0和Excel 2013软件计算,显著性分析的置信区间为95%。
2 结果与讨论
2.1 重组草鱼肉形成过程中分子间作用力的变化
离子键是由两个相反电荷的氨基酸残基之间的静电力,在蛋白质聚集过程中通常表现为相互的排斥力[25]。由图1可知,四组实验离子键均随着加热时间的延续逐渐减小,这说明离子键不是重组鱼肉形成过程的主要作用力,这与刘海梅等[26]研究结果一致;加入TGase样品溶解蛋白质值均小于不添加样品组,这可能是因为TGase与蛋白质残基之间相互作用所引起的;经过超声后样品溶解蛋白质值小于不经过超声的样品,可能是因为超声波的空化作用和机械效应使蛋白质分子内或分子间相互连接更紧密,与此同时超声波也能加快TGase的扩散,促进蛋白质残基与TGase的交联[27]。可见超声波和TGase均可以减弱蛋白质之间的排斥力,促进蛋白质聚集,有利于重组草鱼肉的形成,且两者共同作用时效果更优。
图1 重组草鱼肉形成过程中离子键的变化
氢键是蛋白质分子内或分子间的相互作用力,也是维护蛋白质二级结构的作用力。由图2可知,在四种不同方式处理过程中溶解蛋白质含量均呈现先增加后减少的趋势,这说明在热诱导后期氢键开始发生断裂,同样氢键也不是重组草鱼肉形成的主要作用力,这与杨青[22]研究结果一致。
图2 重组草鱼肉形成过程中氢键的变化
疏水相互作用是指蛋白质在水溶液中由水诱导的非极性基团之间的相互作用。目前普遍认为疏水作用力是蛋白凝胶形成过程中最主要的作用力之一[28]。由图3可知,随着加热时间的延长,蛋白质的疏水相互作用力逐渐增强,这可能因为热诱导使包埋在蛋白质里面的多肽链暴露在表面,从而促进蛋白质的交联作用,这与Takeda等[29]研究结果一致。加入TGase会影响蛋白质分子内和分子间的交联或脱酰胺作用,从而导致其分子结构的变化,改变蛋白质的疏水性,增强其疏水相互作用。加入TGase且超声处理的样品增加趋势最显著,可能是因为超声波振动促进蛋白质分子和TGase的交联作用[26],因此超声波和TGase均能增强疏水作用,即能促进重组草鱼肉的形成,且两者共同作用时效果更优。
图3 重组草鱼肉形成过程中疏水相互作用的变化
二硫键主要由巯基基团氧化形成,是蛋白质经过热诱导形成凝胶的最主要的共价键[30]。由图4可知,随着加热时间的延长二硫键逐渐增多,可能是因为加热使蛋白分子逐渐展开,内部巯基逐渐暴露出来,并促进蛋白分子内部的巯基形成二硫键[31]。且经过超声和加入TGase的样品溶解蛋白质含量更高,二硫键含量更高,这说明超声波和TGase可以促进分子间或分子内交联,故在重组草鱼肉形成过程中均可起到积极作用。
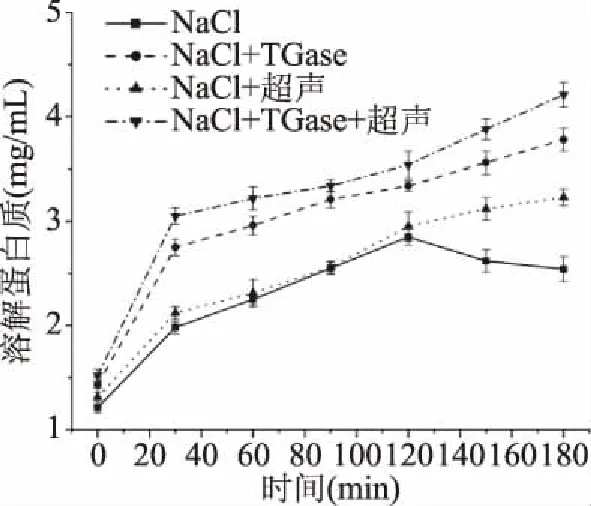
图4 重组草鱼肉形成过程中二硫键的变化
非二硫键主要是由TGase与赖氨酸残基形成ε-(γ-Glu)-Lys共价键[32]。由图5可知,随着加热时间的延长,非二硫键逐渐增强,加入TGase且经超声处理后的样品中溶解蛋白质的含量比其它样品高,这可能是因为超声波促进蛋白质分子展开,原来包埋在内部的疏水性氨基酸残基暴露在分子表面[25],从而促进TGase和赖氨酸残基发生分子内或分子间的交联[33]。故超声波和TGase两者均可促进重组鱼肉的形成,且两者同时存在时效果最佳。
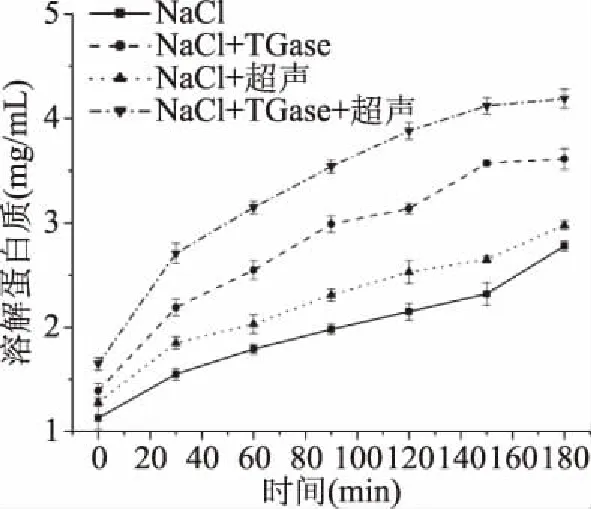
图5 重组草鱼肉形成过程中非二硫键的变化
综上所述,超声波和TGase均会对重组草鱼肉分子间作用力产生影响,且这两者都能促进重组草鱼肉蛋白质三维网络结构的形成,从而促进草鱼肉的重组,当两者同时存在时,促进效果更明显。
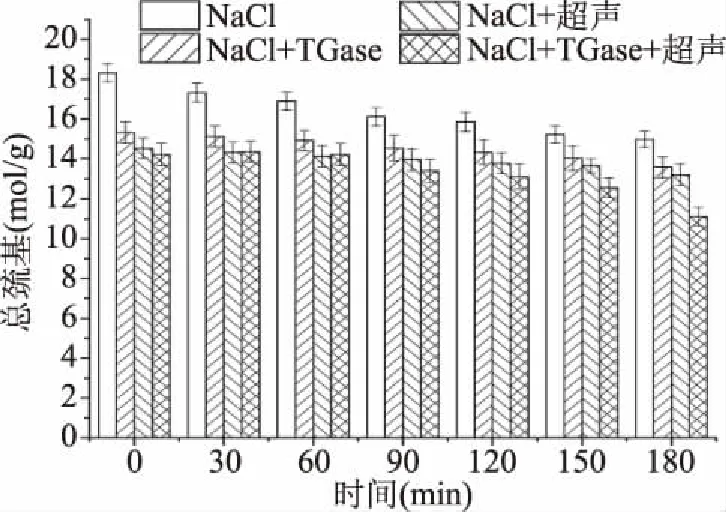
图6 重组鱼肉形成过程中肌原纤维蛋白总巯基的变化
2.2 重组草鱼肉形成过程中巯基的变化
由图6、图7可知,随着热诱导时间的延续,四种不同的处理方式样品的总巯基和活性巯基均呈现下降趋势,这可能是因为热诱导促进更多巯基的暴露,且能使分子表面的巯基氧化形成二硫键[34]。经过超声后的样品总巯基和活性巯基降低,可能是因为超声波可以促进蛋白质分子展开,巯基暴露,且超声波产生的空化效应使水分解为高活性的羟自由基和氢原子,其中羟自由基会使蛋白质的巯基减少[35],这与冷利萍[36]研究结果一致。巯基氧化形成的二硫键可以促进蛋白质三维网络结构的形成,进而促进草鱼肉重组的形成。
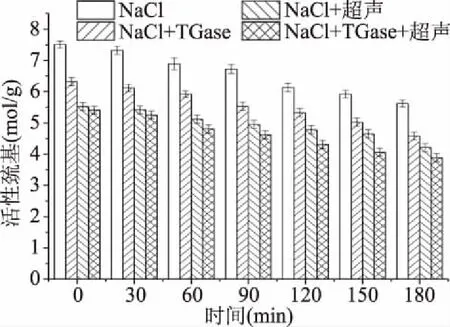
图7 重组鱼肉形成过程中肌原纤维蛋白活性巯基的变化
2.3 重组草鱼肉形成过程中表面疏水性的变化
表面疏水性可以反映疏水基团和极性环境的结合情况,即可以通过表面疏水性的变化来了解蛋白质与其他分子间的相互作用情况及蛋白质分子自身构象的变化[37]。由图8可知,随着热诱导时间的延续,被结合的溴酚蓝(BPB)的量略微增加,但整体变化不大,可能是因为加热使部分肌原纤维蛋白结构和构象发生改变,从而使疏水性基团暴露,进而促进肌原纤维蛋白与BPB的结合[38]。NaCl+TGase+超声的样品结合BPB的能力更强,这可能是因为超声波产生的空穴作用和机械作用可以促进蛋白质分子展开及TGase分子的运动,使分子内部更多的疏水性氨基酸残基暴露出来,促进与BPB的结合[39]。故超声波和TGase结合可以增加重组鱼肉形成过程中肌原纤维蛋白表面疏水性,以促进重组草鱼肉的形成。
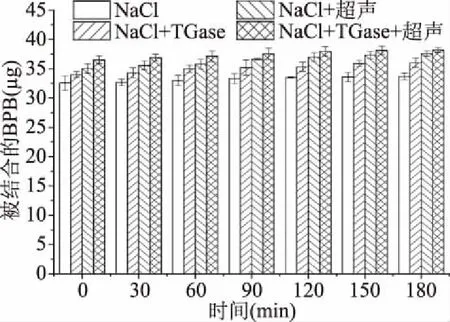
图8 重组鱼肉形成过程中肌原纤维蛋白表面疏水性的变化
2.4 重组草鱼肉形成过程中浊度的变化
在加热过程中由于肌原纤维蛋白发生聚合,当生成足够大的聚合物时引起光散射,从而使吸光值增加[40]。由图9可知,随着热诱导时间的延续,浊度呈现上升的趋势,这可能是因为肌原纤维蛋白发生聚集,粒径逐渐增加,从而导致光散射的增强,吸光值增加,这与陈雪珂[41]研究结果一致。由图还可知,经过超声处理后的样品浊度均高于对照组,这可能因为超声波促进了蛋白质分子间的相互交联,同时TGase在超声波的作用下更能催化蛋白质残基间的结合[42]。故超声波和TGase可以促进蛋白质分子间或分子内的聚集,从而促进重组鱼肉的形成。
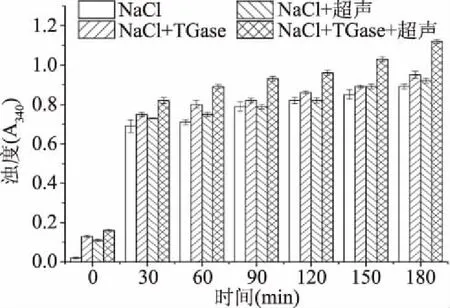
图9 重组鱼肉形成过程中肌原纤维蛋白浊度的变化
2.5 重组草鱼肉形成过程中蛋白质溶解率的变化
β-巯基乙醇、SDS和尿素的混合溶液可以使重组鱼肉中除非二硫共价键(尤其是ε-(γ-Glu)-Lys共价键)外的所有化学键断裂[43]。因此,该混合试剂测得的溶解率可以反映ε-(γ-Glu)-Lys共价键的多少。由图10可知,随着热诱导的延续,蛋白质溶解率均呈现下降趋势,这说明重组鱼肉在热诱导过程中形成了非二硫共价键[30],这与前面测得非二硫共价键增加的结果一致,这些共价键可以产生高分子量聚合物,改变蛋白质表面疏水性,从而影响其溶解率。NaCl+TGase+超声样品的溶解率明显比另两组样品低,这可能是因为超声波处理和TGase加入促进蛋白质分子间和分子内的交联,从而呈现出高的浊度和低的溶解率[44]。
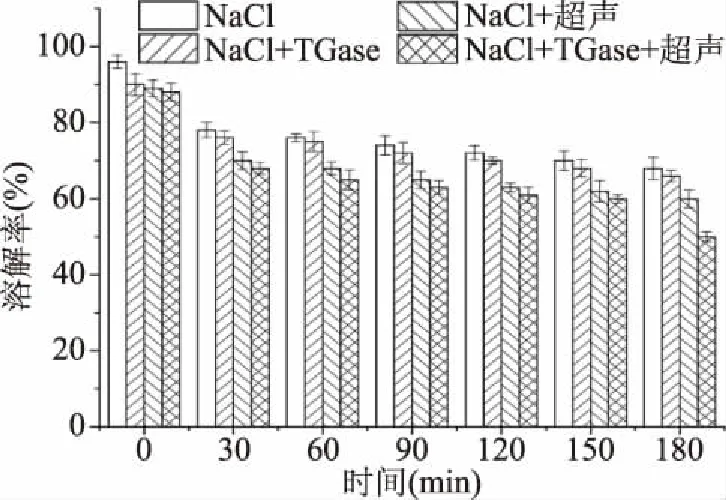
图10 重组鱼肉形成过程中溶解率的变化
2.6 SDS-PAGE电泳
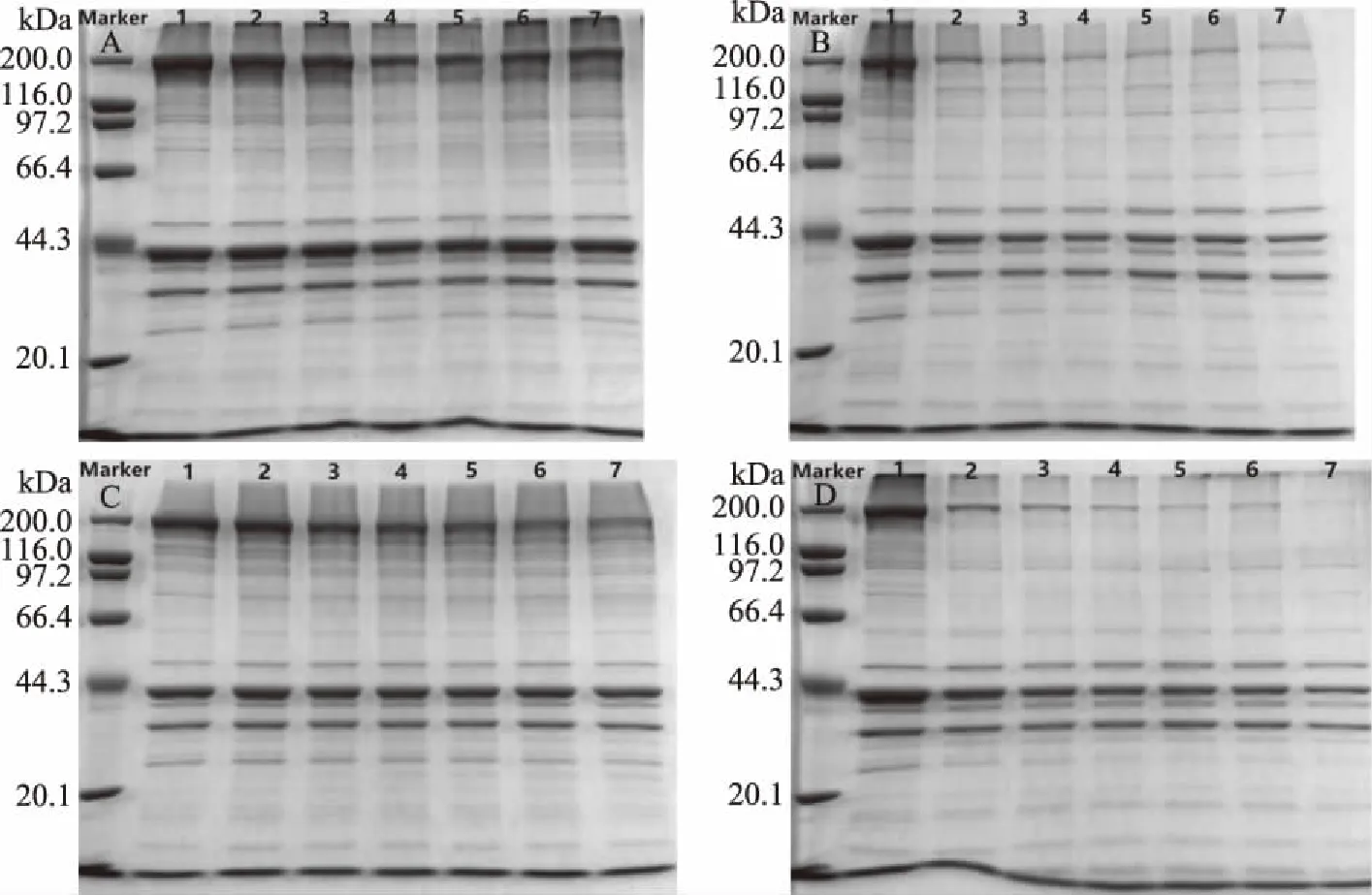
图11 重组鱼肉形成过程中SDS-PAGE电泳图谱的变化
由图11可知,只加入NaCl的样品(A)随着热诱导的延续在200 kDa的肌原纤维蛋白重链(MHC)上的条带有所变淡,经超声波处理后的样品(B)变化更为明显;这说明重组鱼肉中蛋白质的聚集反应主要发生在200 kDa的肌原纤维蛋白重链上,且超声波在重组鱼肉形成过程中起着积极的作用。比较A/C和B/D可知加入TGase的样品随着热诱导的延续在MHC条带显著变淡,甚至消失,且经超声波处理后的样品变化更为显著;这说明大部分的TGase反应发生在肌球蛋白重链上即分子量为200 kDa,少量反应发生在副肌球蛋白链(PM)上即分子量为116.6 kDa,这与马静蓉等[45]研究结果一致;TGase催化肌球蛋白重链上谷氨酸的γ-羟酰胺基和赖氨酸的氨基形成共价键,在分子内和分子间产生大量的共价交联[46],形成大量的聚合物,不能轻易透过SDS-PAGE电泳凝胶,因此会导致MHC带的降低甚至消失,这与Nakahara等[47]研究结果一致。故从电泳图谱可看出超声波和TGase均能促进蛋白质分子的交联,且两者同时存在时交联效果更明显,这也验证了前面的实验结果。
3 结论
四种处理方式均会对草鱼肉重组过程中理化性质产生影响,其中加入TGase并且超声的样品在形成过程中分子间作用力和表面疏水性最强、巯基含量最低、浊度最高、蛋白质溶解率最低、SDS-PAGE电泳图谱中肌原纤维蛋白重链上的条带变化最明显,这些指标的变化都表明该组样品在重组过程中由于超声作用和TGase的存在蛋白质分子内或分子间发生了更多的交联,使其具有相对更优的理化性质,因此重组草鱼肉可以形成更稳定的三维网络结构。由此可知超声波和TGase均能在重组草鱼肉形成过程中起到积极的作用,且两者共同作用时效果更优,对指导重组草鱼肉产业生产具有一定的参考价值。

