不同神经肽S侧脑室注射剂量对瑞芬太尼痛觉敏感小鼠的镇痛效果观察
丁晨 陶红蕾 傅之梅 章杭 马婷婷
[摘要] 目的 探討不同神经肽S侧脑室注射剂量对瑞芬太尼痛觉敏感小鼠的镇痛效果。 方法 42只小鼠分为A组(对照组)、B组(切口痛)、C组(瑞芬太尼)、D组(切口痛-瑞芬太尼),利用切口痛-瑞芬太尼模型成功小鼠进行实验,随机分为Saline组,0.1 nmol/L NPS侧脑室注射组、1 nmol/L NPS侧脑室注射组、10 nmol/L NPS侧脑室注射组,每组6只。采用小鼠热板实验、小鼠热甩尾实验、小鼠醋酸扭体实验检测不同剂量NPS侧脑室注射对瑞芬太尼所引起的痛觉过敏小鼠甩尾潜伏期、应答潜伏期、扭体反应次数的影响。 结果 制作切口痛-瑞芬太尼小鼠术后痛觉过敏模型,在甩尾实验、热板实验和醋酸扭体实验中,侧脑室注射NPS后,小鼠的甩尾潜伏期和热板实验潜伏应答期明显延长,小鼠醋酸扭体反应的次数减少,其作用强度与给药剂量呈一定的量效关系,10 nmol/L NPS引起的镇痛作用强于0.1 nmol/L NPS。 结论 侧脑室注射神经肽S对瑞芬太尼痛觉敏感小鼠能产生浓度依赖性的镇痛作用。
[关键词] 神经肽S;瑞芬太尼;痛觉敏感;镇痛
[中图分类号] R441.1 [文献标识码] A [文章编号] 1673-9701(2020)28-0051-04
Analgesic effect of different doses of neuropeptide S injected into the lateral ventricle on remifentanil pain-sensitive mice
DING Chen TAO Honglei FU Zhimei ZHANG Hang MA Tingting
Department of Anesthesiology, Tongde Hospital of Zhejiang Province, Hangzhou 310015, China
[Abstract] Objective To explore the analgesic effect of different doses of neuropeptide S lateral ventricular injection on remifentanil pain-sensitive mice. Methods A total of 42 mice were divided into group A(control group), group B (incision pain), group C(remifentanil), and group D(incision pain-remifentanil). The incision pain-remifentanil mice were successfully tested and divided into Saline group, 0.1 nmol/L NPS lateral ventricle injection group, 1 nmol/L NPS lateral ventricle injection group,10 nmol/L NPS lateral ventricle injection group, with 6 mice in each group. Mouse hot plate test, mouse hot tail flick test, and mouse acetic acid writhing test were used to detect the tail-flick latency, response latency, and the number of writhing reactions in the pain-sensitive mice induced by different doses of NPS injected in the lateral ventricle. Results The incision pain-remifentanil mouse postoperative hyperalgesia model was made. In the tail flick, hot plate and acetic acid writhing experiment, after the injection of NPS in the lateral ventricle, the tail flick latency and hot plate latency response period in mice was significantly prolonged, and the number of writhing reactions of acetic acid in mice was reduced. The intensity of the action was in a dose-effect relationship with the dose administered. The analgesic effect caused by 10 nmol/L NPS was stronger than that by 0.1 nmol/L NPS. Conclusion Lateral ventricle injection of neuropeptide S can produce concentration-dependent analgesia in remifentanil pain-sensitive mice.
[Key words] Neuropeptide S; Remifentanil; Hyperalgesia; Analgesia
大量使用阿片类镇痛药能够激活体内的促伤害系统,导致周围和中枢神经系统感受伤害性刺激通路敏感化,提高机体对伤害性刺激的敏感性,即痛觉超敏(Opioidinduced hyperalgesia,OIH)[1-2]。瑞芬太尼是一种新型的μ阿片受体激动剂,具有独特的药代动力学特性,起效快、作用时间短、分布容积小、连续用药无蓄积、不依赖肝肾代谢[3]。相比于其他阿片类药物,大剂量或长时间应用瑞芬太尼后发生的痛觉过敏现象更强烈、更频繁,易诱发苏醒期躁动,心律不齐,影响麻醉苏醒质量和患者生命安全[4-5]。获得满意镇痛的效果,减少术后镇痛药的用量,减少并发症发生,维持患者术后各脏器正常的生理功能,是目前镇痛工作研究的热点。神经肽S(Neuropeptide S,NPS)是一个具有20个氨基酸残基的神经短肽,通过其受体NPSR调节觉醒与睡眠、焦虑与抑郁、认知与记忆、摄食与结肠运动、促进药物成瘾、免疫和抗氧化、炎性反应等多种重要的生理病理过程[6-9]。NPS的镇痛作用主要通过多巴胺D2样受体信号传导与多巴胺能神经传递有关[10]。本实验采用不同剂量NPS侧脑室注射,探讨其对瑞芬太尼痛觉敏感小鼠的镇痛效果,现报道如下。
1 材料与方法
1.1 实验动物
本次研究所采用的实验动物为昆明系小鼠,体质量(20±2)g,动物由浙江维通利华实验动物技术有限公司提供,动物许可证号SYXK(浙)2019-0003,动物实验经浙江省立同德医院医学伦理委员会批准。小鼠饲养在实验动物中心的SPF级动物房内,室温22~24℃,室内相对湿度40%~70%,保持室内12 h进行灯的明暗自动切换,小鼠可以自由进行水和食物的摄取。
1.2 药物与试剂
盐酸瑞芬太尼粉剂(江苏恩华药业股份有限公司,国药准字:H20143315)。NPS:上海钦诚生物科技有限公司。冰醋酸:沈阳伊威隆化工原料有限公司。Von Frey测痛仪:上海玉研科学仪器有限公司。KW-RB智能热板仪:南京卡尔文生物科技有限公司。HH-ZKS8恒温水浴锅:上海科升仪器有限公司。
1.3 動物模型的建立
参照Brennan等[11]的方法制备切口痛模型:七氟酸吸入麻醉后,将小鼠仰卧固定于操作台。右后爪消毒后,从足跟近端0.5 cm处纵行切开小鼠足底皮肤,长约1 cm,眼科镊挑起皮肤和筋膜并纵向切割足底部肌肉,保持肌肉的起止和附着完整,按压止血后缝合皮肤,碘伏消毒伤口预防感染。
1.4 动物分组
采用随机数字表法将42只小鼠分为4组,A组、B组、C组,每组6只,D组24只。A组:不行切口操作,静脉输注生理盐水0.1 mL/(kg·min),60 min;B组(切口痛):制作大鼠切口痛模型同时静脉输注生理盐水0.1 mL/(kg·min),60 min;C组(瑞芬太尼):不行切口操作;静脉输注瑞芬太尼1.0 μg/(kg·min),60 min;D组(切口痛-瑞芬太尼):切皮同时,静脉输注瑞芬太尼1.0 μg/(kg·min),60 min。根据文献报道,经尾静脉以1.0 μg/(kg·min)速率输注瑞芬太尼60 min可诱发切口痛小鼠OHI[12-13]。
1.5 实验分组
观察NPS的镇痛作用时,将切口痛-瑞芬太尼组造模成功的24只小鼠分别分为Saline组、0.1 nmol/L NPS注射组、NPS 1 nmol/L NPS注射组和 NPS 10 nmol/L NPS注射组,每组6只。
1.6 侧脑室注射
注射部位位于正中线与两耳连线的交点偏左或右1.5 mm,采用10 μL的微量注射器进行侧脑室注射,垂直颅骨进针2.5 mm,避免进针过深而破坏脑组织。侧脑室注射 NPS(0.1、1.0、10 nmol/L)和Saline,5 min后开始进行小鼠甩尾实验、小鼠热板实验、醋酸扭体实验。
1.7 小鼠甩尾实验
环境温度为(20±1)℃,选择正常痛阈值在(3~6 s)内的合格小鼠。侧脑室注射药物后,将小鼠尾部放置在(48.0±0.5)℃水浴锅内,从小鼠尾巴进入热水中到尾部甩离水面的时间计为小鼠的热甩尾潜伏期(TWL),测定给药后5、10、30、60 min时的TWL。为防止烫伤,浸入时间不超过15 s(这个时间是造模成功后的小鼠做实验的时间)。
1.7 小鼠热板实验药物
注射前,设定热板温度为(55±0.5)℃,选择正常痛阈值在5~30 s内的合格小鼠。将小鼠置于热板上,以其足部接触热板到出现明显缩足、舔足、抬足行为的时间为应答潜伏期(HPPT)。侧脑室注射药物后,测定给药后5、10、30、60 min时的HPPT。为防止烫伤,30 s为上限。
1.8 小鼠醋酸扭体实验
环境温度为(20±1)℃。小鼠腹腔内注射0.60%醋酸0.1 mL/10 g,观察15 min内各组大鼠出现腹部内凹、后肢伸张、臀部高起等扭体反应出现次数,计算药物对扭体反应的抑制率。
1.9 统计学方法
数据应用SPSS20.0统计学软件分析。计量资料以(x±s)表示,组间比较应用单因素方差分析和重复测量方差分析,并进行组间Dunnet t检验。P<0.05为差异有统计学意义。
2 结果
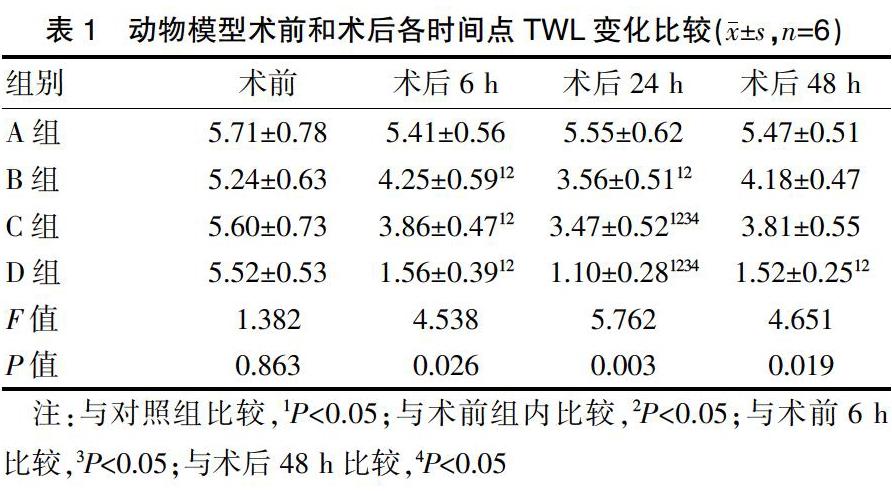
2.1 构建动物模型
B组、C组、D组术后各时间点TWL短于少于术前,提示各组小鼠痛觉敏感性较术前明显增强。B组、C组、D组术后各时间点TWL短于对照组,提示B组、C组、D组敏感性强于A组。C组和D组术后24 h TWL较术后6 h、术后48 h缩短,提示模型最佳实验时间为术后24 h。见表1。
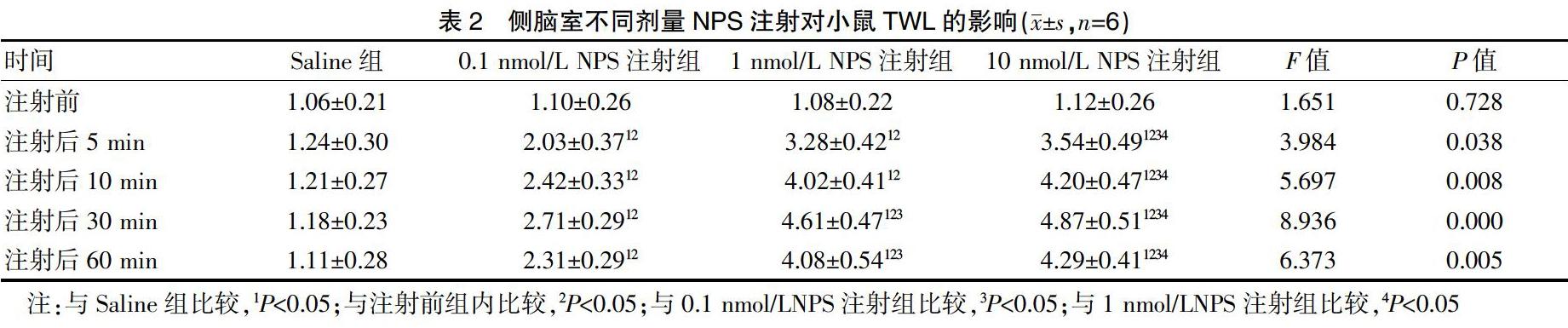
2.2 侧脑室不同剂量NPS注射对小鼠TWL的影响
注射NPS 5、10、30、60 min后各时间点小鼠TWL长于注射前,差异有统计学意义(P<0.05),随着时间的延长,小鼠TWL也逐渐延长,并在注射后30 min达到最高点,之后逐渐降低;注射NPS5、10、30、60 min后各时间点,侧脑室0.1 nmol/L NPS注射组、侧脑室1 nmol/L NPS注射组、侧脑室10 nmol/L NPS注射组小鼠TWL均高于同时间点的Saline组,侧脑室1 nmol/L NPS注射组小鼠TWL、侧脑室10 nmol/L NPS注射组小鼠TWL高于同时间点的侧脑室0.1 nmol/L NPS注射组,10 nmol/L注射组小鼠TWL高于同时间点的侧脑室1 nmol/L NPS注射组,差异有统计学意义(P<0.05)。见表2。
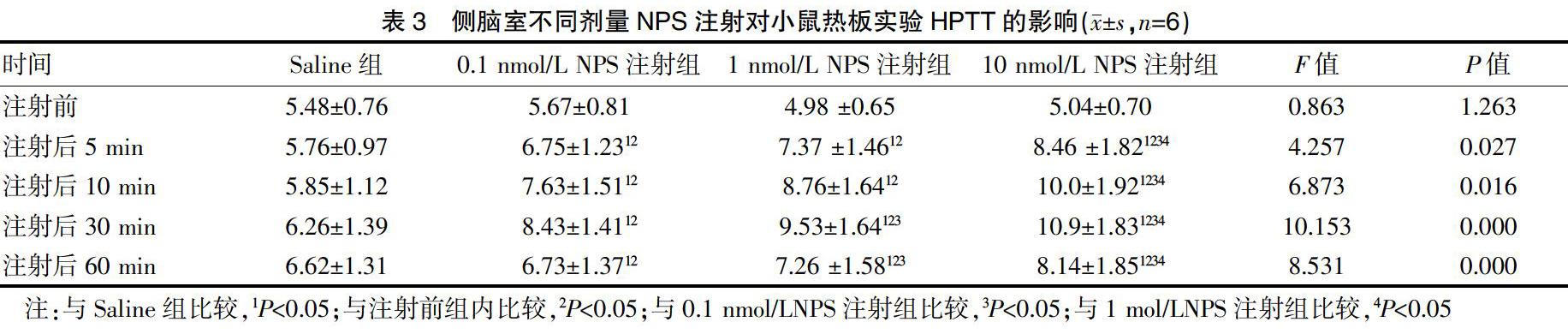
2.3 侧脑室不同剂量NPS注射对小鼠热板实验HPTT的影响
注射NPS 5、10、30、60 min后各时间点小鼠HPTT长于注射前,差异有统计学意义(P<0.05),随着时间的延长,小鼠HPTT也逐渐延长,并在注射后30 min达到最高点,之后逐渐降低;注射NPS 5、10、30、60 min后各时间点,侧脑室0.1 nmol/L NPS注射组、侧脑室1 nmol/L NPS注射组、侧脑室10 nmol/L NPS注射组小鼠HPTT均高于同时间点的Saline组,侧脑室1 nmol/L NPS注射组小鼠、侧脑室10 nmol/L NPS注射组小鼠HPTT高于同时间点的侧脑室0.1 nmol/L NPS注射组,10 nmol/L注射组小鼠HPTT高于同时间点的侧脑室1 nmol/L NPS注射组,差异有统计学意义(P<0.05)。见表3。
2.4 侧脑室不同剂量NPS注射对小鼠醋酸扭体实验的影响
侧脑室0.1 nmol/L NPS注射组、侧脑室1 nmol/L NPS注射组、侧脑室10 nmol/L NPS注射组小鼠的扭体次数少于Saline组,侧脑室1 nmol/L NPS注射组小鼠、侧脑室10 nmol/L NPS注射组小鼠扭体次数少于侧脑室0.1 nmol/L NPS注射组,侧脑室10 nmol/L NPS注射组小鼠扭体次数少于1 nmol/L NPS注射组,差异有统计学意义(P<0.05)。NPS随着剂量从0.1 nmol/L到10 nmol/L,小鼠的疼痛抑制率逐漸增加。见表4。
3 讨论
瑞芬太尼属于高选择性μ阿片受体激动剂,因其良好的镇痛效果,预防拔管相关咳嗽,有效控制血流动力学波动,对患者肝肾功能及苏醒影响轻微,已在神经外科、妇科各类疾病手术的麻醉中应用广泛[14-15]。但使用瑞芬太尼药物麻醉导致患者停药后疼痛敏感度增加,痛觉阀值降低,皮肤疼痛耐受性降低,常引起热痛觉过敏和机械性异常性疼痛,增加了术后疼痛管理难度和术后并发症的发生率,严重影响患者术后身心健康和术后恢复[16]。
NRS为含有20个氨基酸的新型神经肽,NRS受体(NRSR)是具有典型的七次跨膜结构的蛋白偶联受体。NRS及其受体系统在多种生理过程中发挥着重要作用,促进觉醒、各种精神疾病、药物成瘾、调节摄食、炎症和免疫反应、应激反应和抗神经退行性疾病[16-17]。多项研究证实NPS通过受体产生明显的镇痛作用。中脑导水管周围灰质、中缝核、侧臂旁核是调节痛觉传导的重要区域,NRS前体和受体在其中具有广泛和高水平的表达。研究表明,NPS/NPSR系统调节神经元兴奋性,从而影响疼痛行为[18]。NPS/NPSR神经肽系统通过作用于杏仁核信息传递相关通路参与调控疼痛伴发的厌恶、焦虑、恐惧等痛情绪行为,并在其中发挥了重要的作用[19]。神经肽S可以通过杏仁核NPSR上调剂量依赖性地逆转慢性压迫性神经损伤大鼠的疼痛行为[20]。ERK1/2信号通路参与外周和中枢痛觉信号的调制,通过转录或非转录途径促进多种类型疼痛的形成和维持,是维持痛觉过敏的重要因素[21]。NPS激活受体以后可优先作用于ERK1/2的磷酸化,降低ERK1/2的磷酸化程度。剂量的不同、药物种类和给药方式的不同、给药后作用时间的不同会对痛敏程度、种类或范围产生不同的影响。本文旨在讨论NPS的浓度对于瑞芬太尼痛觉敏感小鼠的镇痛效果有何影响。
作为常用的热刺激致痛模型,热板实验和光照热甩尾实验评估机械性异常性疼痛和热痛觉过敏,评价了NPS在脊髓上水平的痛觉调节作用[22]。小鼠醋酸扭体实验敏感、简便,是判断药物是否具有镇痛作用的化学方法。实验结果显示,侧脑室注射NPS能延长热板实验和甩尾实验小鼠的痛阈潜伏期,减少小鼠醋酸扭体反应的次数,高剂量组的TWL、应答潜伏期、扭体反应次数均优于低剂量组,提示NPS提高瑞芬太尼诱发小鼠痛觉过敏的痛阈值,对痛觉过敏有一定的抑制作用,其作用强度与给药剂量呈一定的量效关系,10 nmol/L NPS引起的镇痛作用强于0.1 nmol/L NPS。
综上所述,本实验研究利用瑞芬太尼联合切口痛构建了痛觉过敏模型,并以此模型为基础进行后续实验研究。观察不同剂量NPS侧脑室注射对瑞芬太尼所引起的痛觉过敏小鼠即时TWL、应答潜伏期、扭体反应次数的影响,是NPS剂量对痛阈影响的一次初步研究,NPS能够有效抑制动物模型中的炎症疼痛和神经病理性疼痛,缓解由于瑞芬太尼所引起的痛觉过敏,镇痛作用强度与剂量呈一定的量效关系,为临床用药防治瑞芬太尼引起的OIH提供重要的参考依据。
[参考文献]
[1] Mercadante S,Arcuri E,Santoni A,et al.Opioid-induced toleranceand hyperalgesia[J]. CNS Drugs,2019,33(10):943-955.
[2] Zhang P,Moye LS,Southey BR,et al. Opioid-induced hyperalgesia is associated with dysregulation of circadian rhythm and adaptive immune pathways in the mouse trigeminal ganglia and nucleus accumbens[J]. Mol Neurobiol,2019,56(12):7929-7949.
[3] Yu EH,Tran DH,Lam SW,et al.Remifentanil tolerance and hyperalgesia:Short-term gain,long-term pain?[J].Anaesthesia,2016,71(11):1347-1362.
[4] Zhou J,Qi F,Hu Z,et al. Dezocine attenuates the remifentanil-induced postoperative hyperalgesia byinhibition of phosphorylation of CaMKⅡα[J]. Eur J Pharmacol,2019, 869:172882.
[5] Wu JX,Assel M,Vickers A,et al. Impact of intraoperative remifentanil on postoperative pain and opioid use in thyroid surgery[J]. J Surg Oncol,2019,120(8):1456-1461.
[6] Vardon Bounes F,Pichon X,Ducos G,et al. Remifentanil for procedural sedation and analgesia in central venous catheter insertion:A randomized,controlled trial[J]. Clin J Pain,2019,35(8):691-695.
[7] An XJ,Liu RJ,Yang J,et al. Effects of remifentanil gradual withdrawal on remifentanil induced postoperative hyperalgesia[J]. Zhonghua Yi Xue Za Zhi,2019,99(17):1298-1301.
[8] Baykan H,Baykan ,Durmaz O,et al. Plasma neuropeptide-S levels in populations diagnosed with generalized anxiety disorder:A controlled study[J]. Noro Psikiyatr Ars,2019,56(1):52-56.
[9] Shi X,Guo TZ,Li W,et al. Exercise reverses nociceptive sensitization,upregulated neuropeptide signaling,inflammatory changes,anxiety,and memory impairment in a mouse tibia fracture model[J]. Anesthesiology,2018,129(3):557-575.
[10] Holanda VAD,Oliveira MC,Souza LS,et al.Dopamine D1 and D2 receptors mediate neuropeptide S-induced antinociception in the mouse formalin test[J].Eur J Pharmacol,2019,859:172557.
[11] Brennan TJ,Vandermeulen EP,Gebhart GF. Characteriaztion of an animal model of incisional pain[J]. Pain,1996, 64(3):493-501.
[12] Li Y,Wang H,Xie K,et al. Inhibition of glycogen synthase kinase-3β prevents remifentanil-induced hyperalgesia via regulating the expression and function of spinal N-Methyl-D-Aspartate receptors in vivo and vitro[J].PLoS ONE,2013, 8(10):e77790.
[13] Yuan Y,Wang JY,Yuan F,et al. Glycogen synthase kinase-3β contributes to remifentanil-induced postoperative hyperalgesia via regulating N-methyl-D-aspartate receptor trafficking[J]. Anesth Analg,2013,116(2):473-481.
[14] Kwon JH,Shin YH,Gil NS,et al. Effect-site concentration of remifentanil for smooth emergence from sevoflurane anesthesia in patients undergoing endovascular neurointervention[J]. PLoS One,2019,14(6):e0218074.
[15] Vardon Bounes F,Pichon X,Ducos G,et al. Remifentanil for Procedural Sedation and Analgesia in Central Venous Catheter Insertion:A Randomized,Controlled Trial[J]. Clin J Pain,2019,35(8):691-695.
[16] Ghazal P. The Physio-Pharmacological Role of the NPS/NPSR System in Psychiatric Disorders:A Translational Overview[J]. Curr Protein Pept Sci,2016,17(4):380-397.
[17] Zhao P,Qian X,Nie Y,et al. Neuropeptide S Ameliorates Cognitive Impairment of APP/PS1 Transgenic Mice by Promoting Synaptic Plasticity and Reducing Aβ Deposition[J].Front Behav Neurosci,2019,13:138.
[18] Banerjee S,Chaturvedi CM.Neuroendocrine mechanism of food intake and energy regulation in Japanese quail under differential simulated photoperiodic conditions:Involvement of hypothalamic neuropeptides,AMPK,insulin and adiponectin receptors[J].J Photochem Photobiol B,2018,185:10-23.
[19] 吳叶琪,项亚楠,房军帆,等.杏仁核NPS/NPSR神经肽系统参与痛情绪过程的研究进展[J].浙江中医药大学学报,2019,43(3):286-290.
[20] 金旭,曾敏,熊蔚,等.侧脑室内连续注射神经肽S对神经病理性疼痛大鼠疼痛及焦虑行为的影响[J].中国康复理论与实践,2014,20(7):621-625.
[21] Li Y,Wang H,Xie K,et al. Inhibition of glycogen synthase Kinase-3β prevents remifentanil-induced hyperalgesia via regulating the expression and function of spinal N-Methyl-D-Aspartate receptors In vivo and vitro[J].PLoS ONE,2013, 8(10):e77790.
[22] Qi F,Liu T,Zhang X.Ketamine reduces remifentanil-induced postoperative hyperalgesia mediated by CaMKII-NMDAR in the primary somatosensory cerebral cortex region in mice[J]. Neuropharmacology,2020,162:107783.
(收稿日期:2020-01-10)

