MST1通过促进PEPCK的表达调控小鼠肝脏糖异生
解相宏,耿 超,赵 微,李春美,张伟虹,杨佳卉,刘晓军*
(1.中国医学科学院基础医学研究所 北京协和医学院基础学院 医学分子生物学国家重点实验室, 北京 100005;2.山西医科大学 基础医学院 微生物学与免疫学教研室, 山西 太原 030001)
糖尿病是一种代谢紊乱性疾病,该病凭借着高患病率、高致残率和高致死率已然成为全球面临的严重健康问题。近年来, 中国的糖尿病发病率逐年升高,发病人数亦逐年增加。有研究表明,按照世界卫生组织(WHO)的诊断标准,中国成年人的糖尿病总患病率从2007年的9.7%已上升到2017年的11.2%[1]。肝脏作为代谢的中枢器官,是机体进行糖异生的主要场所。在糖尿病进程中,肝脏糖输出异常增加是造成糖尿病患者持续性高血糖的重要因素之一[2]。磷酸烯醇式丙酮酸羧化酶(phosphoenolpyruvate carboxykinase,PEPCK)是肝脏糖异生途径的一个限速酶,有文献报道糖尿病db/db小鼠在感染PEPCKshRNA腺病毒后,极大改善了小鼠的高血糖和高胰岛素血症等不良状况[3]。哺乳动物不育系20样激酶1 (mammalian sterile 20-like kinase 1, MST1) 是一种丝氨酸/苏氨酸激酶,作为Hippo信号通路的核心成分之一,主要参与调节细胞增殖和周期、促进细胞凋亡、抑制肿瘤生长等生物过程[4-6]。有研究表明,MST1可以通过沉默交配型信息调节因子2同源蛋白1(silent mating type information regulation 2 homolog 1,SIRT1)抑制固醇调节元件结合蛋白-1c(sterol regulatory element-binding protein 1c,SREBP-1c),提高抗氧化基因的表达进而调控肝脏的脂代谢[7]。然而,有关MST1在肝脏糖异生中的作用及调节机制目前尚未见报道。
1 材料与方法
1.1 材料
1.1.1 实验动物:8周龄的雄性糖尿病模型db/db小鼠和对照db/m小鼠[SPF级,南京大学模式动物研究所,许可证号:SCXK(苏)2018-0008];8周龄的雄性C57BL/6小鼠(SPF级,中国医学科学院基础医学研究所实验动物中心)。
1.1.2 细胞培养:人肝癌细胞系(HepG2)为本实验室保存。
1.1.3 质粒和腺病毒:MST1表达质粒(pCMV5-MST1-FLAG)、MST1失活突变体表达质粒(pCMV5-DN-MST1-FLAG)(中国人民解放军军事医学科学院的袁增强教授友情提供);报告基因质粒pGL3-Basic-PEPCK启动子(-450 bp~-1 bp),pRL-TK质粒、FOXO1表达质粒(pcDNA3-FOXO1-FLAG)、FOXO1突变体表达质粒(pcDNA3-FOXO1-Δ256-FLAG)、MST1过表达腺病毒(Ad-MST1)、带GFP标签的腺病毒(Ad-GFP)、FOXO1干扰腺病毒(Ad-shFOXO1)、对照干扰腺病毒(Ad-shCON)(本实验室保存)。
1.1.4 主要试剂:Trizol(Invitrogen公司);RIPA裂解液(碧云天生物技术有限公司);DMEM基础培养基,RPMI 1640培养基,胎牛血清(Gibco公司);SYBR Green Ⅰ Q-PCR kit(Promega公司);组织细胞葡萄糖氧化酶测定试剂盒(普利莱基因技术有限公司);PierceTMBCA Protein Assay Kit(Thermo Fisher Scientific公司);高效真核转染试剂VigoFect(威格拉斯生物技术有限公司);Dual-Luciferase®Reporter Assay System(Promega公司)。
1.2 方法
1.2.1 总RNA提取和RT-qPCR:剪取适当大小的小鼠肝脏组织在低温研磨后用Trizol试剂提取总RNA。定量取2 μg的总RNA配置20 μL反应体系反转录为cDNA,并在PCR扩增仪上进行扩增反应。定量取1 μL的cDNA模板,采用SYBR Green I Q-PCR kit配置20 μL反应体系,在Bio-Rad CFX96 real-time system上进行扩增并实时荧光定量检测。所有基因的表达都以β-actin进行均一化处理,最终得到mRNA的相对表达量。引物序列如下:人MST1上游引物:5′-CGGAATACAGTGATAGGAAC-3′,下游引物:5′-AAGATTGCCC TCATTGGATG-3′;鼠MST1上游引物:5′-AGGAATACAGTAATAGG GAC-3′,下游引物:5′-AATATTGCCCTCATTGGATG-3′; 人PEPCK上游引物:5′-TATGACAACTGCTGG TTGGC-3′,下游引物:5′-ATAACCGTCTTGCTTTCG ATC-3′;鼠PEPCK上游引物:5′-CAGGATCGAAA GCAAGACAGT-3′,下游引物:5′-AAGTCCTCTTCC GACATCCAG-3′;鼠FOXO1上游引物:5′-GTGAAC ACCATGCCTCACAC-3′,下游引物:5′-CACAGTCC AAGCGCTCAATA-3′;β-actin上游引物:5′-CCAGC CTTCCTTCTTGGGTAT-3′,下游引物:5′-TGCTGG AAGGTGGACAGTGAG-3′;人GAPDH上游引物:5′-CCCCTTCATTGACCTCAACTAC-3′,下游引物:5′-GAGTCCTTCCACGATACCAAAG-3′;扩增条件:95 ℃预变性3 min,循环55次;95 ℃变性10 s,58 ℃退火20 s。结果以2-ΔΔCt法计算目的基因的相对表达水平。
1.2.2 细胞感染病毒和转染:分离C57BL/6小鼠的肝原代细胞接种至6孔板,培养12 h之后感染Ad-MST1,以Ad-GFP作为对照,感染24~48 h后收集细胞。小鼠肝原代细胞的分离培养以及感染腺病毒具体方法见参考文献[8]。将HepG2细胞以(2~4)×104个/孔的细胞数接种到6孔板,培养24 h后进行转染,分别设两组各3个复孔,实验组转染pCMV5-MST1-FLAG质粒,对照组转染空质粒载体,转染方式参照高效真核转染试剂说明书进行。
1.2.3 细胞葡萄糖输出的测定:C57BL/6小鼠的肝原代细胞在感染病毒48 h后,弃去培养基并用PBS洗3遍,然后换成无葡萄糖无酚红的DMEM培养基,加入乳酸钠、丙酮酸钠、地塞米松(DEX)和forskolin(FSK)至终浓度分别为20 mmol/L及2 mmol/L和1 μmol/L及10 μmol/L,37 ℃孵育3~6 h。收集上清液测定葡萄糖的浓度(具体操作见试剂盒说明书)。收集细胞用RIPA裂解液裂解后,用BCA法测定蛋白浓度,以葡萄糖浓度和蛋白浓度的比值作均一化(具体操作见试剂盒说明书)。
1.2.4 双荧光素酶报告基因检测启动子活性:在条件为37 ℃,5% CO2的细胞培养箱中培养HepG2细胞至汇合度为50%~70%时,将不同的质粒载体共转染转入细胞,培养24~48 h后,按照双荧光素酶报告基因检测试剂盒说明书测定各组荧光素酶活性,以对照组作均一化处理。
1.3 统计学分析

2 结果
2.1 Real-time PCR检测MST1在糖尿病小鼠db/db肝脏组织中的表达
糖尿病db/db小鼠肝脏组织中,MST1 mRNA的表达水平(2.42±0.52)显著高于对照组(1.00±0.41)(P<0.001)。
2.2 肝原代细胞中过表达MST1促进葡萄糖输出
小鼠肝原代细胞感染MST1腺病毒,Ad-MST1组的葡萄糖输出(1.40±0.61)高于对照组(1.00±0.14)(P<0.05)。
2.3 MST1通过增强PEPCK的启动子活性来促进其表达
在HepG2细胞中过表达MST1,可显著上调PEPCK的mRNA水平(P<0.001)(图1A);同时增强了PEPCK的启动子活性(P<0.01),而MST1失活突变体(DN-MST1)对PEPCK启动子激活作用消失,表明MST1可以通过增加PEPCK启动子活性来促进其表达(图1B)。
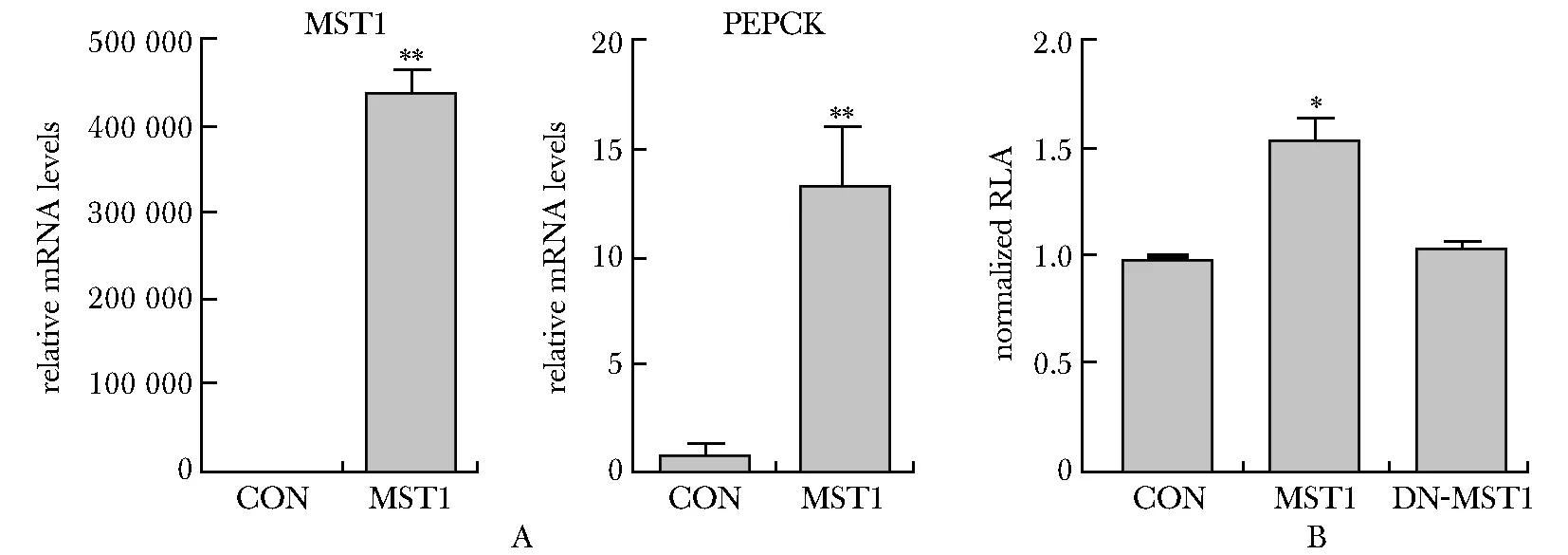
A.MST1 over-expression upregulated the mRNA levels of PEPCK; B.MST1 over-expression increased the activity of PEPCK promoter; *P<0.01,**P<0.001 compared with control group
2.4 FOXO1参与MST1调控PEPCK
在HepG2细胞中,过表达叉头盒转录因子O1(forkhead transcription factor O1, FOXO1)显著激活PEPCK的启动子活性(P<0.05),而突变体FOXO1-Δ256不仅对PEPCK启动子活性无激活效应,反而有抑制作用(P<0.001);共转染MST1拮抗了FOXO1-Δ256对PEPCK启动子活性的抑制作用(P<0.001)(图2A)。进一步在肝原代细胞中,用Ad-shFOXO1敲低FOXO1表达,MST1诱导PEPCKmRNA表达增加的作用消失(图2B)。
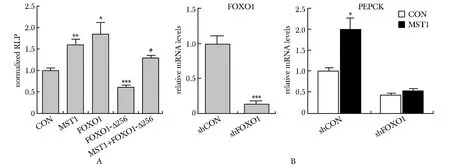
A.MST1 over-expression alleviated the inhibitory effect of FOXO1-Δ256 on the activity of PEPCK promoter; B.FOXO1 mediated MST1-induced increase in PEPCK mRNA levels; *P<0.05,**P<0.01,***P<0.001 compared with control group;#P<0.001 compared with FOXO1-Δ256
3 讨论
在长期禁食情况下,机体会启动肝脏糖异生增加糖输出来维持血糖水平,保证其相对恒定的稳态,这是一个多分子、多因素参与和调控的过程。但在某些异常机制下,肝糖异生过度激活使内源性血糖水平升高最终导致糖尿病等代谢类疾病的发生[9]。
MST1是一种促凋亡激酶,是细胞凋亡过程的重要调控者。本研究发现在糖尿病模型db/db小鼠肝脏组织中MST1的mRNA 表达增加,过表达MST1促进小鼠肝原代细胞的葡萄糖输出。之前有研究证实在糖尿病小鼠模型中敲除MST1有抑制高血糖和糖尿病进展的保护性作用[10],表明MST1可能参与机体的葡萄糖代谢。PEPCK是肝糖异生途径中一个非常关键的限速酶,已有报道表明FOXO1、CREB、 PGC-1α与激素和糖异生限速酶葡萄糖-6-磷酸酶(G-6-Pase)和PEPCK编码基因的串话(cross talk)是决定糖异生启动的关键环节[11]。本研究中,MST1促进了PEPCKmRNA水平的表达并增强PEPCK的启动子活性,表明MST1可能通过调节PEPCK的表达在肝脏糖异生过程中发挥作用。FOXO1属于FOXOs家族的一个亚型,是胰岛素信号通路的关键靶点,可以调控机体多种基因的表达,包括可以通过上调PEPCK的表达参与机体糖代谢。有报道称肝脏中FOXO蛋白功能的调节对胰岛素维持糖稳态和抑制肝脏葡萄糖生成的能力至关重要,而FOXO蛋白功能失调被认为是糖尿病的发病机制之一[12]。MST1可以通过磷酸化FOXO1促进FOXO1入核发挥一系列生理病理功能[5]。本研究中,过表达MST1逆转了FOXO1突变体对PEPCK启动子活性的抑制效应,而敲低FOXO1表达后,MST1对PEPCKmRNA的促表达作用消失。
综上所述,MST1可以通过促进PEPCK的表达来调控小鼠肝脏糖异生,并且这一过程依赖于FOXO1。本研究表明MST1有可能成为未来糖尿病预防和临床诊疗的新靶点。

