负载TGF-β3壳聚糖复合水凝胶促进兔半月板缺损修复
王 赟,徐宏宇,潘宗友,倪利承,王刚祥,赵 勇,郑 强*
(1.浙江大学医学院附属第二医院 骨科,浙江 杭州 300009; 3.浙江大学医学院附属第一医院 骨科,浙江 杭州 310003;2.嵊州市人民医院 骨科,浙江 嵊州 312400)
对于膝关节半月板内侧无血供区域的损伤,只能采用半月板完全或部分切除术等姑息性手术方法,愈后效果较差[1-2]。近些年来组织工程技术为治疗半月板损伤带来了新的希望[3-4]。壳聚糖复合水凝胶(chitosan composite hydrogel)具有良好的理化性能、力学性能、降解性能及生物相容性,是一种较理想的可注射支架材料[5]。骨髓间充质干细胞(bone marrow mesenchymal stem cells,BM-MSCs)在组织工程中应用广泛,是较理想的种子细胞。转化生长因子β3(transforming growth factor-β3,TGF-β3)不但可调控软骨与骨的再生过程[6-7],还能调节细胞外基质的分泌,抑制组织再生过程中的瘢痕形成[8],诱导间充质干细胞分化为成纤维软骨样细胞[9]。但是,目前较少见将TGF-β3应用于半月板损伤修复中。基于此,本实验拟研究BM-MSCs负载TGF-β3的壳聚糖复合水凝胶联合修复半月板缺损的效果。
1 材料与方法
1.1 材料
1.1.1 实验动物:4周龄新西兰大白兔3只,SPF级,体质量(0.75±0.18)kg,雌雄不限,用于BM-MSCs的提取;8周龄新西兰大白兔60只,体质量(2.05±0.26)kg,雌雄不限,用于半月板缺损造模。均由浙江大学实验动物中心提供[许可证号:SCXK(浙)2018-0001]。
1.1.2 主要材料、试剂:聚乙烯醇(北京沃比森科技有限公司);壳聚糖(成都化夏化学试剂有限公司);TGF-β3(上海康朗生物科技有限公司);DMEM/F-12培养液、胎牛血清(北京索莱宝科技有限公司);成脂诱导分化培养基、成骨诱导分化培养基(北京雅安达生物技术有限公司);Ⅱ型胶原多克隆抗体(武汉云克隆科技股份有限公司);蛋白聚糖多克隆抗体(上海钦诚生物科技有限公司)。
1.2 方法
1.2.1 BM-MSCs的培养与鉴定:耳缘静脉注射1%戊巴比妥钠3 mL/kg麻醉,无菌环境下取双侧股骨,以含双抗的PBS清洗,剪去骨干两端的干骺端,以含10%胎牛血清的DMEM/F-12培养液冲洗髓腔,冲出的悬液接种于培养皿内,置于37 ℃、体积分数5% CO2培养箱中培养,每2~3 d换液1次。观察细胞达到85%汇合时,胰蛋白酶消化后传代培养。取第3代细胞进行实验。
取第3代BM-MSCs,接种至24孔板,分别进行成骨诱导分化与成脂诱导分化,成骨诱导分化培养液成分为:体积分数5%胎牛血清、50 μmol/L维生素C、10 μmol/L β-磷酸甘油、100 nmol/L地塞米松、1%的双抗及DMEM/F-12培养基,成脂诱导分化培养成分为:体积分数10%胎牛血清、10 μmol/L胰岛素、1 μmol/L地塞米松、200 μmol/L吲哚美辛、1%的双抗及DMEM/F-12培养基,置于37 ℃、体积分数5%CO2培养箱中培养,每2~3 d换液1次。成骨诱导14 d时进行茜素红染色,成脂诱导14 d时进行油红O染色。
1.2.2 壳聚糖复合水凝胶的制备:在超纯水中加入5 g的聚乙烯醇并加热至60 ℃,20min后可见明显溶胀的聚乙烯醇,置于磁力搅拌器上90 ℃搅拌3 h,配制聚乙烯醇水溶液。在洁净的烧杯中加入1 g的壳聚糖,在通风厨中加入1%的乙酸溶液(壳聚糖与乙酸的体积比为1∶50),密封后于磁力搅拌器上搅拌1 h,制备壳聚糖溶液。将聚乙烯醇水溶液与壳聚糖溶液以6∶4的质量比混合,按15∶1的质量比在混合溶液中加入表面活性剂聚山梨酯80溶液磁力搅拌30 min,之后置于真空干燥箱中1 h以去除气泡。然后导入无菌24孔板内,每孔约2 mL混合液,密封后置于-20 ℃冷冻箱中20 h;取出后室温下融化8 h,此过程重复7次。在24孔板内加入少许1% NaOH溶液浸泡12 h,加入0.9%氯化钠溶液调整pH至中性,最后置于超纯水中保存。扫描电镜下观察壳聚糖复合水凝胶的微观结构。
1.2.3 负载生长因子壳聚糖复合水凝胶的制备:取1 μg TGF-β3,800 r/min 离心5 min,加入20 μL柠檬酸(10 mmol/L),调节pH值为3.0,室温放置10 min后加入5 mL含适量牛血清白蛋白的PBS,TGF-β3的浓度为200 μg/L。将0.5 mL TGF-β3溶液缓慢加入壳聚糖复合水凝胶中,振荡混匀。
取第3代BM-MSCs,分别加入负载TGF-β3的壳聚糖复合水凝胶与单纯壳聚糖复合水凝胶中,调整细胞为1×107/mL,培养2 h。活死染色观察水凝胶内的细胞。
1.2.4 兔的分组及处理:耳缘静脉注射戊巴比妥钠3 mL/kg麻醉,仰卧固定四肢,在一侧膝关节取正中切口,将髌骨向外侧翻开,游离内侧半月板前角内侧,利用环钻在内侧半月板前角内侧制作直径2 mm的全层缺损,随机分3组处理:对照组未植入任何材料,不做修复处理;修复Ⅰ组缺损处注入壳聚糖复合水凝胶与BM-MSCs复合物;修复Ⅱ组缺损处注入负载TGF-β3的壳聚糖复合水凝胶与BM-MSCs复合物;关闭关节囊后逐层关闭切口。术后所有动物不做外固定,自由活动,连续注射青霉素3 d预防感染。
1.2.5 放射学检查:术后8周、12周,每组各随机处死兔10只,取术侧膝关节进行MRI检查。将兔肢体置于小动物核磁专用线圈中,并将膝关节置于线圈的中心位置,利用以色列Aspect M7小动物磁共振成像系统进行磁共振检测,行T2加权扫描,观察半月板缺损区修复情况。
1.2.6 大体观察:放射线检查完成后,切取术侧半月板组织,观察缺损区修复情况。同时利用Axio Vision Rel软件定量分析新生半月板的大小。
大体观察没有通用的损伤-修复的评分标准偏主观性,缺乏信服力。
1.2.7 组织学观察:取半月板组织,放入10%甲醛固定 24 h,体积分数70%、80%、90%、95%、100%乙醇梯度脱水各30 min,依次置入二甲苯Ⅰ 15 min、二甲苯Ⅱ 15 min至标本透明,浸蜡、包埋、切片,切片厚度6 μm,常规苏木精-伊红(HE)染色,光镜下观察。
1.2.8 Western blot检测相关蛋白表达:取缺损区域半月板组织,置于液氮中粉碎,加入裂解液制备匀浆,16 000×g离心10 min后提取总蛋白,采用BCA法检测总蛋白浓度。配制电泳凝胶→配制buffer与蛋白混合样,加样→电泳→根据目的条带的大小及标准蛋白所指示的具体位置问合适大小的PVDF膜,转膜→放入含有封闭液的孵育盆中摇床孵育2 h→孵育一抗(Ⅱ型胶原、蛋白聚糖多克隆抗体)与二抗→发光显影。
1.3 统计学分析
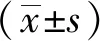
2 结果
2.1 BM-MSCs的培养与鉴定
第3代BM-MSCs呈长梭形,逐渐融合成片,细胞排列呈漩涡状(图1A);成脂诱导14 d后,油红O染色可见脂滴形成(图1B);成骨诱导14 d后,茜素红染色可见钙化结节(图1C)。

A.the third generation of BM-MSCs; B.differentiation of the third generation of BM-MSCs induced by lipogenesis;C.osteogenic differentiation of the third generation of BM-MSCs
2.2 壳聚糖复合水凝胶的微观形貌
扫描电镜显示,壳聚糖复合水凝胶表面分布着大小不等的孔洞结构,内部亦分布着大小不等的孔洞结构,孔洞之间贯通较好,较大的孔径200~400 μm(图2A)。活死染色显示,壳聚糖复合水凝胶中的BM-MSCs分布较为均匀,细胞增殖形态良好(图2B,C)。
2.3 动物实验
2.3.1 实验动物术后一般情况:60只兔术后均未发生感染,无死亡,术后有跛行,1周后消失;所有动物关节无红肿,关节腔内可见少量淡黄色的关节液,未见关节囊挛缩,滑膜无充血、水肿,无组织黏连。
2.3.2 放射学检查: 术后8周,矢状位T2WI可见对照组半月板前角全层缺损,呈不规则增高的信号;修复Ⅰ组可见大部分信号较高的物质填充于半月板前角全层缺损中;修复Ⅱ组可见部分较高的物质填充于半月板前角全层缺损中。术后12周,矢状位T2WI可见对照组半月板前角全层缺损,仍呈不规则增高的信号(图3A);修复Ⅰ组可见部分信号较高的物质填充于半月板前角全层缺损中(图3B);修复Ⅱ组仅局部可见少量高信号影,表面几乎平滑(图3C)。
2.3.3 大体观察: 对照组术后8周时缺损底部以薄层纤维结缔组织填充,质地较软且与与周围组织结合疏松;术后12周时缺损部位无明显变化,仍以薄层纤维结缔组织填充(图4A)。修复Ⅰ组组术后8周时缺损部位由部分白色的修复组织填充,质地稍韧,与周围组织有明显的界限,但与周围组织结合较紧密;术后12周时缺损部位进一步修复,但仍与周围组织有较明显的界限(图4B)。修复Ⅱ组术后8周时缺损部位由大部分白色修复组织填充, 质地较韧,与周围组织结合紧密;术后12周时缺损部位几乎由白色修复组织填充完整,表面较光滑,与周围组织已无明显的界限(图4C)。对照组、修复Ⅰ组与修复Ⅱ组新生半月板组织覆盖率依次为2.3%±0.2%、58.2%±9.8%、78.9%±10.2%。统计分析显示,修复Ⅰ组与修复Ⅱ组新生半月板组织覆盖率高于对照组(P<0.01),修复Ⅱ组高于修复 Ⅰ 组(P<0.05)。

A.scanning electron microscopy observation of the micromorphology of chitosan composite hydrogels(×500);B,C.observation of BM-MSCs in chitosan composite hydrogel by living dead staining(×40)

A.control group; B.repair group Ⅰ; C.repair group Ⅱ图3 术后12周各组膝关节MRI矢状位T2WI影像Fig 3 Sagittal T2WI images of knee joint in each group 12 weeks after operation

A.control group; B.repair group Ⅰ; C.repair group Ⅱ图4 术后12周时各组半月板缺损部位大体观察Fig 4 Gross observation of meniscus defect at 12 weeks after operation in each group
2.3.4 组织学观察: 苏木精-伊红(HE)染色显示,术后8周时,对照组缺损区域未见明显修复,软骨细胞体积较小,未见软骨囊;对照组水凝胶大部分已降解,可见少量软骨细胞;实验组水凝胶大部分已降解,可见较大量的软骨细胞及少量的胶原纤维。术后12周时,对照组缺损区域依然无明显变化(图5A);修复Ⅰ组水凝胶基本已降解完全,可见大量成纤维细胞,胶原纤维排列混乱(图5B); 修复Ⅱ组水凝胶基本已降解完全, 可见大量的胶原纤维与成团的软骨细胞,软骨囊形成,与正常组织之间有胶原纤维连接,无间隙,并且胶原纤维排列规则(图5C)。
2.3.5 Western blot检测:术后8周、12周,对照组Ⅱ型胶原、蛋白聚糖蛋白表达均低于修复Ⅰ组、修复Ⅱ组(P<0.05,P<0.01);修复Ⅰ组Ⅱ型胶原、蛋白聚糖蛋白表达均低于修复Ⅱ组(P<0.05)(图6)。
3 讨论
TGF-β3属于TGF-β超家族成员,与TGF-β1为同源异构体,可调节细胞的增殖分化,使正常成纤维细胞表型发生转化,促进成纤维细胞、成骨细胞和许旺细胞增殖[10],可以诱导BM-MSCs转化为软骨细胞。TGF-β3在半月板发育中具有重要作用[11]。此外,观察TGF-β3种不同亚型(β1、β2和β3)对前软骨干细胞的增殖分化及细胞外基质合成的影响发现,TGF-β3较另TGF-β两种亚型对前软骨干细胞增殖和分化的正向调节作用更为显著[12]。因此,本实验将TGF-β3负载于壳聚糖复合水凝胶中,观察其对半月板缺损的修复作用。
本实验结果显示,对照组术后12周内影像学检查无愈合现象,组织学观察也未见明显的修复现象,无血运半月板损伤不能自然愈合。单纯壳聚糖复合水凝胶联合BM-MSCs修复组在术后8周、12周时相对于对照组均表现出不同程度的修复愈合,说明壳聚糖复合水凝胶联合BM-MSCs构建的组织工程软骨可在一定程度上修复兔半月板缺损,提示半月板并不是完完全全的惰性组织,无血运半月板损伤部位在一定条件刺激下可产生纤维组织的愈合。而对比单纯壳聚糖复合水凝胶联合BM-MSCs修复组,负载TGF-β3的壳聚糖复合水凝胶联合BM-MSCs修复组术后8周、12周的修复效果更加显著,其可能的作用机制为:促进BM-MSCs分化为软骨细胞,促进软骨特异性基质的合成。笔者认为在适宜的生长环境中,在种子细胞、支架材料与生长因子参与甚至更多因素参与时,可促进纤维软骨细胞大量增殖并合成合成基质蛋白等成分,有可能实现无血运半月板损伤的愈合。将TGF-β3负载于壳聚糖复合水凝内可起到良好的缓释效果,但是具体的负载剂量与缓释时效还有待研究。本研究的实验周期较短,长期修复效果还有待进一步的证实。

A.control group; B.repair group Ⅰ; C.repair group Ⅱ图5 术后12周各组半月板缺损部位组织学观察Fig 5 Histological observation of meniscus defect in each group at 12 weeks after operation (HE staining)

A.Western blot of type Ⅱ collagen and proteoglycan protein 8 weeks after operation;B.Western blot of type Ⅱ collagen and proteoglycan protein 12 weeks after operation;*P<0.05,**P<0.05 compared with the control group;#P<0.05 compared with the repair group Ⅰ
本实验结果显示,负载TGF-β3的壳聚糖复合水凝胶联合BM-MSCs可促进兔半月板缺损的修复,将继续观察其长期修复效果。

