血浆PRA、CTRP3水平与2型糖尿病患者颈动脉粥样硬化的关系
陈毅光,刘枘岢,李雯翀,周敏华,朱咏瑶 东莞市松山湖中心医院,广东东莞523320
2型糖尿病(T2DM)是动脉粥样硬化的独立危险因素之一,长期高血糖可损伤血管内皮功能,加剧氧化应激反应和动脉粥样硬化性疾病进程[1]。颈动脉是动脉粥样硬化的好发部位,也是反映全身动脉粥样硬化的窗口,可预测心脑血管事件的发生风险[2]。因此,探讨与T2DM患者颈动脉粥样硬化密切相关的生物标志物有助于早期预测心脑血管疾病的发生风险。有研究报道,肾素—血管紧张素—醛固酮系统(RAAS)[3]、脂肪细胞因子在动脉粥样硬化过程中发挥重要作用[4]。肾素活性(PRA)是RAAS中的一个关键上游酶调节因子,通过调节RAAS,促使肾素、血管紧张素Ⅱ、醛固酮分泌。PRA活性升高可能通过促炎、促凝、损伤血管内皮功能等途径导致动脉粥样硬化的发生[3]。C1q/TNF相关蛋白3(CTRP3)是新近发现的一种脂肪细胞因子,对机体具有正性作用,在调节代谢、保护心肌、改善血管内皮功能等方面具有重要作用。有研究报道,CTRP3能够抑制血管重塑和血栓形成,与动脉粥样硬化性疾病的发生密切相关[4]。本研究探讨了血浆PRA、CTRP3水平与T2DM患者颈动脉粥样硬化的关系。现报告如下。
1 资料与方法
1.1 临床资料 选择2018年5月—2019年5月东莞市松山湖中心医院收治的T2DM患者137例(T2DM组)。T2DM诊断符合《中国2型糖尿病防治指南(2017年版)》[5]中的诊断标准:糖尿病症状+随机血糖≥11.1 mmol/L或空腹血糖≥7 mmol/L或口服葡萄糖耐量试验2 h血糖≥11.1 mmol/L。纳入标准:①符合T2DM诊断标准[5];②年龄18~80周岁;③入组前未接受降糖和调脂治疗。排除标准:①妊娠期糖尿病者;②合并急慢性感染、自身免疫性疾病、恶性肿瘤等疾病者;③既往有心脑血管疾病史者;④近期服用降糖、调脂、抗感染、抗氧化药物或免疫抑制剂者。所有患者入院后采用Philips Sonos5000彩色多普勒超声诊断仪测量颈动脉内膜—中层厚度(IMT),以IMT≥1.3 mm为斑块形成,其中有斑块形成83例(斑块组)、无斑块形成54例(无斑块组)。本研究经东莞市松山湖中心医院医学伦理委员会批准,患者或其家属知情同意。
1.2 资料收集与分析 所有研究对象入院后收集一般临床资料[性别、年龄、BMI、血压(收缩压、舒张压)、基础疾病(高血压、高脂血症)、吸烟史、饮酒史、心脑血管疾病家族史、饮食方式、运动方式]、实验室检查资料[TC、TG、LDL-C、HDL-C、空腹血糖(FPG)、空腹胰岛素(FINS)、胰岛素抵抗指数(HOMA-IR)、糖化血红蛋白(HbA1c)、PRA、CTRP3]。比较两组一般临床资料和实验室检查资料,将两组上述有统计学差异指标纳入多元逐步Logistic回归模型,分析影响T2DM并发颈动脉粥样硬化的危险因素。
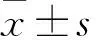
2 结果
2.1 两组临床资料比较 两组一般临床资料共纳入12个因素。斑块组男56例、女27例,年龄(62.46±3.42)岁,BMI(26.13±2.36)kg/m2,收缩压(139.35±5.16)mmHg、舒张压(71.29±3.26)mmHg,合并高血压44例、高脂血症46例,有吸烟史36例、饮酒史23例,有心脑血管疾病家族史19例,不合理饮食43例,缺乏运动45例;无斑块组男34例、女20例,年龄(61.92±3.13)岁,BMI(23.21±2.42)kg/m2,收缩压(130.24±5.03)mmHg、舒张压(70.19±3.16)mmHg,合并高血压17例、高脂血症13例,有吸烟史14例、饮酒史16例,有心脑血管疾病家族史11例,不合理饮食18例,缺乏运动20例。两组BMI、收缩压、有吸烟史例数、合并高血压例数、合并高脂血症例数、不合理饮食例数、缺乏运动例数比较差异均有统计学意义(t/χ2分别为7.006、10.198、4.297、6.140、13.112、4.520、3.872,P均<0.05),而性别构成、年龄、舒张压、有饮酒史例数、有心脑血管疾病家族史例数比较差异均无统计学意义(χ2/t分别为0.295、0.933、1.953、0.059、0.122,P均>0.05)。
两组实验室检查资料共纳入10个因素。斑块组TC(5.80±0.35)mmol/L、TG(1.39±0.21)mmol/L、HDL-C(1.12±0.43)mmol/L、LDL-C(2.31±0.39)mmol/L,FPG(12.46±3.82)mmol/L,FINS(10.42±3.15)mmol/L,HOMA-IR 3.97±0.61,HbA1c(9.91±3.15)%,PRA(4.64±0.53)μg/(L·h),CTRP3(86.67±13.79)ng/mL;无斑块组TC(5.37±0.39)mmol/L、TG(1.35±0.20)mmol/L、HDL-C(1.21±0.38)mmol/L、LDL-C(2.29±0.35)mmol/L,FPG(10.24±2.76)mmol/L,FINS(8.32±2.61)mmol/L,HOMA-IR 2.25±0.34,HbA1c(7.02±2.09)%,PRA(4.03±0.49)μg/(L·h),CTRP3(106.35±26.35)ng/mL。两组TC、FPG、FINS、HOMA-IR、HbA1c、PRA、CTRP3比较差异均有统计学意义(t分别为6.716、3.688、4.072、18.884、5.941、6.779、5.714,P均<0.05),两组TG、HDL-C、LDL-C比较差异均无统计学意义(t分别为1.110、1.252、0.305,P均>0.05)。
2.2 影响T2DM并发颈动脉粥样硬化的危险因素 以T2DM是否并发颈动脉粥样硬化为因变量,以BMI、收缩压、吸烟史、合并高血压、合并高脂血症、饮食方式、运动方式、TC、FPG、FINS、HOMA-IR、HbA1c、PRA、CTRP3为自变量,纳入多元逐步Logistic回归模型。结果发现,收缩压、TC、HbA1c、PRA、CTRP3是T2DM并发颈动脉粥样硬化的危险因素(P均<0.05)。见表1。
2.3 血浆PRA、CTRP3水平对T2DM并发颈动脉粥样硬化的预测效能 构建血浆PRA、CTRP3水平单独和联合预测T2DM并发颈动脉粥样硬化的ROC曲线,结果显示血浆PRA水平预测T2DM并发颈动脉粥样硬化的曲线下面积(AUC)为0.731(95%CI:0.644~0.817),其截断(cut off)值为4.21 μg/(L·h),此时其预测T2DM并发颈动脉粥样硬化的敏感度为72.29%、特异度为79.63%;血清CTRP3水平预测T2DM并发颈动脉粥样硬化的AUC为0.801(95%CI:0.720~0.881),其cut off值为90.31 ng/mL,此时其预测T2DM并发颈动脉粥样硬化的敏感度为78.31%、特异度为87.04%;血浆PRA、CTRP3水平联合预测T2DM并发颈动脉粥样硬化的AUC为0.903(95%CI:0.843~0.964),其预测T2DM并发颈动脉粥样硬化的敏感度为91.57%、特异度为92.59%。
3 讨论
糖尿病是严重影响人类健康的全球性公共卫生问题之一,已经成为继心血管疾病、恶性肿瘤之后第三大威胁人类健康的非传染性疾病[6]。T2DM是糖尿病最常见的类型,约占糖尿病的90%。T2DM被公认为是心脑血管疾病的独立危险因素,与非糖尿病患者相比,其罹患大血管疾病的风险明显增加[7]。动脉粥样硬化是心脑血管疾病发病的主要病理基础,T2DM患者颈动脉粥样硬化的检出率较非糖尿病患者高,其动脉粥样硬化程度更重。因此,评估T2DM患者动脉粥样硬化程度可预测心脑血管疾病的发生风险。颈动脉超声是评估斑块形成的有效方法,但存在一定滞后性。外周血生物学指标能够在影像学检查发现斑块形成前提示早期颈动脉粥样硬化信息,有助于识别高危群体,从而预防心脑血管事件的发生。
RAAS是人体内作用最广泛的内分泌调节系统,能够调节血压和水盐代谢。RAAS病理激活与动脉粥样硬化、高血压、脑卒中等心脑血管疾病的发生、发展密切相关[8]。血管紧张素Ⅱ增加、一氧化氮降低引起的内皮细胞损伤可导致血管舒张和血管收缩之间的平衡被破坏,这可能是动脉粥样硬化形成的主要原因。RAAS通过影响血管内皮功能、炎症反应、纤溶平衡和斑块稳定性参与动脉粥样硬化的病理进程[9]。PRA是一种特异性天冬氨酸蛋白酶,主要由肾小球产生,是RAAS激活级联反应的始动因子。PRA活性升高可引起RAAS过度激活,并通过促炎、促凝、损伤血管内皮功能等参与动脉粥样硬化的病理进程,导致不稳定性粥样硬化斑块形成[10]。脂肪细胞因子与颈动脉粥样硬化斑块形成及其稳定性密切相关。CTRP3是具有心脑血管保护作用的新型脂肪细胞因子,与脂联素具有高度同源性和相似的生理作用[11],在抑制炎症反应、调节糖脂代谢、降低胰岛素抵抗、改善血管内皮功能等方面发挥一定作用[12]。有研究发现,CTRP3在抑制血管重塑和血栓形成方面亦具有重要作用,其表达缺失可引起糖尿病、脂肪肝、冠心病等疾病的发生、发展[13-14]。CTRP3能够通过TLR4-NF-κB、PPARγ-LXRα-ABCA1/ABCG1信号通路参与抗炎和巨噬细胞表型转换,其表达下调可导致其抗炎活性降低,促使动脉粥样硬化斑块形成[15]。CTRP3还可通过激活PI3K/AKT/eNOS信号通路抑制ox-LDL诱导的主动脉内皮细胞炎症反应和内皮功能障碍,加速动脉粥样硬化形成进程[4]。但目前血浆PRA、CTRP3水平与T2DM患者颈动脉粥样硬化的关系尚不清楚,相关报道较少。
JOSEPH等[16]认为,血浆PRA水平升高与T2DM患者FPG、胰岛素抵抗和胰岛β细胞功能有关,其水平升高可导致T2DM发病。张德龙等[17]研究发现,血浆CTRP3水平与高血压合并糖尿病患者颈动脉IMT呈负相关关系,血浆CTRP3水平每降低1 μg/L,颈动脉IMT将增加0.163倍。提示血浆PRA、CTRP3水平可能与T2DM患者并发颈动脉粥样硬化有关。本研究结果发现,斑块组血浆PRA水平高于无斑块组,血浆CTRP3水平低于无斑块组;多元逐步Logistic回归分析发现,血浆PRA、CTRP3水平是T2DM并发颈动脉粥样硬化的独立危险因素,与以往研究[16-17]结论基本一致。本研究ROC曲线分析显示,血浆PRA、CTRP3水平单独预测T2DM并发颈动脉粥样硬化的AUC为0.731、0.801,其预测敏感度分别为72.29%、78.31%,特异度分别为79.63%、87.04%;而血浆PRA、CTRP3水平联合预测T2DM并发颈动脉粥样硬化的AUC达到0.903,其预测敏感度为91.57%、特异度为92.59%。结果表明血浆PRA、CTRP3水平均能预测T2DM并发颈动脉粥样硬化的发生风险,二者联合时预测价值更高。本研究结果还发现,除了PRA、CTRP3外,收缩压、TC、HbA1c亦为T2DM并发颈动脉粥样硬化的危险因素。高收缩压、高TC水平是心脑血管疾病的高危因素,而HbA1c能够反映T2DM患者近1个月的血糖控制水平[18],在高血压、高血脂、高血糖共同作用下,动脉粥样硬化的发生风险将明显增加,动脉粥样硬化程度将明显加重。
综上所述,T2DM并发颈动脉粥样硬化患者血浆PRA水平升高、血浆CTRP3水平降低;血浆PRA、CTRP3水平是T2DM并发颈动脉粥样硬化的危险因素,并可作为其预测指标。

