miR-122抑制Sprouty2促进肾癌细胞增殖
周海, 潘凯, 陈玉明, 申余勇, 周明, 贺兴军, 费尚春, 王小祥
微小RNAs(mircoRNAs, miRNAs)是一种由21~22个核苷酸构成的非编码RNA,可以通过与靶基因3′-非编码区(untranslated region, UTR)结合影响转录后调控,从而抑制mRNA翻译或促进mRNA降解。实验证据表明miRNAs参与了多种肿瘤的发生、发展[1]。Sprouty2属于哺乳动物Sprouty信号转导蛋白家族,在细胞凋亡、增殖、迁移中发挥重要的作用[2-3]。本实验旨在研究miR-122在肾癌中的作用,并确定Sprouty2是否是miR-122的作用靶点。
1 材料和方法
1.1 材料
1.1.1 组织标本 原发性肾癌和相邻正常组织标本来自扬州大学附属医院2017年1月至2019年6月接受部分或根治性肾切除术的患者,共42例,中位年龄55岁(41~70岁)。组织标本于术后立即在液氮中冷冻,并储存在-80 ℃冰箱冻存备用。选取肿瘤组织>70%的样品用于提取总RNA。本研究方案经本院伦理委员会审核,并取得所有患者及家属书面知情同意。
1.1.2 实验材料 CAKI-1、786-0细胞系、放射免疫沉淀测定缓冲液(南京凯基生物公司),Lipofectamine 2000TM试剂、Trizol试剂(上海英俊生物公司),转染序列(上海吉玛公司),Sprouty2和 GAPDH基因序列(上海捷瑞生物),NanoDrop(Thermo Fisher Scientific公司,美国),TaqMan MicroRNA逆转录试剂盒、TaqMan MicroRNA Assay Kit及 7900HT Fast Real-Time PCR System(Applied Biosystems公司,美国),PrimerScript One-Step RT-PCR试剂盒(大连Takara公司),PVDF膜(Millipore公司,美国),抗β微管蛋白、小鼠抗Sprouty2(Abcam公司,美国),化学发光试剂盒(Thermo Fisher Scientific公司,美国),细胞计数试剂盒-8(CCK-8)(上海碧云天生物技术公司),pGL3-REPORT荧光素酶载体试剂盒(Invitrogen公司,美国),双荧光素酶测定法(Promega公司,美国)。
1.2 方法
1.2.1 细胞培养和转染 本实验使用了CAKI-1和786-0两种人类细胞系。细胞在包含有10%胎牛血清(FBS)、100 μg/ml青霉素和100 μg/ml链霉素的RPMI-1640和McCoy’s 5A培养基中,于含有5%CO2的37 ℃环境培养。在转染前1天将细胞接种在6孔板上,细胞生长密度约70%时使用LipofectamineTM2000试剂进行转染。转染6 h后,用RPMI-1640/McCoy’s 5A和FBS代替培养基。miR-122 模拟序列为:上游引物5′-UGGAGUGUGACAAUGGUGUUUG-3′;下游引物5′-AACACCAUUGUCACACUCCAUU-3′。miR-122 对照序列为:上游引物5′-UUCUCCGAACGUGUCACGUTT-3′;下游引物5′-ACGUGACACGUUCGGAGAATT-3′。miR-122 抑制剂序列为:5′-CAAACACCAUUGUCACACUCCA-3′;miR-122 抑制剂对照序列为:5′-CAGUACUUUUGUGUAGUACAA-3′。靶向作用于Sprouty2的小干扰RNA(siRNA)序列为:上游引物5′-CCCAGCAGGUACAUGUCUUTT-3′;下游引物5′-AAGACAUGUACCUGCUGGGTT-3′。
1.2.2 RT-qPCR检测 根据说明书,使用Trizol试剂从组织和细胞中提取总RNA,用NanoDrop测量RNA浓度。使用TaqMan MicroRNA Reverse Transcription Kit 反转录得到miR-122的互补DNA(cDNA),根据使用说明将总RNA(10ng)反转录成cDNA。采用TaqMan MicroRNA Assay Kit行PCR操作。内参U6探针序列为cat:4395356。使用PrimerScript One-Step RT-PCR Kit将Sprouty2 RNA反转录成cDNA。Sprouty2引物序列:正向引物 5′-ATCCAGAGACAAGACATGTAC-3′,反向引物5′-TTCAGATGTGTTCTAAGCC-3′; 而GAPDH的序列为:正向引物5′-GAAGGTGAAGGTCGGAGTC-3′,反向引物5′-GAAGATGGTGATGGGATTTC-3′。所有反应均使用7900HT Fast Real-Time PCR System进行3次。每个样本设置3个复孔,每个实验重复3次。
1.2.3 Western bolt检测 采用radioimmunoprecipitation assay buffer,加入蛋白酶抑制剂,提取细胞系和肾癌组织蛋白。应用10%十二烷基硫酸钠聚丙烯酰胺凝胶电泳分离等量的蛋白质样品并转移到PVDF膜上;然后用5%脱脂牛奶在PBST中封闭1 h。在4 ℃下与一抗anti-β-tubulin和 anti-Sprouty2孵育过夜后,用TBST洗涤3次,常温下二抗孵育2 h,检测条带。上述每个实验重复至少3次。
1.2.4 CCK-8实验测定肾癌细胞体外增殖水平 细胞以2 000个/孔接种在96孔板中。在分别转染24 h、48 h、72 h和96 h后,进行CCK-8测定。每个处理组3组样品,测量450 nm波长处吸光度来确定细胞存活率。
1.2.5 流式细胞法测定肾癌细胞体外细胞周期 转染48 h后,收集细胞,用PBS洗涤两次,并在-20 ℃下用70%乙醇固定过夜。然后常温下将细胞在50 mg/ml碘化丙啶和1 mg/ml RNA酶中孵育30 min。使用流式细胞仪分析细胞周期。每个样品至少包含20 000个细胞。上述每个实验重复至少3次。
1.2.6 荧光素酶报告实验测定Sprouty2基因表达水平 将含有miR-122结合位点的野生型Sprouty2 3′-UTR和突变型Sprouty2 3′-UTR的片段克隆至pGL3荧光素酶报告系统。构建含有Sprouty2 3′-UTR和突变型Sprouty2 3′-UTR荧光素酶报告质粒;miR-122类似物、miR-122类似物对照和miR-122抑制剂、miR-122抑制物对照共转染肾癌细胞株。转染48 h后,以内参基因作为内参照,双荧光素酶测定法测量荧光素酶活性。
1.3 统计学方法
2 结果
2.1 miR-122和Sprouty2在肾癌中的表达水平
使用RT-qPCR分析42个原发性肾癌和42个正常组织标本中miR-122的表达水平。肾癌组织中miR-122的表达水平高于正常组织,差异有统计学意义(P<0.05)(图1)。Western bolt显示Sprouty2蛋白在肾癌组织中的表达水平低于正常对照组织,差异有统计学意义(P<0.05)(图2)。MiR-122与Sprouty2在肾癌中表达水平呈负相关。

注:N代表正常组织,T代表癌组织与癌组织比较,*P<0.05

注:N代表正常组织,T代表癌组织;与癌组织比较,*P<0.05
2.2 下调miR-122对肾癌细胞增殖的影响
在786-0和CAKI-1细胞中,通过转染miR-122 抑制剂及miR-122抑制剂对照研究miR-122对细胞增殖的影响。在CCK-8实验中,miR-122表达下调96 h后肾癌细胞的体外增殖活性降低,差异有统计学意义(P<0.05)(图3A)。与阴性对照和空白组相比,miR-122抑制剂转染的CAKI-1和786-0细胞在G0/G1期的百分比升高,差异有统计学意义(P<0.05),表明下调miR-122可引起细胞停滞在G1期(图3B), miR-122在体外实验中增强了肾癌细胞的增殖能力。
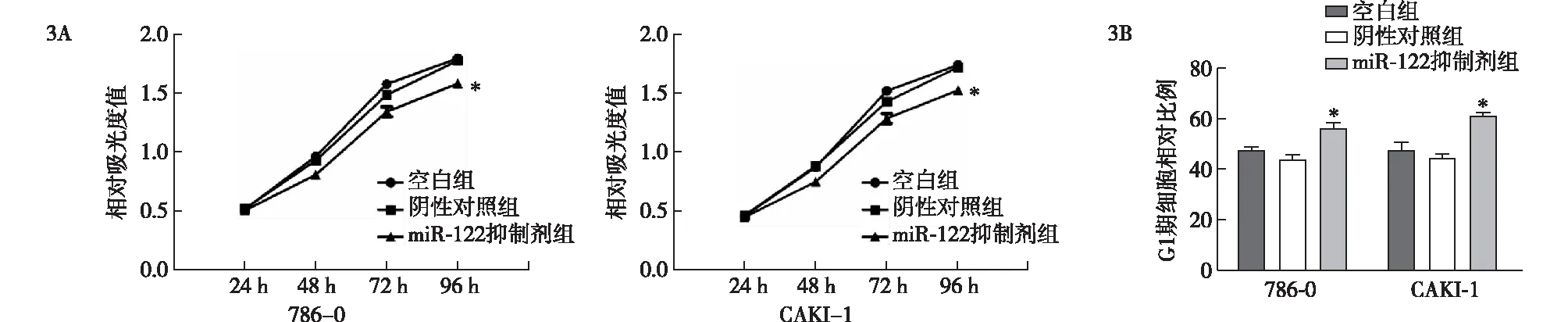
3A:786-0和CAKI-1细胞不同干预的增殖能力;3B:miR-122抑制剂转染导致786-0和CAKI-1细胞G1细胞周期停滞,与阴性对照和空白组相比,*P<0.05
2.3 miR-122抑制剂与Sprouty2表达量的关系
与阴性对照和空白组相比,用miR-122抑制剂转染的CAKI-1和786-0细胞中miR-122的表达水平降低,差异有统计学意义(P<0.05)(图4A)。3组间Sprouty2 mRNA表达,差异无统计学意义(P>0.05)(图4B),转染72 h后,转染miR-122抑制剂的细胞中Sprouty2蛋白的表达高于阴性对照组、空白组,差异有统计学意义(P<0.05)(图4C)。miR-122能下调Sprouty2蛋白的表达水平。
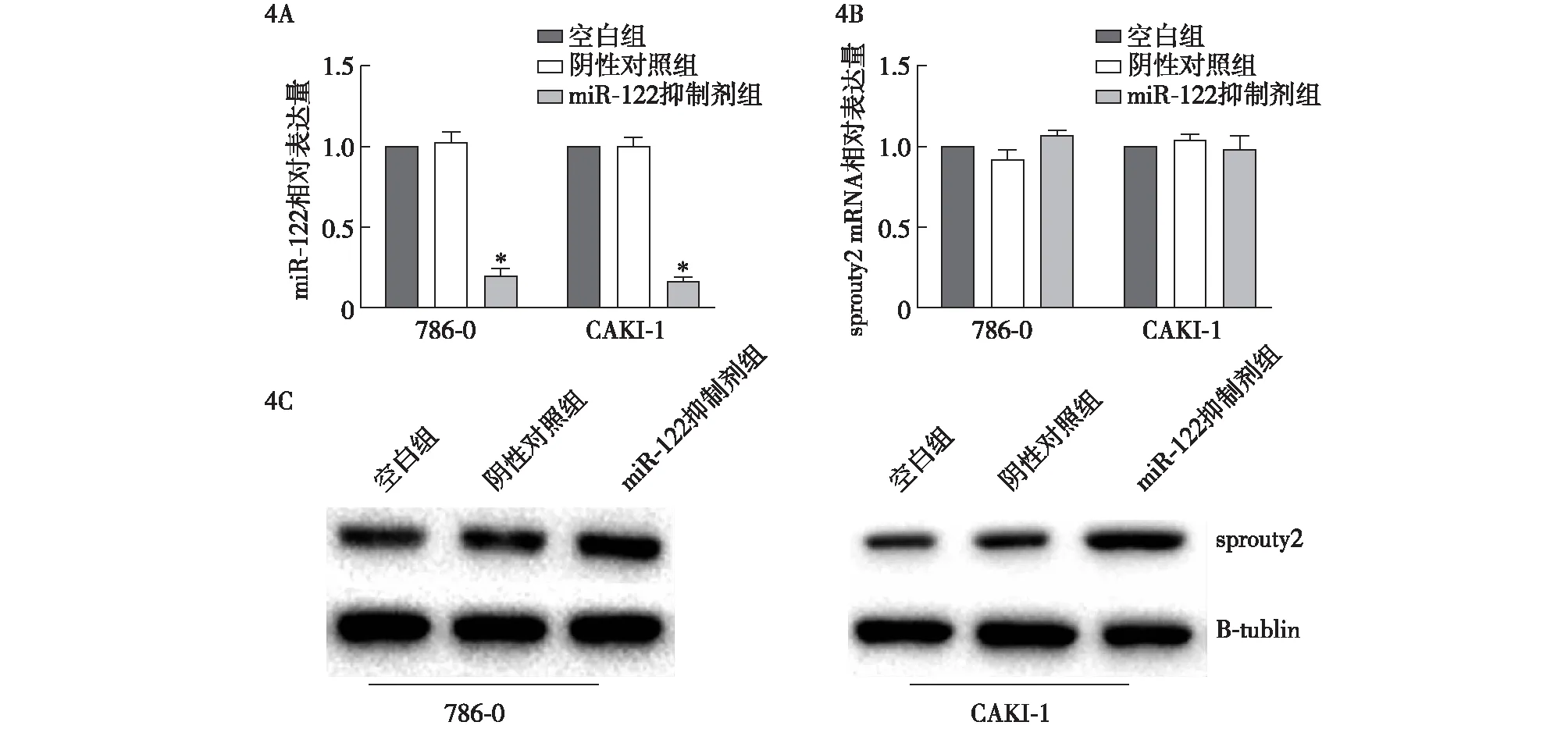
4A:miR-122抑制剂转染的CAKI-1和786-0细胞中miR-122的表达,与阴性对照和空白组相比,*P<0.05;4B:转染miR-122抑制剂对细胞Sprouty2 mRNA的影响;4C:转染miR-122抑制剂对细胞中Sprouty2蛋白表达的影响
2.4 敲低Sprouty2对肾癌细胞增殖的影响
Sprouty2蛋白和mRNA的表达量在si-Sprouty2转染的CAKI-1和786-0细胞中低于用对照组siRNA或空白组转染的细胞,差异有统计学意义(P<0.05)(图5A、5B)。在CCK-8实验中,用si-Sprouty2转染的CAKI-1和786-0细胞增殖能力相比对照组、空白组的细胞增强,差异有统计学意义(P<0.05)(图6A)。转染48 h后,用si-Sprouty2转染的CAKI-1和786-0细胞与对照和空白组细胞相比,G1期细胞百分比减少,差异有统计学意义(P<0.05)(图6B)。敲低Sprouty2增强了肾癌细胞的体外增殖能力。

5A:Sprouty2敲低对体外细胞Sprouty2 mRNA表达的影响,与阴性对照和空白组相比,*P<0.05;5B:Sprouty2敲低对体外细胞Sprouty2蛋白表达的影响

6A:Sprouty2敲低对细胞增殖的影响;6B:Sprouty2敲低对细胞G1期的影响,与阴性对照和空白组相比,*P<0.05
2.5 Sprouty2与miR-122的靶向关系
野生型Sprouty2在其3′-UTR中包含miR-122可能的结合位点(图7A)。两种细胞系中,用miR-122类似物共转染的细胞荧光素酶基因表达水平低于和用miR-122类似物对照或miR-122抑制剂对照转染的细胞荧光素酶基因表达水平;与miR-122抑制剂的共转染增强了荧光素酶基因的活性,差异有统计学意义(P<0.05)(图7B)。突变型Sprouty2在3′-UTR中亦包含miR-122可能的结合位点(图8A),但是含有突变型Sprouty2 3′-UTR的报告,基因组间相关荧光素酶基因活性,差异无统计学意义(P>0.05)(图8B)。因此,miR-122是肾癌细胞系中Sprouty2的直接靶基因。

注:与阴性对照组相比,*P<0.05;与抑制剂阴性对照组相比,*P<0.05。7A:miR-122与野生型Sprouty2 3′-UTR的潜在结合位点;7B:786-0和CAKI-1细胞株,与miR-122类似物或miR-122 抑制剂组共转染对荧光素酶基因活性的影响

注:与阴性对照组、抑制剂阴性对照组相比,P>0.05。8A:miR-122与突变型Sprouty2 3′-UTR的潜在结合位点;8B:786-0和CAKI-1细胞株,与miR-122类似物或miR-122 抑制剂组共转染对荧光素酶基因活性的影响
3 讨论
肾癌是一种常见的泌尿系肿瘤,最常见的亚型是透明细胞癌[4]。目前肾癌的发病机制尚未明确,其高危因素包括吸烟、肥胖、高血压和糖尿病等[5]。由于临床缺乏肾癌的早期诊断标志物,患者确诊时肿瘤进展、转移的比例相当高。因此,研究与肾癌发生和发展相关的分子机制可为肾癌的临床诊断、治疗提供更多依据。
miR-122由肝脏特异性产生,它参与调节肝细胞发育、分化、胆固醇代谢和应激反应,并抑制肝细胞癌发生[6]。研究表明miR-122在乳腺癌和皮肤T细胞淋巴瘤中存在异常表达[7-8]。Osanto等[9]发现miR-122在肾癌中过度表达,提示miR-122可能是肾癌的诊断标志物和潜在治疗靶点。Sprouty2通过抑制Ras/促分裂原活化蛋白激酶信号通路[10],调节细胞增殖、侵袭、迁移和细胞凋亡,参与肿瘤的发生和发展过程。目前miR-122与Sprouty2相关性仍不清楚,因此,我们期望明确miR-122在肾癌中的作用机制并进一步研究Sprouty2与miR-122的相关性,为肾癌临床早期检测和靶向治疗提供参考。
本研究中发现miR-122在肾癌组织样本中表达水平相对相邻正常组织升高,这与其他miR-122在肾癌中表达水平研究结果一致[9]。近期越来越多的证据表明[11],miR-122在肿瘤中发挥不同作用。在肝癌中,诱导miR-122表达抑制Bcl-W和/或细胞周期蛋白 CyclinG1(CCNG1)的表达,引起细胞周期阻滞和细胞凋亡[12]。此外,乳腺癌中miR-122的表达上调能靶向作用IGF1R,同时调节PI3K/AKT/Mtor/p70s6k通路来抑制肿瘤发生[13]。这些发现表明miR-122在肝癌和乳腺癌中起到抑癌作用。然而,miR-122在进展性皮肤T细胞淋巴瘤中表达升高,证明miR-122在皮肤T细胞淋巴瘤中起致癌作用[14]。我们发现下调miR-122抑制786-0和CAKI-1细胞系的增殖、侵袭和迁移,表明miR-122在肾癌细胞系中发挥致癌作用。明确参与miR-122调控的靶点可以进一步明确miR-122的作用机制。我们认为Sprouty2是miR-122的潜在靶点。首先,我们确定了Sprouty2的3′-UTR中有miR-122序列的互补结合位点。与miR-122抑制剂对照相比,miR-122抑制剂共转染的野生型荧光素酶报告基因的表达增加,但在突变型报告基因中没有这种变化。同时,miR-122的表达增加会抑制Sprouty2的野生型3′-UTR的活性,然而Sprouty2的突变型3′-UTR不受miR-122的调控。此外,miR-122抑制剂在翻译水平促进了Sprouty2的表达。因此,我们认为miR-122通过直接结合Sprouty2 3′-UTR参与调控Sprouty2的表达。
我们发现Sprouty2在肾癌组织中的表达水平低于正常组织,表明Sprouty2在肾癌中发挥抑癌作用。同时,miR-122的表达水平上调抑制Sprouty2的表达,表明miR-122可能参与调节恶性肿瘤的发生发展。由此我们推测,miR-122诱导Sprouty2表达水平降低,通过Ras/MAPK信号通路的异常激活促进癌细胞中细胞增殖或抑制癌细胞凋亡。研究表明Sprouty2在多种癌症中存在高甲基化[15-17],这可能导致其表达水平降低。但是,甲基化和miRNA都可作用于Sprouty2,导致其在肾癌中的表达下调。
综上所述,miR-122可通过抑制Sprouty2的表达,在肾癌中发挥致癌作用。miR-122是肾癌潜在的诊断和预后标志物,在未来可以针对miR-122进行靶向治疗,提高肾癌患者生存率。但是,在肾癌中是否存在其他miR-122的靶基因发挥共同作用,还需要进一步研究。

