营养监测对老年食管癌术后病人生活质量的影响
李丹凤 李辉 马晶晶 苏丹
食管癌是全球高发的恶性肿瘤,且发病率在迅速增加[1]。我国是食管癌高发地区[2],流行病学研究显示,在我国>60岁的老年人中,食管癌位居所有恶性肿瘤发病率及致死率的第4位[3]。食管癌病人多以进食困难甚至恶病质为首发症状就诊,在确诊时已经存在营养不良问题。而老年食管癌病人由于恶性肿瘤的消耗、机体各系统功能退化及自身脏器储备差等原因,营养不良的现象更为突出[4]。手术是食管癌首选治疗方式,但手术器械创伤,术前既已存在营养不良、免疫力低下,是术后感染、器官衰竭的主要原因。因此,术后对病人进行合理的营养支持十分必要。目前,营养监测在临床应用较为少见,本研究通过设计的随机对照试验探讨营养监测对食管癌病人的营养状态和生活质量的影响,报道如下。
1 资料与方法
1.1 临床资料 选择2016年1月至2019年5月辽宁省肿瘤医院胸外科收治的老年食管癌病人,病人均行根治手术治疗。纳入标准:(1)经术后病理确诊为食管癌;(2)年龄60~75岁;(3)卡氏评分≥70分;(4)预计生存期>3个月。排除标准:(1)合并脑水肿、颅内高压等脑血管病变;(2)严重器质性心肺疾病;(3)消化道出血、严重感染、其他部位恶性肿瘤;(4)妊娠期、经期妇女;(5)恶病质,多脏器功能衰竭者;(6)严重肝肾功能障碍。依据以上筛选标准共纳入96例病人,按随机数字表将病人分为2组。观察组48例,男26例,女22例;年龄60~74岁,平均(65.25±8.21)岁;病理类型:鳞癌17例,腺癌15例,腺鳞癌16例;肿瘤部位:颈段12例,胸上段12段,胸中段10例,胸下段14例;TNM分期:Ⅲ期19例,Ⅳ期17例,N0 12例。对照组48例,男27例,女21例;年龄61~72岁,平均(64.67±7.51)岁;病理类型:鳞癌18例,腺癌17例,腺鳞癌13例;肿瘤部位:颈段11例,胸上段15段,胸中段12例,胸下段10例;TNM分期:Ⅲ期21例,Ⅳ期15例,N0 12例。2组病人年龄、性别、病理分型、肿瘤部位、TNM分期差异均无统计学意义(P>0.05),本研究获得我院伦理委员会批准,研究期间严格遵循伦理学原则。
1.2 方法
1.2.1 对照组:术后给予肠内或肠外营养支持。具体方法如下:肠内营养剂为肠内营养混悬液,通过留置鼻胃管或空肠管使用一次性流量设定微调式输液器控速输液器输入,速度从20 mL/h起逐渐增加至80~100 mL/h,每4 h暂停输入0.5~1 h,定期测量胃残留量,评估肠道耐受情况。若残留量≤100 mL且无反流、腹泻、腹胀等不良反应,可调整营养支持量,逐渐增加至80~100 mL/h,1000~1500 mL/d;若残留量>100 mL则给予多潘立酮片管饲,管道护理由专业护师进行。
1.2.2 观察组:在对照组基础上采用精细营养监测调整营养支持方案。内容如下:由经过训练的专业营养膳食调查人员采用营养风险筛查量表[5]对病人的营养状况进行评估,制定营养支持方案,每3 d评估1次病人的营养状态,根据评估结果调整营养支持方案。具体评估方式为:营养风险筛查量表总分值≥3分(或胸水、腹水、水肿且血清蛋白<35 g/L)则病人处于营养不良或有营养风险,需要营养支持,结合临床营养指标检测[如测定血液中营养成分含量、血清白蛋白(albumin,ALB)、Hb等]结果制定个体化营养治疗计划;总分值<3分,则维持原有营养支持方案,并每3 d复查营养风险筛查,若复查的结果≥3分,则结合临床营养指标检测结果制定个体化营养治疗计划。
具体营养支持方案为:肠内营养不足部分由肠外营养补充,直至完全满足肠内营养时停止肠外营养支持。肠外营养支持:经中心静脉置管输注营养液,肠外营养液由50%葡萄糖注射液、复方氨基酸注射液18AA-Ⅱ、中/长链脂肪乳注射液、脂溶性维生素、水溶性维生素、氯化钾等电解质及微量元素配制而成,总量700~1500 mL,速度50~80 mL/h。营养补给充足的病人维持原有营养支持方案。
1.3 观察指标 (1)院内期间,观察2组病人术后住院时间、并发症发生情况。(2)分别于营养治疗前、后采用强生VITROS 5600全自动生化分析仪检测ALB、血清前白蛋白(prealbumin,PA),希森美康21-1全自动血细胞分析仪检测Hb,罗氏E201特种蛋白分析仪及其配套试剂检测转铁蛋白(transferrin,TRF),国际标准卷尺测量上臂三头肌肌围(arm muscle circumfer,AMC)。(3)采用健康状况调查简表(SF-36)[6]评估病人生活质量,该量表从生理机能、生理职能、躯体疼痛、一般健康状况、精力、社会功能、情感职能、精神健康8个维度共36个条目进行评价,总评分越高表示生活质量越高。
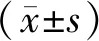
2 结果
2.1 2组术后住院时间及并发症发生率比较 观察组的术后住院时间明显短于对照组,并发症发生率明显低于对照组,差异均有统计学意义(P<0.05),见表1。
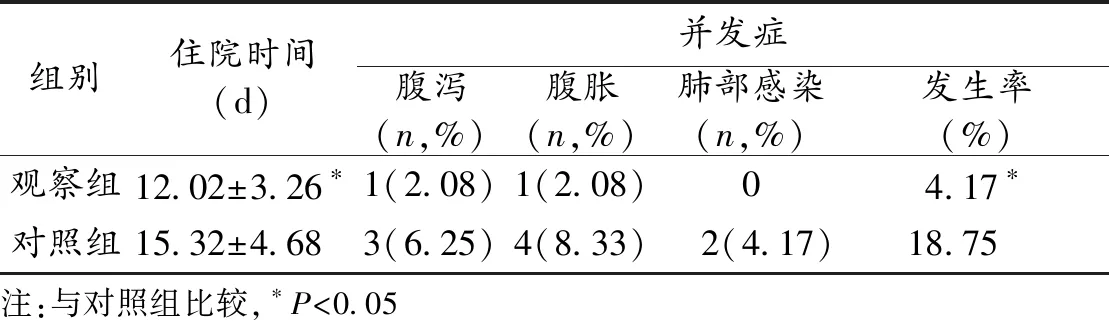
表1 2组术后住院时间及并发症发生率比较(n=48)
2.2 2组干预前后营养指标水平比较 干预前,2组ALB、PA、Hb、TRF、AMC水平差异均无统计学意义(P>0.05)。干预后,观察组的ALB、PA、Hb、TRF、AMC水平均高于术前及对照组,差异有统计学意义(均P<0.05),对照组的ALB、PA、Hb、TRF、AMC水平较干预前无明显变化,差异均无统计学意义(P>0.05)。见表2。
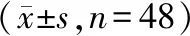
表2 2组干预前后营养指标水平变化
2.3 2组生活质量比较 干预前,2组病人SF-36各维度评分比较,差异均无统计学意义(P>0.05)。干预后,2组SF-36各维度评分均较干预前有所增高(P<0.05),且观察组SF-36各维度评分均高于对照组,差异有统计学意义(P<0.05)。见表3。
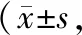
表3 2组干预前后SF-36评分比较分,n=48)
3 讨论
食管癌病人营养不良发病率位居恶性肿瘤首位,约60%~85%,这一比例在老年病人中更高。食管癌围手术期营养不良可降低机体免疫功能,导致急性炎症损伤,增加术后并发症发生率和死亡率[7-8]。老年食管癌病人由于身体机能较差,常合并多种慢性疾病,同时机体多脏器功能减退,摄食能力下降,加之行根治手术重建上消化道,病人术后适应新消化道需要一定时间,大大影响了饮食和营养状态;手术创伤应激一方面导致食管的炎性改变,另一方面增加体内营养物质消耗;此外,病人长期进食困难,导致消化道功能障碍,营养物质摄入不足,流失过多,因此术后营养不良风险明显增加[9-10]。
营养监测是在营养评估基础上发起的营养管理指导方案。实时营养监测可动态评估个体营养风险,补充营养不足,纠正营养过剩,预防营养干预引起的并发症,最大程度保证营养支持的顺利进展,达到完美的营养补给[11]。传统肠内营养支持方案无法满足老年食管癌病人术后营养需求,相关报道显示,早期完全肠内营养病人耐受率较低,仅有15%~19%[12]。因此,单独肠内营养支持可导致营养物质不能得到较好吸收,进而出现能量与蛋白质摄入不足问题,出现低蛋白血症,降低免疫系统功能。本研究中对照组病人术后采用经鼻胃管或空肠管肠内营养支持,干预后ALB、PA、Hb、TRF、AMC水平无明显变化,说明单独肠内营养支持仅可以遏制体内营养物质的流失,但对于老年食管癌病人无法维持正常的营养需求。肠外营养支持是经静脉补充营养物质,能保证能量和营养物质供给。但是如果仅仅依赖肠外营养支持,胃肠道处于废用状态,蠕动减慢,导致腹胀;其次缺乏食物刺激,肠黏膜上皮组织逐渐萎缩,肠黏膜通透性增加,屏障功能逐渐减退,进而诱发菌群移位和紊乱,发生肠源性感染,该现象在老年病人中更为突出[13]。每周营养监测可发现营养供给的不足之处,及时调整营养支持方案。本研究中观察组病人在营养监测下采用肠内联合肠外营养支持干预,其ALB、PA、Hb、TRF、AMC水平得到明显改善,且上述指标均高于对照组,说明营养监测下营养支持可更好地纠正老年食管癌病人术后营养状态,避免营养不良的风险。营养监测下肠内外联合营养支持方案整合了肠内、肠外营养支持的优点,既可以保护胃肠道功能,提高胃肠道免疫功能,又可以保证足够的机体营养供给,最大程度降低病人营养不良风险,改善营养状态[14-15]。
本研究观察组病人干预后SF-36评分显著高于对照组,提示营养监测下的营养支持可提高食管癌病人术后生活质量。原因可能是:首先,营养监测可发现营养不良风险,并针对老年病人的机体情况,制定合理的营养支持方案,最大程度降低营养不良,减少营养物质的过度消耗;其次,营养监测保证病人充足的营养供给,提高病人免疫力,减少术后并发症风险,并促使伤口愈合,加速术后康复进程[16];第三,术后早期肠内营养支持可加快肠蠕动,促使肠道功能恢复,联合肠外营养形成优势互补,更好地改善病人营养状态,提高病人生活质量[17]。本研究观察组病人术后住院时间较对照组短,并发症发生率低于对照组,提示营养监测可更好地保证食管癌病人术后营养平衡,促使病人康复,降低并发症风险。
综上所述,营养监测指导下的营养支持干预可更好地改善老年食管癌病人术后营养状态,提高其生活质量,适合在老年食管癌术后营养管理中推广。

