富马酸丙酚替诺福韦与阿德福韦酯治疗慢性乙型肝炎患者的临床效果比较
张晓强 余建平 盛吉芳



[摘要] 目的 探討富马酸丙酚替诺福韦(TAF)与阿德福韦酯(ADV)治疗慢性乙型肝炎(CHB)患者的临床效果。 方法 分层抽样法选取杭州市余杭区第一人民医院感染科2019年3—10月的CHB患者,总共128例。治疗前,采用摸球法随机分为两组,每组各64例。研究组给予TAF治疗(TAF组),对照组给予ADV治疗(ADV组)。治疗结束后,比较两组HBV载量、Child-Pugh评分、肝功能指标、肝纤维化、临床疗效指标。 结果 治疗后,TAF组HBV载量指标为(1.48±0.49)copies/mL,明显低于ADV组的(2.69±0.68)copies/mL,差异有统计学意义(P<0.05);TAF组Child-Pugh分级评分为(5.25±0.69)分,明显低于ADV组的(6.31±1.25)分,差异有统计学意义(P<0.05);TAF组的血清丙氨酸氨基转移酶(ALT)、谷草转氨酶(AST)、总胆红素(TBiL)、碱性磷酸酶(ALP)明显低于ADV组,差异有统计学意义(P<0.05);在评价肝纤维化指标中,TAF组层粘连蛋白(LN)、透明质酸酶(HA)、Ⅲ型前胶原(PCⅢ)、Ⅳ型胶原(Ⅳ-C)较ADV组明显降低,差异有统计学意义(P<0.05);TAF组总有效率为95.31%,明显高于ADV组的79.69%,差异有统计学意义(P<0.05)。 结论 对于慢性乙型肝炎患者,TAF较ADV治疗可明显改善HBV载量、Child-Pugh评分、肝功能,减轻肝纤维化,增加疗效。
[关键词] 慢性乙型肝炎;富马酸丙酚替诺福韦;阿德福韦酯;HBV载量;Child-Pugh评分;肝功能;肝纤维化
[中图分类号] R512.62 [文献标识码] A [文章编号] 1673-9701(2021)32-0030-04
[Abstract] Objective To investigate the clinical effects of tenofovir alafenamide fumarate (TAF) and adefovir dipivoxil (ADV) on patients with chronic hepatitis B (CHB). Methods A total of 128 patients with CHB in the Department of Infectious Diseases of First People's Hospital of Yuhang District in Hangzhou from March to October 2019 were selected using a stratified sampling method. Before treatment, they were randomly divided into two groups, with 64 cases in each group. The study group was given TAF treatment (TAF group), and the control group was given ADV treatment (ADV group). After the treatment, the HBV load, Child-Pugh score, liver function indexes, liver fibrosis, and clinical efficacy indexes were compared between the two groups. Results After treatment, the HBV load index of the TAF group was(1.48±0.49) copies/mL,which was significantly lower than that of (2.69±0.68) copies/mL in the ADV group, and the difference between the two groups was statistically significant(P<0.05). The Child-Pugh grading score of the TAF group was(5.25±0.69),which was significantly lower than that of (6.31±1.25) in the ADV group, and the difference between the two groups was statistically significant (P<0.05). The serum alanine aminoeransferase (ALT), aspartate aminotransferase (AST), total bilirrbin (TBIL), and alkaline phosphatase(ALP) of the TAF group were significantly lower than those in the ADV group, and the difference between the two groups was statistically significant(P<0.05). In the evaluation of liver fibrosis indicators, the laminin (LN), hyaluronidase (HA), Procollagen type Ⅲ (PCⅢ) and type Ⅳ collagen (Ⅳ-C) in the TAF group were significantly lower than those in the ADV group, and the differences between the two groups were statistically significant(P<0.05). The total effective rate in the TAF group was 95.31%, which was higher than that of 79.69% in the ADV group. The difference between the two groups was statistically significant(P<0.05). Conclusion For patients with chronic hepatitis B, TAF can significantly improve HBV load, Child-Pugh score, liver function, reduce liver fibrosis, and increase efficacy compared with ADV treatment.
[Key words] Chronic hepatitis B; Tenofovir alafenamide fumarate; Adefovir dipivoxil; HBV load; Child-Pugh score; Liver function; Liver fibrosis
慢性乙型肝炎(Chronic hepatitis B,CHB)是一种常见慢性肝脏炎症性疾病,主要由乙型肝炎病毒(Hepatitis B virus,HBV)感染所致[1-2]。慢性乙型肝炎若不及时干预易导致肝纤维化,引发肝硬化,甚至发展为肝细胞癌[3-4]。目前认为,CHB发病主要原因为HBV大量复制,治疗上需根除病毒或长期、稳定地抑制病毒复制。既往临床多采用干扰素[5],近年来,常用阿德福韦酯(Defovir dipivoxil,ADV)、富马酸丙酚替诺福韦(Tenofovir alafenamide Fumarate,TAF)等核苷酸类似物。ADV长时间应用可出现肾损害,影响血磷、血钙的代谢,易产生耐药性,而TAF可长期、稳定抑制HBV复制,抗病毒活性更强,病毒耐药率更低[6-7]。本研究选取184例CHB患者,分析比较TAF与ADV治疗的差异,重点探讨对HBV载量、Child-Pugh评分、肝功能及肝纤维化的影响,现报道如下。
1 资料与方法
1.1 一般資料
分层抽样法选取杭州市余杭区第一人民医院感染科2019年3—10月的128例CHB患者。纳入标准[8]:①符合《慢性乙型肝炎防治指南》中CHB诊断标准[血清乙肝表面抗原(HBsAg)和(或)HBV-DNA阳性];②意识清楚;③签署知情同意书。排除标准[7]:①对所用药物过敏者;②合并血液系统疾病、免疫系统疾病或恶性肿瘤者;③近1个月内接受过其他抗病毒药物治疗者;④妊娠、哺乳期妇女。128例患者采用摸球法随机分为两组,每组各64例。本研究符合并通过杭州市余杭区第一人民医院医学伦理委员会审批标准。
1.2 方法
两组均给予常规处理,包括保肝治疗、对症支持、指导合理饮食等。TAF组给予富马酸丙酚替诺福韦片(TAF)(生产厂家:Patheon Inc,规格:25 mg×30片,国药准字H20180060)口服,25 mg/次,1次/d,建议随餐服用,持续治疗48周;ADV组则给予阿德福韦酯(ADV)[生产厂家:葛兰素史克(天津)有限公司,规格:10 mg×14粒,国药准字H20050651]口服,10 mg/次,1次/d,持续治疗48周。
1.3 观察指标及评价标准
本研究采集CHB患者HBV载量、Child-Pugh评分、肝功能、肝纤维化和临床疗效治疗前后的指标。①采用实时荧光定量PCR方法检测TAF组和ADV组的HBV载量;②采用Child-Pugh分级评分量表,评估CHB患者的肝性脑病、腹水、总胆红素、血清白蛋白浓度、凝血酶原时间延长,总共5项指标的情况,各项采用1~3级评分,总分范围5~15分,得分越高则肝脏储备功能越差[9];③采用日本Hitach公司7600-020日立全自动生化分析仪检测两组治疗前后血清丙氨酸氨基转移酶(Alanine aminoeransferase,ALT)、谷草转氨酶(Aspartate aminotransferase,AST)、总胆红素(Total bilirrbin,TBiL)、碱性磷酸酶(Alkaline phosphatase,ALP)的变化情况。在评价肝纤维化指标方面,采用美国雅培Architect i2000SR型全自动免疫分析仪检测两组层粘连蛋白(Laminin,LN)、透明质酸酶(Hyalero-nidase,HA)、Ⅲ型前胶原(Procollagen type Ⅲ,PCⅢ)、Ⅳ型胶原(Type Ⅳ collagen,Ⅳ-C)。在临床疗效判定中,依据文献[10]拟定疗效标准:显著改善:治疗后HBV-DNA、HBsAg转阴,ALP≤40 IU/L;好转:治疗后HBV-DNA转阴,HBsAg阳性,ALP≤40 IU/L;无效:治疗后HBV-DNA、HBsAg均为阳性。总有效率=(显著改善+好转)例数/总例数×100%。
1.4 统计学方法
采用SPSS 20.0统计学软件对数据进行分析。计量资料以均数±标准差(x±s)表示,采用t检验。计数资料以[n(%)]表示,采用χ2检验。P<0.05为差异有统计学意义。
2 结果
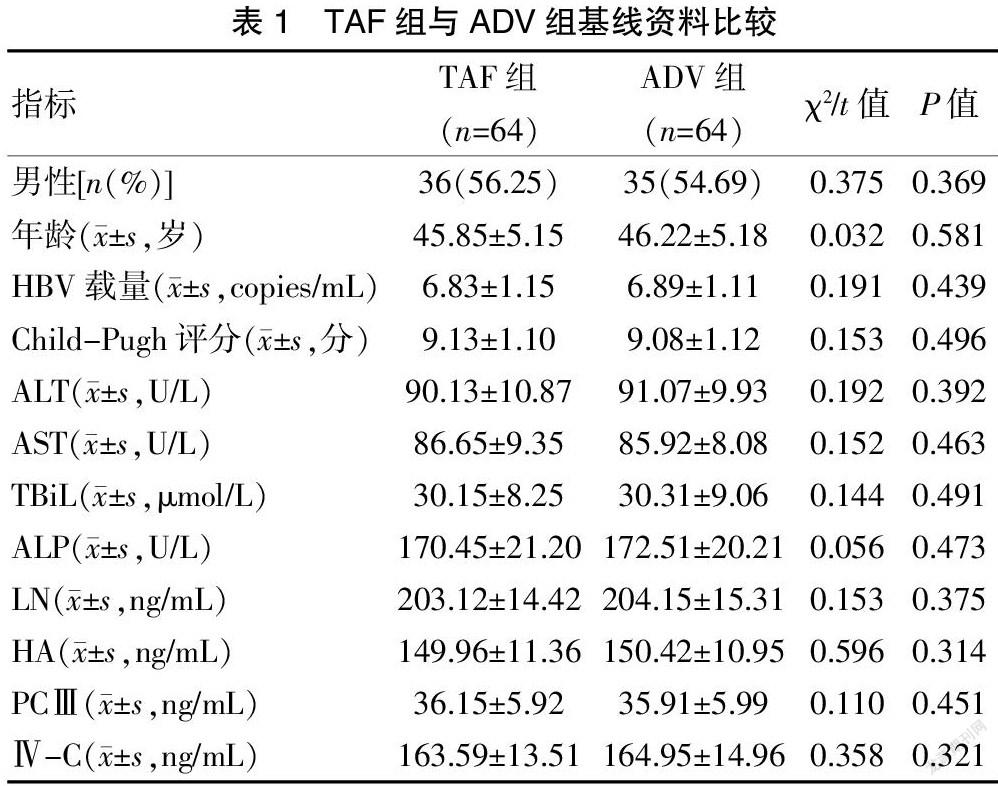
2.1 TAF组与ADV组基线资料比较
治疗前,TAF组与ADV组在性别、年龄、HBV载量、Child-Pugh评分、肝功能以及肝纤维化指标方面比较,差异无统计学意义(P>0.05),具有可比性。见表1。
2.2 TAF组与ADV组治疗后HBV载量、Child-Pugh评分、肝功能比较
治疗后,TAF组HBV载量指标为(1.48±0.49)copies/mL,明显低于ADV组的(2.69±0.68)copies/mL,差异有统计学意义(P<0.05);TAF组Child-Pugh分级评分为(5.25±0.69)分,明显低于(6.31±1.25)分,差异有统计学意义(P<0.05);在评价肝功能指标中,TAF组的ALT、AST、TBiL、ALP较ADV组均明显降低(P<0.05)。见表2。
2.3 TAF组与ADV组治疗后肝纤维化指标的比较
治疗后,在肝纤维化指标中,TAF组的LN、HA、PCⅢ、Ⅳ-C明显低于ADV组,差异有统计学意义(P<0.05)。见表3。
2.4 TAF组与ADV组治疗后临床疗效的比较
TAF组总有效率为95.31%,明显高于 ADV组的79.69%,差异有统计学意义(P<0.05)。见表4。
3 讨论
目前,CHB为严重威胁人们生命健康的重要病因之一,我国具有较高患病率[11-12]。肝纤维化是CHB向肝硬化进展的关键环节,CHB患者肝功能受损,肝脏分泌大量细胞因子,且HBV感染引起肝脏持续炎症浸润,从而导致肝星状细胞纤维化[13-14];研究发现,肝纤维化也具有一定可逆性,核苷酸类似物能对HBV复制进行根除或长期抑制,逆转或延缓CHB患者肝纖维化进程,从而降低肝硬化发生风险[15]。目前,在临床中CHB抗病毒治疗药物的选择仍存在争议,既往临床上多采用ADV治疗,虽具有一定抗病毒作用,但属于低耐药屏障药物,长时间应用会导致耐药风险提升[16]。
TAF是一种新型核苷酸类似物,可明显改善肝脏组织学,逆转肝纤维化,对肾、骨骼几乎没有损伤,安全可靠。除此之外,TAF具有水溶性特点,经口服给药后可快速吸收,降解为活性物质替诺福韦,并进一步被细胞激酶磷酸化,生成二磷酸替诺福韦,阻断病毒DNA延长,从而长期、稳定地抑制病毒复制[17]。相较于其他药物,TAF具有较高的抗病毒活性,适应范围广,且可用于妊娠期,因此逐渐为学术界广泛认可[18]。本研究结果显示,TAF组较ADV组治疗后的HBV载量明显较低,提示在治疗中应用TAF可显著降低乙肝病毒载量。其可能的原因在于:与ADV相比,TAF为替诺福韦的亚磷酰胺药物前体(2'-脱氧腺苷-磷酸类似物),属于核苷酸逆转录酶抑制剂,通过干扰乙肝病毒DNA聚合酶的功能,抑制乙肝病毒复制,使血清及肝组织内的病毒载量降低,在体内可表现出强大的抗HBV活性。另外,TAF组治疗后肝功能指标(ALT、AST、TBiL及ALP)及Child-Pugh评分分级改善效果较ADV组更为理想,与潘家超等[19]结果相符,说明CHB治疗中采用TAF较ADV治疗更利于改善肝功能。这可能与两种药物的耐药机制有关:ADV为低耐药屏障药物,长时间应用可能引发耐药性,且起效慢,影响肝功能恢复,而TAF具有较强抗病毒活性及耐药屏障,且可稳定细胞膜和保护肝脏细胞,促进肝功能恢复。本研究还发现,TAF组治疗后肝纤维化指标(LN、HA、PCⅢ、Ⅳ-C)均明显低于ADV组,提示CHB患者治疗中应用TAF还可减轻肝纤维化,考虑可能与TAF可更好抑制病毒复制有关,利于减轻肝组织炎症及肝纤维化。在临床疗效评价中,TAF组总有效率明显高于ADV组,说明CHB患者治疗中应用TAF效果确切,临床价值较高。此外,一项为期5年的随访研究发现[20],对于慢性乙肝病毒感染患者,长期(至少5年)应用富马酸丙酚替诺福韦治疗安全有效,其长期、稳定病毒抑制可以逆转肝纤维化和肝硬化。朱浩翔等[21]的研究认为,替诺福韦为其前体药物TAF(9-[(R)-2-(磷酸甲氧基)-丙基]腺嘌呤,PMPA)的形式给药,是可磷酸化为PMPApp的核苷酸。PMPApp若整合入DNA链后可终止DNA链,是天然脱氧腺苷5'-三磷酸盐的竞争性抑制剂,经口服给药后,TAF通过血浆酯酶转换为替诺福韦,通过肾小球滤过和肾小管主动分泌的形式清除;疗效研究显示,HBV DNA转阴率、HBsAg转阴率均高于阿德福韦(ADV);在耐药性的研究中发现,Ⅲ期临床试验结果显示,TAF治疗5年后并未出现明确的TAF耐药。ADV治疗期间病毒抑制不理想且无明确耐药者亦可换用TAF,但若肯定存在ADV耐药,TAF并不是最佳的挽救疗法。在安全性的研究中,TAF是妊娠B级药物,HIV和HBV合并感染的孕妇予TAF治疗后,婴儿并未出现出生缺陷;TAF对肝脏具有更高的靶向性,推荐用量为25 mg/d,剂量更小,改善了长期用药对肾损伤和骨密度的影响,定期监测血清肌酐和血电解质,发现不良反应,及时调整药物剂量及补充电解质。
综上所述,在慢性乙型肝炎(CHB)患者治疗中,应用富马酸丙酚替诺福韦(TAF)可获得较为理想效果,且能改善肝功能,降低HBV载量,减轻肝纤维化,值得临床进行深入研究。
[参考文献]
[1] Maini MK,Burton AR. Restoring,releasing or replacing adaptive immunity in chronic hepatitis B[J]. Nature Reviews Gastroenterology & Hepatology,2019,16(11):662-675.
[2] Wei L,Kao JH. Benefits of long-term therapy with nucleos(t)ide analogues in treatment-na?觙ve patients with chronic hepatitis B[J]. Curr Med Res Opin,2017,33(3):495-504.
[3] Liu H,Hou J,Zhang X. Targeting cIAPs,A new option for functional cure of chronic hepatitis B infection?[J]. Virol Sin,2018,33(5):459-461.
[4] 田贤江,赵立夫,沈跃飞,等. 恩替卡韦治疗HBV DNA低水平HBeAg阳性慢性乙型肝炎可抑制病毒复制及改善肝组织学病变[J]. 中华临床感染病杂志,2019,12(2):107-110.
[5] 梁超,段卫星,李卫强. INFα-2b联合恩替卡韦对慢性乙型肝炎患者病毒载量、外周血中Th1/Th2型细胞因子与肝功能的改善效果[J]. 中国老年学杂志,2018,38(21):5210-5213.
[6] 阴敏,唐亮,姜百灵. 富马酸丙酚替诺福韦治疗HBV感染孕妇的疗效及垂直传播阻断效果[J]. 中华医院感染学杂志,2019,29(23):3632-3636.
[7] 张永萍. 富马酸丙酚替诺福韦对乙型肝炎病毒表面抗原定量的影响[J]. 中西医结合肝病杂志,2019,29(4):332-333,385.
[8] 陆荫英,李晶. 《慢性乙型肝炎防治指南(2015年版)》解读之:HBV感染相关HCC的随访监测[J]. 中国肝脏病杂志(电子版),2015,7(3):36-39.
[9] Sy BT,Hoan NX,Tong HV,et al. Genetic variants of interferon regulatory factor 5 associated with chronic hepatitis B infection[J]. World J Gastroenterol,2018,24(2):248-256.
[10] 吳小洁. 加味膈下逐瘀汤联合恩替卡韦片对治疗瘀血阻络型慢性乙肝临床研究[J]. 世界中西医结合杂志,2017, 12(11):1594-1596.
[11] Lok AS,Zoulim F,Dusheiko G,et al. Hepatitis B cure:From discovery to regulatory approval[J]. J Hepatol,2017, 67(4):847-861.
[12] Lazarus JV,Block T,Bréchot C,et al. The hepatitis B epidemic and the urgent need for cure preparedness[J]. Nature Reviews Gastroenterology & Hepatology,2018,15(9):517-518.
[13] 张学伟,石炜,殷晓飞,等. 胸腺肽注射液联合恩替卡韦治疗对肝硬化代偿期患者病毒负荷、肝纤维化、免疫应答的影响[J]. 海南医学院学报,2017,23(20):2779-2782.
[14] 李哲成,陈朝霞,吴昭颐,等. 聚乙二醇干扰素α-2a联合恩替卡韦对慢性乙型肝炎病人肝功能及肝纤维化的影响[J]. 安徽医药,2017,21(8):1490-1493.
[15] 胡锡坤. 舒肝益脾胶囊联合恩替卡韦治疗乙型肝炎肝硬化的临床研究[J]. 现代药物与临床,2019,34(9):2765-2768.
[16] 张颖慧,李良平,张笛,等. 拉米夫定与阿德福韦酯初始联合与单药优化治疗代偿期乙型肝炎肝硬化的疗效比较[J]. 重庆医学,2017,46(29):4077-4080.
[17] 王永广,许盼成,张俊. 替诺福韦艾拉酚胺与富马酸替诺福韦二吡呋酯对非初治艾滋病患者长期安全性和有效性影响的Meta分析和系统评价[J]. 预防医学情报杂志,2019,35(12):1329-1340.
[18] 张伟伟, 赵永芳. 富马酸替诺福韦二吡呋酯片联合聚乙二醇化干扰素治疗慢性乙型肝炎疗效观察[J]. 医学临床研究,2019,36(8):1614-1615.
[19] 潘家超,王蒙,杨洋,等. 替诺福韦酯与阿德福韦酯治疗HBeAg阳性慢性乙型肝炎的临床对比[J]. 中华传染病杂志,2017,35(6):372-373.
[20] Marcellin P,Gane E,Buti M,et al. Regression of cirrhosis during treatment with tenofovir disoproxil fumarate for chronic hepatitis B:A 5-year open-label follow-up study[J]. Lancet,2013,381(9865):468-475.
[21] 朱浩翔,张继明. 抗HBV药物——替诺福韦[J]. 肝脏,2011,16(2):145-147.
(收稿日期:2020-12-16)

