南瓜色素的分离制备及其抗氧化作用
钱颖聪,胡 炜,陈天鉴,阮依莉,林艺涵,张拥军
(中国计量大学 生命科学学院,浙江 杭州 310018)
南瓜色素是从葫芦科南瓜属南瓜(Cucurbita moschata(Duch.ex Lam.)Duch.ex Poiret)果肉得到的黄色天然食品级色素,是一种少有的着色力强的理想天然色素,稳定性好且具有抗氧化作用,可在多种领域中得到应用[1,2]。南瓜色素主要由α-胡萝卜素,β-胡萝卜素和叶黄素这三类类胡萝卜素构成,这是使南瓜果肉呈现强烈的黄色或橙色的原因[3],其中按照Bartosz Kulczynski 等对于南瓜色素的分析可知,每100 g鲜南中β-胡萝卜素1.29~8.33 mg,叶黄素3.34~22.92 mg[4]。可知叶黄素占大多数。叶黄素因含有羟基、羰基、甲氧基或环氧化结构而极性较强,故在极性较强的有机溶剂中溶解性较大。黄爱妮等研究发现,无水乙醇、丙酮、乙酸乙酯与乙醚都可以作为南瓜色素的提取剂,其中无水乙醇提取率最大[5]。目前已有关于南瓜果肉色素提取、稳定性方面的研究报道[6-10],在南瓜色素分离纯化及抗氧化性方面的研究也逐渐开展[11-13]。但现有研究大多停留在南瓜色素提取制备等方面,关于其纯化、结构及定量分析方法等方面的研究鲜有报道;关于其抗氧化的研究也只涉及体外试管比色实验,鲜有生物体内抗氧化方面的研究。基于此,本实验首先通过比色法和高效液相色谱法建立了南瓜色素的定量测定方法,采用乙醇作为提取液,进而采用Box-Behnken Design(BBD)的试验设计方法对超声辅助提取南瓜色素的工艺条件进行优化,利用大孔吸附树脂对制备的南瓜色素进行纯化,并对纯化后南瓜色素在秀丽隐杆线虫(Caenorhabditis elegans)模式生物体内的抗氧化作用进行了研究,以期为南瓜色素的开发利用提供参考。
1 材料与方法
1.1 原料与试剂
南瓜采用黄狼南瓜购于杭州下沙物美超市,无病虫害和腐烂,洗净后去皮、籽、瓤并切丝,置65 ℃烘箱中烘干后粉碎,过60目筛备用;甲醇与乙腈为色谱纯,购于杭州米克化工仪器有限公司;二甲基亚砜(DMSO)等化学试剂均为分析纯,购于杭州米克化工仪器有限公司;大孔吸附树脂(AB-8、D-101、DA-201、DM-301)购于东鸿化工有限公司;野生型秀丽隐杆线虫(N2),大肠杆菌E.coliOP50,由浙江大学动物科学学院惠赠;BCA蛋白定量测定试剂盒,超氧化物歧化酶(SOD)试剂盒,丙二醛(MDA)测试盒,所有试剂盒购于南京建成科技有限公司。
1.2 实验方法
1.2.1 南瓜色素定量分析方法的建立
采用超声辅助醇提的方法制备南瓜色素,用95%的乙醇溶液洗脱至无色,用DA-201树脂纯化后,在300~800 nm范围内进行光谱扫描获得最大吸收峰。参考周业丰等的方法[14]略做修改,即纯化后色素,用无水乙醇配置成不同浓度的稀释液,测定南瓜色素在可见区(446 nm)具有最大吸收,在446 nm处检测不同浓度南瓜色素的吸光度,绘制浓度-吸光度关系曲线,线性回归方程为:y=0.132 9x-0.009 2,R=0.994 1。南瓜色素浓度与吸光度之间存在较好的线性关系。
1.2.2 南瓜色素提取工艺单因素试验
1.2.2.1 浸提剂浓度优化
配置浓度分别为50%、60%、70%、80%、90%、100%的乙醇溶液,在料液比1∶10,超声30 min,温度50 ℃,水浴震荡40 min条件下提取。
1.2.2.2 浸提时间的优化
将水浴震荡时间分别设置为10、20、30、40、50、60 min,在乙醇浓度100%,料液比1∶10,超声30 min,温度50 ℃条件下提取。
1.2.2.3 浸提料液比的优化
分别按照料液比1∶5、1∶10、1∶15、1∶20、1∶25、1∶30、1∶35、1∶40(g/mL)加入无水乙醇,在超声30 min,温度50 ℃,水浴震荡40 min条件下提取。
1.2.2.4 浸提温度的优化
将浸提温度分别设置为20、30、40、50、60、70 ℃,在乙醇浓度100%,料液比1∶10,超声30 min,水浴震荡40 min条件下提取。
1.2.2.5 超声辅助时间的优化
将超声波辅助时间分别设置为10、20、30、40、50、60 min,在乙醇浓度100%,料液比1∶10,温度50 ℃,水浴震荡40 min条件下提取。
1.2.3 响应面优化提取条件
根据单因素试验的结果,确定影响南瓜色素得率最显著的3 个因素,以南瓜色素得率为响应值,采用Box-Behnken Design(BBD)的试验设计优化南瓜色素的提取工艺条件。
1.2.4 大孔树脂型号的选择
称取活化后大孔树脂AB-8、D-101、DA-201与DM-301,加入南瓜色素提取液,置于恒温水浴振荡器中进行振荡吸附,测定最佳波长下吸光度,计算吸附率;将吸附平衡的大孔树脂抽滤,加入无水乙醇进行水浴振荡解吸,测定最佳波长下吸光度,计算解吸率。吸附率与解吸率计算公式参考努尔比亚·亚力坤的等的方法[15]。计算公式为:
(1)吸附率%=(初始吸光值-吸附后吸光值)/初始吸光值×100%
(2)解析率%=解吸后吸光值/(初始吸光值-吸附后吸光值)×100%。
1.2.5 大孔树脂静态吸附实验
1.2.5.1 吸附解吸最佳时长
静态吸附动力学曲线:取20 mL 南瓜提取液,向其中加入经过预处理的大孔树脂2 g,静态吸附,每隔30 min测定1次吸光度,持续180 min。
解吸动力学曲线:过滤达到饱和吸附的树脂,向树脂中加入20 mL无水乙醇,静态解吸,每隔10 min测定一次吸光度。
1.2.5.2 树脂与提取液的最佳比例
分别称取0.5、1.0、1.5、2,2.5、3、3.5、4.0 g处理好的最优型号树脂,各加入20 mL南瓜色素提取液,静置最优时长后,测定各吸附液的吸光度。
1.2.5.3 树脂与提取液的最佳pH值取7 份20 mL 南瓜色素粗提液,分别加入1 g 最优型号树脂。pH 值分别调为1.0、2.0、3.0、4.0、5.0、6.0、7.0、8.0、9.0、10.0、11.0(HCl或NaOH调节),静态吸附最优时长后,在最优波长下测定吸光度。
1.2.6 大孔树脂动态实验取已吸附南瓜色素的树脂10 g,装入25×200 mm的色谱柱,用蒸馏水洗脱8个柱体积后,再用无水乙醇洗脱至洗脱液无色,流速为1.0 mL/min,测定每份收集液的吸光度,确定洗脱剂用量。
1.2.7 线虫体内抗氧化指标检测。
C.elegans经同步化培养后使用,实验设DMSO空白对照组、VE阳性对照组与不同浓度样品组(12.5、25、50 μmol/L)。同步化线虫挑至含大肠杆菌OP50的NGM培养基,样品处理6 h后,制备线虫均浆,采用试剂盒法检测线虫体内总超氧化物歧化酶活力(T-SOD)和丙二醛(MDA)水平。
1.2.8 数据处理
试验数据均以Means±SD表示,使用IBM SPSS Statistics 22 进行显著性分析(P<0.0.5)。
2 结果与分析
2.1 南瓜色素的提取工艺优化
2.1.1 南瓜色素超声提取的单因素试验
2.1.1.1 乙醇浓度的优化
乙醇浓度对南瓜色素得率的影响较大。随乙醇浓度增加,南瓜色素得率快速上升,浓度增加至95%时,色素得率趋于平缓,故选择95%乙醇作为浸提剂浓度。
2.1.1.2 超声时间、料液比、浸提温度、浸提时间的优化
超声时间、料液比、浸提温度、浸提时间对南瓜色素得率的影响见图1。由图1(A),随着超声时间的延长,南瓜色素得率出现先升后降的趋势,可能是超声过长破坏南瓜色素导致[3]。超声40 min时得率最大,故选择40 min作为响应面优化的中心水平。由图1(B),随着料液比的增加,色素得率快速上升,随着趋于平缓并有下降趋势,其原因可能是随着料液比的增大,单位体积提取剂中对南瓜色素的溶解量已基本饱和,南瓜色素向浸提剂的扩散达到平衡,导致南瓜色素不能充分溶出[16]。料液比1∶40时得率最大,故选择1∶40作为响应面优化的中心水平。
由图1(C),温度为40 ℃时得率最高,原因是温度过高使南瓜色素降解导致[17],故选择40 ℃作为最佳提取温度。由图1(D),随着浸提时间的延长,南瓜色素得率出现先降后升再降的趋势,浸提60 min时色素得率最高,随后下降可能是随着时间的延长,南瓜色素被氧化所致,故选择60 min作为响应面优化的中心水平。
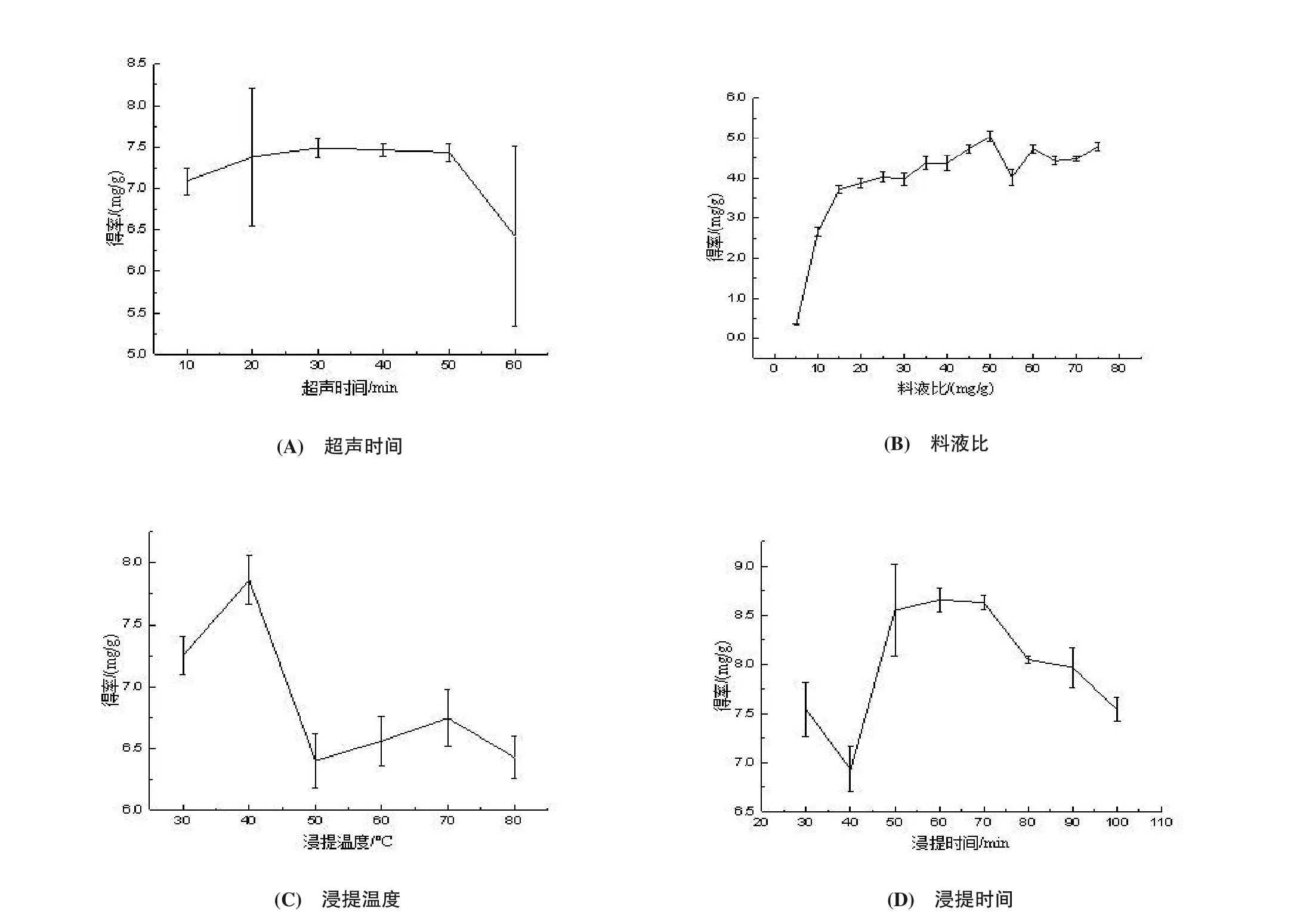
图1 超声条件对南瓜色素得率的影响Figure 1 The effect of ultrasonic condition on yield of pumpkin pigment
2.1.2 响应面优化南瓜色素的提取工艺条件
根据南瓜色素提取的单因素试验,确定3 因素3 水平为料液比1∶10、1∶40、1∶70,浸提时间40、60、80 min,超声时间20、40、60 min。通过Design-expert 8.0.6数据处理软件的Box-Behnken Design(BBD)的试验设计原理,以南瓜色素得率为响应值,试验设计与结果见表1,可获得3个因素与响应值间的回归方程,如下:
Y=-0.28A2+0.084B2-0.51C2+0.11AB-0.11AC-0.009BC+0.035A+0.049B+0.9C+6.27
回归方程中,Y表示南瓜色素得率的预测值,A、B与C分别代表超声时间、浸提时间与料液比的自变量,对回归方程系数分析结果见表2。对回归模型进行方差分析,影响南瓜色素得率的顺序为料液比>浸提时间>超声时间。相关系数R2(决定系数)与R2Adj(调节决定系数)分别为0.942 4与0.868 2,表明预测值与观测值间具有较高相关性。同时,较低的变异系数(C.V.%3.67)表明高度的可靠性与精密度。P用于检测每个系数的显著性,其中模型的P=0.001 5,说明模型适应性非常显著该模型的拟合度好,可以真实地描述各个影响因子与响应值之间的关系。同时,失拟项(0.131 3)不显著,说明回归方程与实际情况吻合较好,实验误差小。

表1 南瓜色素提取的BBD设计及响应值Table 1 BBD design and response value of pumpkin pigment extraction

表2 响应面二次型方差分析Table 2 Response surface quadratic analysis of variance
由实验结果做响应面图,见图2,可看出各因素在南瓜色素得率过程中的相互作用,从而确定合适的配比参数。预测的配比参数为:超声时间41.56 min、浸提时间80 min、料液比1∶66.14,该条件下南瓜色素得率理论值为6.74 mg/g。为了验证模型预测的准确性,实验对预测参数进行了验证,参数调整为:超声时间42 min、浸提时间80 min、料液比1∶66。经过3组平行实验,实验南瓜色素得率为6.760±0.005 mg/g,与预测理论值无显著性差异,响应面优化真实可靠。
2.2 南瓜色素纯化工艺的选择
2.2.1 大孔树脂型号的选择
由表3可知,AB-8的吸附率最优,其次为D-101,而解吸率相较其他型号较差。树脂的选择需同时考虑吸附率和解吸率,其中AB-8是常用的大孔树脂,价格低廉,因此综合考虑之后选取AB-8。

图2 自变量间的交互作用对南瓜色素得率的影响Figure 2 The effect of interaction among variables on the yield of pumpkin pigment

表3 不同型号大孔树脂的解吸率和吸附率Table 3 Desorption and adsorption rates of different types of macroporous resins
2.2.2 静态吸附解吸时长的选择
由图3(A),静态吸附时随着时间增加,得率逐渐降低,在150 min后趋于稳定,因此静态吸附的最佳时间是150 min。由图3(B),静态解吸时吸光度随时间增加得率升高,50 min后趋于平缓,故解吸的最佳时间为50 min。相较于努尔·亚力坤等的研究结果[15],由于树脂型号的不同,AB-8对于南瓜色素吸附解吸的时长比D-101短。

图3 静态吸附解吸时长对南瓜色素的影响Figure 3 The effect of static adsorption and desorption time on pumpkin pigment
2.2.3 料液比的选择
由图4可知,在每200 mL乙醇中树脂质量达到2.5 g时被吸附的色素提取液得率趋于稳定,所以较优的树脂与色素提取液比例为1∶8(g/mL)。
2.2.4 洗脱剂的选择由表4,解吸时最优洗脱剂为乙酸乙酯,其次为丙酮,由于各文献中树脂型号选择不同,洗脱剂有所不同,出于安全考虑,后期实验采用乙醇作为洗脱剂。

图4 树脂用量对南瓜色素得率影响Figure 4 The effect of resin dosage on the yield of pumpkin pigment

表4 不同洗脱剂对南瓜色素解吸的影响Table 4 Effect of different eluents on the desorption of pumpkin pigment
2.2.5 pH值的选择
实验发现南瓜色素在碱性条件变浑浊,有文献报道类胡萝卜素在高碱性环境中不稳定[18],可见南瓜色素不适用于碱性条件。由图5(A),酸性和中性条件下,AB-8大孔树脂对南瓜色素的吸附随着pH值呈现先升后降趋势,可能是由于色素内含有羧基(-COOH)呈现酸性的原因[19]。不同pH值条件下的吸附效果相差不大,且强酸性条件下色素的得率有所下降,说明色素在强酸性条件下被降解。故选取pH值为7。
2.2.6 洗脱剂用量的选择
由图5(B),得率随洗脱剂用量的增加先升高后降低,洗脱剂用量为6 倍洗脱体积(BV)时,达到峰值。18 BV以后得率趋于平稳,色素基本全部被洗脱出来,故洗脱剂的最佳用量为18 BV。
综上,在最佳纯化条件下,即选取AB-8树脂,树脂与溶剂最佳比例为1∶8(g/mL),吸附洗脱剂的最佳用量为18 倍柱体积,此时南瓜色素的得率为9.5%。在此条件下分离制备南瓜色素,进行后续的抗氧化能力研究。

图5 pH和洗脱剂用量对南瓜色素得率影响Figure 5 The effect of pH and the amount of eluent on the yield of pumpkin pigment
2.3 南瓜色素对C. elegans体内总超氧化物歧化酶(T-SOD)与MDA活性的影响
SOD是机体重要的抗氧化酶,可清除超氧阴离子自由基。由图6(A),随着南瓜色素浓度升高,线虫体内T-SOD 活性呈现先升后降现象,色素浓度为25 mg/mL 时,SOD 活性显著高于空白对照组(P<0.05)。在50 mg/mL抗氧化活性大幅降低且仅稍好于对照,主要原因可能有两方面的原因,一是浓度过高会产生其它生理毒性,反而影响了线虫的正常生理活动[20],二是可能是渗透压过高造成的[21]。由图6(B),与空白对照组比较,不同浓度的南瓜色素,均可以使线虫体内MDA 水平显著下降(P<0.05),且与阳性对照VE间无差异(P>0.05)。MDA作为脂质氧化终产物,其含量越大表明机体氧化损伤越严重[22]。

图6 南瓜色素对C.elegans体内总超氧化物歧化酶(T-SOD)与MDA活性的影响Figure 6 The effect of pumpkin pigment on T-SOD and MDA level activity in C.elegans
3 结论
南瓜色素是一种安全性高,着色力强的天然色素,同时又是一种非常重要生物抗氧化剂。南瓜色素的提取方法主要有传统的溶剂提取法(提取南瓜色素较普遍方法,包含固液萃取法、回流法、煎煮法等)、微波辅助提取法、超声波辅助提取法以及超临界二氧化碳萃取法等。其中,超声波辅助提取法具有减少耗时、效率高、能耗低、可低温下操作等优点近年来倍受关注。我们采用超声波辅助提取南瓜色素时发现,随着超声时间延长、温度升高,南瓜色素的得率出现先上升后下降的趋势,这主要是因为超声时间过长[3],温度过高[17],都会导致南瓜色素被破坏。而随着浸提时间的延长,得率却呈现先降后升的趋势,这可能是由于南瓜色素被氧化造成的。随着料液比的增大,南瓜色素得率的趋势上升后趋向平衡,这主要是因为单位体积提取剂中南瓜色素的溶解量已经基本饱和[16]。本实验采用单因素试验和Box-Behnken Design(BBD)的试验设计得出95%乙醇为浸提剂、超声时间42 min、浸提时间80 min、料液比1∶66时,南瓜色素溶出效果最佳,南瓜色素得率达6.760±0.005 mg/g。
南瓜色素的纯化方法主要采用吸附柱层析法,常用的吸附剂主要为大孔吸附树脂、氧化铝等。我们对不同极性的大孔树脂进行了筛选,实验结果与王莹[11]等的研究结果不同,可能是由于使用的南瓜品种不同,其中的南瓜色素的种类与极性不同所致。考虑南瓜色素(主要为叶黄素类的类胡萝卜素)的极性特点,我们选取了非极性与弱极性树脂进行纯化。吸附率最高的是AB-8,但解析率不高,文献中用丙酮作为溶剂,解析率较高;考虑到食用安全性,实验选择了乙醇进行洗脱。
南瓜色素是一种含有共轭双键系的萜烯基团类天然色素,它能够影响细胞生长调节,调节基因表达和免疫反应。近年来,对于花青素等水溶性天然色素的抗氧化性研究较多,而目前对于南瓜色素的抗氧化能力作用尚不明确,可通过体内体外实验探讨其作用机制,体外实验包括羟自由基(·OH)、DPPH 自由基(DPPH·)清除能力等,体内实验可选用秀丽隐杆线虫(C.elegans)、大鼠及小鼠作为模式实验。其中秀丽隐杆线虫因具有结构简单、繁殖量大、方便观察等特点备受关注,且大多与人体病症有关的基因和通路涵盖在线虫基因组中。在秀丽隐杆线虫上进行对南瓜色素抗氧化性的研究,便于观察,应用线虫模型做的研究结果也可以外推到人类。本文南瓜色素抗氧化活性体内实验中,随着南瓜色素浓度升高,线虫体内SOD活性呈现先升后降现象,可能原因是浓度过高会产生其它生理毒性[20],反而影响了线虫的正常生理活动,或是高浓度产生的高渗透压所致[21]。而不同浓度的南瓜色素,均可以使线虫体内MDA水平显著下降(P<0.05),使机体抗氧化能力提高。
目前对南瓜色素的高效制备仍在起步阶段,抗氧化性研究也多停留在体外试管比色实验。获得高得率高纯度的南瓜色素,解吸其分子结构、探讨其抗氧化应激作用的机制及结构与活性间的构效关系等是目前亟待解决的问题。

