蜱类涎液与病原体传播的关系及其在蜱媒病防控中的应用*
张美娜 秦 通 施明杰 孙 毅
(军事科学院军事医学研究院微生物流行病研究所,病原微生物生物安全国家重点实验室,媒介生物危害和自然疫源性疾病北京市重点实验室,北京 100071)
蜱隶属于蛛形纲蜱目,是一类通过叮咬吸血,传播病毒、细菌、螺旋体和毒素等多种病原体并引发人兽共患疾病流行的媒介节肢动物(刘敬泽等,2013)。蜱类传播的病原体谱很广,既包括经典蜱媒疾病病原体,如伯氏疏螺旋体、克里米亚刚果出血热病毒、森林脑炎病毒、斑点热群立克次体等,又包括新近发现的病原体,如波本Bourbon病毒(Lambertetal., 2015)、荆门蜱病毒(Jiaetal., 2019)、阿龙山病毒(Wangetal., 2019)、假面山病毒(Kobayashietal., 2020)、奥多摩町病毒(Kobayashietal., 2020)、Thogoto病毒(THOV)(Talactacetal., 2018)和新布尼亚病毒(Yuetal., 2011)。近年来,以发热伴血小板减少综合征、荆门蜱病毒为代表的蜱媒病危害日益严重,探索蜱媒病防治方法成为科学界尤其是预防医学领域研究中热点问题之一。然而由于蜱媒病原种类多样、变异快,蜱媒病原特异性疫苗研发投入巨大,但成效甚微。研究者不得不将单纯的病原体研究转移到病原体、媒介蜱和宿主动物(人)的相互作用方面来,其中围绕涎腺等关键传播环节的研究最为活跃。在NIH支持下,2005年Francischetti 完成了肩突硬蜱涎腺的转录组学分析(Francischettietal., 2005),接着Ribeiro 等人完成了肩突硬蜱涎腺分泌蛋白的分类与功能注释,发现了可通过调节宿主免疫介导病原传播的Salp蛋白及类似物(Ribeiroetal., 2006);针对美洲花蜱涎腺的基因组学和转录组学研究(Karimetal., 2011; 2015)也为明确蜱类涎腺活性分子在病原体传播中的作用提供了坚实基础。尤其是2016年完成的肩突硬蜱全基因组测序成为蜱媒研究中具有里程碑意义的前沿进展(Gulia-Nussetal., 2016)。在应用方面,继蜱类中肠抗原的兽用抗蜱疫苗TickGARD®和Gava®上市以后,涎腺分泌的粘质蛋白cement 64TRP组分被认为具有阻断森林脑炎病毒传播的开发潜力(de la Fuenteetal., 2016);电压依赖型阴离子通道蛋白(voltage-dependent anion channel, VDAC)重组疫苗通过阻断蜱媒病原对家畜的传播作用已进入现场评价阶段(Ortega-Sánchezetal., 2020)。最近对我国6个代表蜱种的高质量基因组分析也为阐明涎腺在病原体传播中的关键作用提供了重要基础(Jiaetal., 2020)。这些围绕着蜱类涎腺、中肠等活性成分的应用基础研究,初步彰显了涎腺在病原体传播中的关键作用以及传播阻断在蜱媒病防控中的巨大潜力(de la Fuenteetal., 2017)。
1 涎腺结构与功能
1.1 涎腺结构
涎腺是蜱类游离态和寄生态多样化生理过程的必要腺体,除维持离子与水分平衡外,涎腺通过分泌涎液在蜱媒病原传播中发挥关键作用。涎腺位于蜱的体腔两侧、呈葡萄串状, 是蜱体内最大的腺体。附突扇头蜱Rhipicephalusappendiculatus雄蜱有约1 400个(acini I~IV)腺泡,雌蜱约1 350个(acini I~III),涎腺支管汇合于涎腺管,涎腺管汇于贮涎窦(salivarium)并开口于口下板基部。其中,I型腺泡 (acini I)为非颗粒型,在所有蜱种中存在,多位于总涎管的前端或涎管的基部。II型腺泡中的单一颗粒型(acini II)仅为软蜱所有;在硬蜱科种类中,雄蜱有腺泡I~IV型(acini I~IV),雌蜱仅有腺泡I~III型。颗粒状结构的II、III型腺泡 (acini II、III)往往位于分支涎管的端部,被认为是蜱类分泌涎液的主要场所。
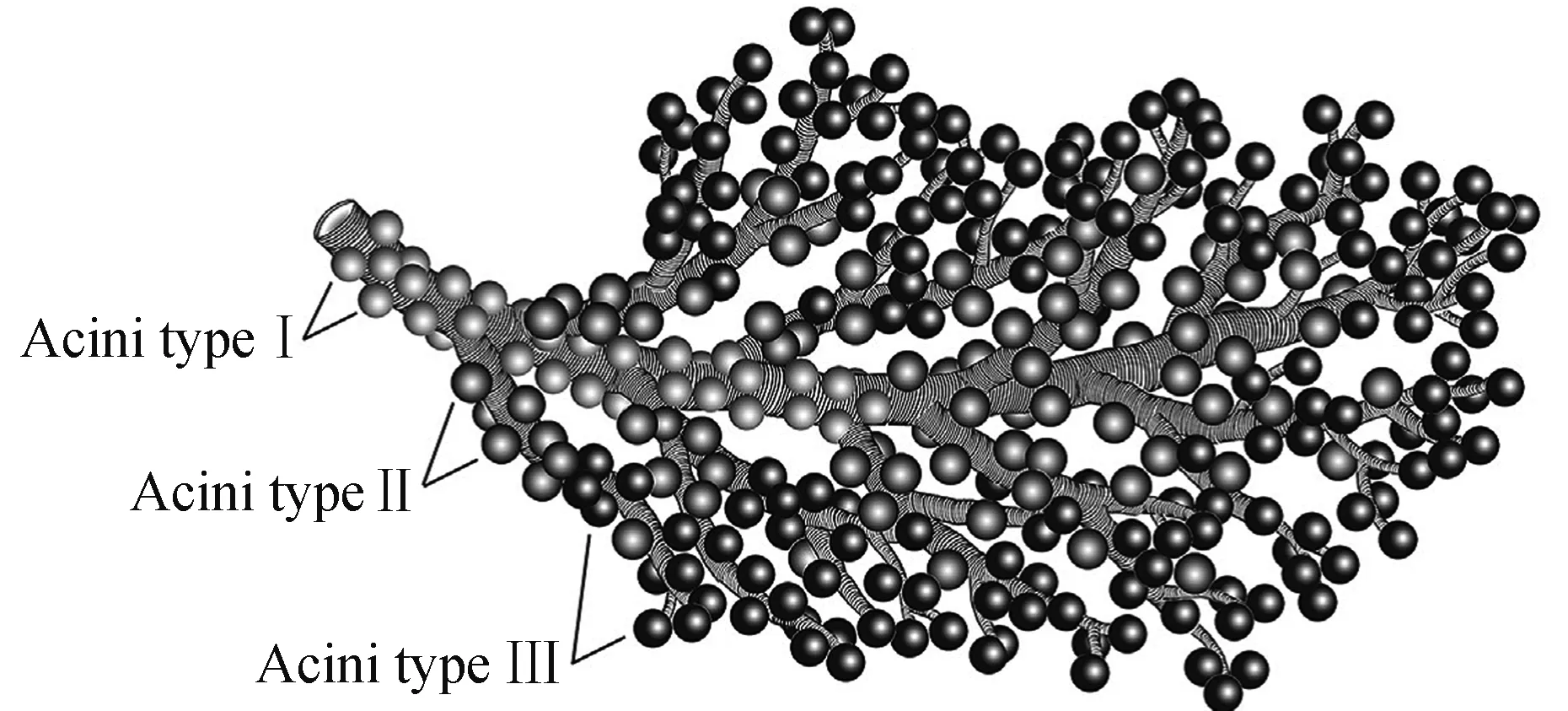
图1 硬蜱涎腺模式图Fig.1 Diagram of salivary gland in Ixodid ticks
1.2 涎腺功能
无论是游离还是寄生,蜱类涎腺都发挥着重要的生理功能,主要包括(1)非取食期从空气中吸收水分;(2)调节蜱类离子和渗透压平衡;(3)产生粘质物质,固定口器;(4)产生有助于吸血或调节宿主免疫作用的活性物质;(5)为病原体发育和释放提供合适的传播途径等。
1.2.1水分及离子平衡:硬蜱体表为几丁质所覆盖,具有相对不透水的特性。除了非取食期,蜱类利用腺泡I分泌的吸湿性涎液获取水分外,涎腺腺泡还可以排出多余的水分(Reuben Kaufmanetal., 2010)。涎腺通过涎液分泌将血餐中多余的液体和离子归还给寄主,以浓缩营养物质并调节血淋巴的体积和离子成分(Reuben Kaufmanetal., 2010)、维持水压(Bowmanetal., 2008)及水分平衡。在安氏革蜱Dermacentorandersoni中74%的水分以及96% 钠离子就是通过这种方式归还至宿主动物。其中,腺泡III所具有的钠钾泵(sodium potassium pump (Na/K-ATPase))可能发挥着重要作用。
1.2.2涎液分泌:涎液分泌是涎腺的一个复杂过程,调控涎腺分泌活动的诸多生物活性成分被逐渐发现。儿茶酚胺 (catecholamines)被认为是涎液分泌的主要激活分子,由多巴胺介导的蜱类涎腺分泌激活已在多个蜱种的体内、外实验中得以证实(imoetal., 2012)。多巴胺由蜱类的中枢神经—合神经节的多巴胺性神经元触突产生,腺泡细胞是多巴胺的自分泌或旁分泌信号的靶标 (imoetal., 2011;etal., 2014)。除多巴胺外,其他一些物质也可直接或间接地调控涎腺的分泌,但这些物质的受体尚不清楚。例如章鱼胺可诱导美洲花蜱涎腺分泌3倍于多巴胺诱导的分泌量;γ-氨基丁酸可影响多巴胺的产生,但其本身则无法诱导涎腺分泌;此外,麦角生物碱(Ergot alkaloids)、拟胆碱类普鲁卡因(pilocarpine)都可刺激涎腺分泌涎液。与此同时,最近的研究发现,蜱类也可通过神经肽网络选择性控制腺泡的生理分泌活动,如合神经节大神经元上的肌神经肽(myosin inhibitory peptide,MIP)和SIFamide被证实可调控腺泡II和III的基部组织的生理活动(Rolleretal., 2015)。在诱导涎腺分泌涎液过程中,环磷酸腺苷依赖型蛋白磷酸化途径和激活胞质磷酸化酶A2的钙离子依赖途径尤为重要,后者被证实可释放花生四烯酸(arachidonic acid)和前列腺素E2(PGE2) (Qianetal., 1998; Saueretal., 2000),PGE2进入涎腺可诱导涎腺通过胞内Ca2+通道分泌抗凝血成分以及其他蛋白。
2 涎液的组成及功能
蜱类涎液的组分随发育期、性别、行为以及病原体感染不同而不同(Ribeiroetal., 2006; Diaz-Martinetal., 2013; Liuetal., 2014c)。关于涎腺或涎液的基因组学、转录组学和蛋白组学研究目前已见报道,但对涎液组分的认识仍旧是冰山一角,只有不足5%的涎腺蛋白得到了注释和功能验证(Francischettietal., 2009)。对篦子硬蜱涎腺的转录组学发现,大部分转录子(12.8%)被归类于氧化—还原过程,整合至细胞膜系统的转录子约占11.4%,还有63.2%的转录子被转录为结合蛋白(Liuetal., 2014b)。在该蜱叠联群序列数据中,13%被认为是分泌蛋白,蛋白抑制剂占所有叠联群的2.6% (Schwarzetal., 2013)。
2.1 宿主免疫调节相关的涎液活性分子
为应对宿主动物的免疫胁迫,蜱类也演化出一系列调节或逃避宿主免疫体系的涎液活性分子。
2.1.1先天免疫与补体系统:抗炎反应:炎性反应通常发生在蜱类叮咬形成的伤口,伤口的炎性反应主要基于炎性细胞对补体组分、前列腺素、白三烯素、抗菌肽、化学因子和细胞因子等招募活动(Andradeetal., 2005);作为应对措施,蜱类涎液分泌出可调节前炎性因子(pro-inflammatory factor)的活性分子,作用于包括嗜中性粒细胞(Guoetal., 2009)、NK 细胞 (Kubešetal., 1994)、巨噬细胞 (Krameretal., 2011)、T淋巴细胞 (Ramachandraetal., 1992)和树突细胞 DCs (Cavassanietal., 2005)等在内的多种靶细胞。这些分子通过抑制前炎性Th1细胞因子,上调抗炎性Th2细胞因子,引发Th2细胞的极化(Mejrietal., 2001)。Th2细胞因子对炎性的抑制对于蜱类完成吸血和病原体传播具有重要作用(Schoeleretal., 2001)。同样,蜱类涎液蛋白也可通过模拟宿主动物的蛋白实现免疫逃逸,如美洲花蜱中的巨噬细胞迁移抑制因子可保护蜱类免遭巨噬细胞攻击(Jaworskietal., 2001)。
抗补体反应:连接先天免疫和后天免疫的补体系统主要通过备选、经典和凝集素补体激活通路进行激活。其中,备选的补体激活通路是宿主动物应对病原入侵和蜱类攻击的重要防线。肩突硬蜱的Isac、Salp20和Isac-1 (Valenzuelaetal., 2000; Tysonetal., 2007) 以及篦子硬蜱Isac类似物 IRAC I、II (Daixetal., 2007; Couvreuretal., 2008) 可通过阻断寄主补体因子B与补体C3b的结合,特异性抑制C3 转换酶的激活。非洲钝缘蜱脂蛋白补体抑制剂特异性作用于宿主动物补体级联系统的C5 活化步骤(Nunnetal., 2005);卡津花蜱A.cajennense涎液则可抑制寄主动物补体系统的经典激活通路(Francoetal.,2016)。
2.1.2后天免疫:在抗蜱宿主动物中,蜱类抗原的特异性抗体或T淋巴细胞效应因子的出现可引起宿主动物对蜱类再次叮咬的拮抗。而在敏感宿主动物中,蜱类的反复叮咬并不出现拮抗作用,这可能与增强T细胞激活反应、Th1/Th2联合的细胞因子反应相关(Heinzeetal., 2012b)。
蜱类诱导的宿主动物免疫抑制特征是降低初级抗体对T细胞依赖性抗原的免疫反应和宿主动物对Th2型免疫反应的极化。这种极化作用主要通过下调前炎性Th1细胞因子(IL-2, IFN-gamma)和上调Th2细胞因子(IL-4, IL-5, IL-6, IL-10, IL-13) (Schoeleretal., 2001; Wikeletal., 2001)实现的。蜱类涎液中发现多个T细胞抑制分子,包括安氏革蜱(Bergmanetal., 2000)中的P36、篦子硬蜱(Leboulleetal., 2002)中的Iris、肩突硬蜱(Anguitaetal., 2002)中的Salp15等。Iris 抑制T细胞增生诱导Th2型免疫反应并抑制前炎性细胞因子IL-6和TNF-α;Salp15同CD4+T 细胞表面的CD4分子结合,进而抑制T细胞受体介导的信号传导,降低白介素IL2的增生并抑制T细胞增殖(Anguitaetal., 2002; Gargetal., 2006)。此外,Salp15还通过Toll样受体 (TLR) 抑制树突细胞功能,导致树突细胞的T细胞激活和前炎性细胞因子的产生受阻(Hoviusetal., 2008a)。太平洋硬蜱I.pacificus、篦子硬蜱、全沟硬蜱以及中华硬蜱I.sinensis(Hoviusetal., 2007; Hojgaardetal., 2009; Morietal., 2010;Wangetal., 2014)的Salp15蛋白陆续得以鉴定。蜱类涎腺免疫调节蛋白还包括白介素IL2结合蛋白,该蛋白抑制T细胞增生并激活多个白介素2以外的免疫效应分子(Gillespieetal., 2001)。涎腺半胱氨酸蛋白酶抑制剂sialostatin L 及L2可抑制组织蛋白酶cathepsin L (Kotsyfakisetal., 2006),从而抑制细胞毒性T淋巴细胞的繁殖和脂多聚糖诱导的树突细胞成熟(Sa-Nunesetal., 2009)。蜱类亦可通过抑制B细胞反应阻止特异性抗蜱反应,其中B细胞抑制蛋白BIP和BIF已分别从篦子硬蜱和亚洲璃眼蜱中鉴定出来(Hannieretal., 2004; Yuetal., 2006)。另外,蜱类涎液中还含有免疫球蛋白结合蛋白IGBP,它可以通过蜱类的中肠,促进涎液的分泌,该蛋白保护蜱类免受宿主动物IgG的作用(Wangetal., 1999)。同时,附突扇头蜱涎腺的脂蛋白Japanin被认为具有刺激和抑制前炎性因子和抗炎性因子、以及T细胞极化的细胞因子,最终抑制单核细胞向树突细胞的分化。
3 涎液与病原体传播
3.1 涎液组分对病原体传播的影响
病原体在蜱体内进行增殖并进入涎腺后,涎腺尤其是涎液在病原体向宿主动物传播过程中发挥着关键作用。因而病原体的传播不能以“注射器”简化了之。在蜱、宿主和病原体的长期共同进化中,涎腺已进化出通过宿主局部感染或系统感染甚至一过性感染,确保病原体传播的能力(Nuttalletal., 2004; Ramamoorthietal., 2005; Wikel, 2013)。这三者之间的分子互作不仅仅是进化冲突,也包括两方或者三方受益的合作共赢。目前有关涎腺或涎液与病原体的传播大多停留在涎液辅助传播等现象的观察阶段,尽管一些涎腺活性分子已得到鉴定,但距离深刻洞悉涎腺及其涎液对病原体传播的内在机制及其分子基础还有不少差距。
3.1.2共同吸血传播(Cofeeding transmission): Jones等观察到THOV向未感染蜱传播,在与感染蜱的共同吸血时更为有效,且共同吸血的寄主动物并不发生系统感染,因此,将这种新型的病毒传播模式定义为共同吸血传播(Cofeeding transmission) (Jonesetal., 1987)。感染与未感染蜱之间的共同吸血传播也被认为是涎腺辅助传播的间接证据(Nuttalletal., 2004)。蜱类吸血时形成的融入了涎液的血池为病原体在蜱个体间交换提供了良好条件 (Randolph, 2011; Voordouw, 2015)。森林脑炎病毒共同吸血传播比其他细菌更为有效,甚至可以发生在有一定滴度的病毒特异性中和抗体出现的条件下 (Labudaetal., 1997),这提示了蜱媒病毒具有的精妙的免疫逃逸策略。涎腺活性物质所致的免疫调节和免疫逃逸在蜱类共同吸血传播中发挥着重要作用。在篦子硬蜱共同吸血传播案例中,局部皮肤的一过性感染是共同吸血传播的基础,在叮咬部位出现的细胞浸润以及病毒抗原在朗格罕细胞Langerhans cells、中性粒细胞出现,乃至病毒出现在单核细胞或巨噬细胞提示了这些迁移细胞及引流淋巴结作为病毒运输工具在蜱类共同吸血传播中发挥主要作用(Labudaetal., 1996)。体外实验也证实了利用涎液处理树突细胞可增加病毒的载量,并降低病毒诱导产生的TNF-α、IL-6以及病毒诱导细胞凋亡 (Fialováetal., 2010)。肩突硬蜱涎液中的Sialostatin L2就具有抑制干扰素,促进TBEV在树突细胞复制的能力(Lieskovskáetal., 2015)。除病毒外,蜱类共同吸血传播还发生在胞间寄生的病原体如莱姆病螺旋体或胞内寄生的立克次体R.conorii,R.parkeri和埃粒克体Ehrlichiamuris等。
3.1.3与蜱媒病原传播相关的涎腺活性分子: 目前涎腺活性分子对病原体的作用主要表现在两个方面,一是病原体在蜱体内的复制和转运,二是促进病原体向宿主的传播。其中,最典型的案例是莱姆病螺旋体的表型可塑性。在蜱体内莱姆病螺旋体表达外膜蛋白A(Osp A),并通过中肠的Osp A特异性受体结合至蜱类中肠。随着蜱类在寄主动物体表开始吸血,在ROS系统调控下,莱姆病螺旋体上调表达外膜蛋白C(Osp C)同时下调外膜蛋白A(Osp A)的表达,并突破中肠屏障向血淋巴和涎腺迁移。当螺旋体由涎腺释放进入涎液,莱姆病螺旋体又分别同涎液中的诸多活性分子相互作用,包括调控T细胞的Salp15、抑制补体反应的Isac、Salp20以及作用于巨噬细胞、中性粒细胞及宿主免疫系统的其他组分等。(1)外泌体(exosome)等液泡系统(vesicles system) 液泡是由细胞囊泡系统生成,可运载生物活性多糖、脂类、蛋白质、核酸等物质,在细胞间交流并调控靶细胞功能的囊泡体。蜱类涎液中的液泡按直径和功能可划分为微体ectosome、外泌体exosome、自噬体autophagosome及凋亡体apotosome等。作为蜱类重要的分泌腺体,涎液中的涎腺外泌体等液泡体因其具有脂质双层膜,可作为载运工具长距离递送涎液活性分子。涎液中液泡体除运送多样化的涎腺活性分子外(包括具有免疫调节和自噬及凋亡诱导作用的小分子如mRNA、miRNA、ncRNA以及lncRNA等),还可递送蜱媒病原体,如兰加特病毒、发热伴血小板综合征病毒、森林脑炎病毒等。涎腺外泌体对多种涎腺活性分子乃至病原体的个性化分拣包装机制和递送至宿主后诱导的自噬和凋亡调控及宿主免疫调节,为解释蜱媒病原突破蜱类涎腺释放屏障机制,抑制蜱类和宿主动物的免疫胁迫提供了可靠的分子基础(Robbinsetal., 2016)。(2)涎腺中B细胞抑制蛋白BIP可在螺旋体外膜蛋白C的诱导下抑制B淋巴细胞的产生,进而促进螺旋体向宿主的传播(Hannieretal., 2003)。(3)Salp15 涎腺分泌Salp15可结合哺乳动物的CD4细胞(Gargetal., 2006),并抑制CD4+T淋巴细胞的激活(Anguitaetal., 2002)。除此以外,Salp15还作为免疫保护抗原,降低螺旋体对宿主动物的感染载量(Ramamoorthietal., 2005;Daietal., 2009)。在蜱类涎腺中,螺旋体通过外膜蛋白OspC与Salp15结合,可有效保护螺旋体免于宿主动物抗体及补体的胁迫(Schuijtetal., 2008),促进螺旋体的传播及其在宿主皮肤中繁殖(Ramamoorthietal., 2005)。除此以外,从篦子硬蜱、中华硬蜱的涎腺中也发现了Salp15的类似物如Salp15 Iric-1, Salp15 Isin-1a (Hoviusetal., 2008b, Wangetal., 2014)。(4)Salp25D 从肩突硬蜱分离出来优势免疫涎腺蛋白Salp25D在蜱类获取螺旋体感染时作为抗氧化剂维护螺旋体的存活(Dasetal., 2001; Narasimhanetal., 2007)。(5)Salp20 腺蛋白Salp20通过与备解素properdin或P因子的结合,解离补体的C3转换酶,抑制备选补体激活途径(Tysonetal., 2007; Hourcadeetal., 2016)。Salp20的表达对于保护螺旋体免于在血浆激活因子H的辅助下被人血清水解具有重要意义。(6)tHRF(组氨酸释放因子) 蜱类组氨酸释放因子可结合哺乳动物的嗜碱性粒细胞并启动组氨酸的释放 (Mulengaetal., 2003b; Daietal., 2010)。该因子在蜱类快速吸血阶段表达上调,通过提高血管的通透性增加血流满足蜱类饱血以及莱姆病螺旋体感染的需要,对tHRF的基因沉默则影响蜱类的取食并降低宿主动物心脏和关节中的莱姆病螺旋体载量(Daietal., 2010)。组氨酸的血管扩张作用对于促进螺旋体的复制及其从中肠向血淋巴的扩散、以及宿主动物的系统感染都具有重要意义(Daietal., 2010)。(7)TSLPI 蜱类涎腺凝集素途径抑制剂 该抑制剂同人的凝集素补体系统相互作用,抑制中性粒细胞、吞噬细胞以及趋化因子的作用,保护病原体免疫凝集素补体途径的杀灭(Schuijtetal., 2011)。(8)IrSPI 来源于篦子硬蜱涎腺的丝氨酸蛋白酶抑制剂IrSPI,属于BPTI (bovine pancreatic trypsin inhibitor)/Kunitz家族的丝氨酸蛋白酶抑制剂,它通过阻遏宿主的止血,促进蜱类吸血和病原体的感染。对IrSPI的RNAi沉默可导致蜱类吸血受阻和蜱类涎腺中汉赛巴尔通体载量下降(Liuetal., 2014b)。(9)Salp 16 嗜吞噬细胞无形体的感染可诱导肩突硬蜱涎腺产生Salp16,该涎腺蛋白的表达对于无形体由血餐向蜱类涎腺的扩散至关重要,也是蜱类持续感染嗜吞噬细胞无形体的特异需求(Sukumaranetal., 2006)。(10)sialostatin L2 肩突硬蜱涎腺蛋白sialostatin L2可通过阻遏caspase-1活性抑制炎性体的形成(Chenetal., 2014)。其他已知涎液活性成分及功能见表1。
3.1.4病原感染对涎腺活性分子基因转录及表达的影响: 在涎腺作用于病原体同时,病原感染也对涎腺蛋白转录及表达产生着深刻的影响。目前仅有的几项研究主要集中在变异革蜱与蒙特立克次体(Macalusoetal., 2003)、附突扇头蜱与帕瓦泰勒虫Theileriaparva(Neneetal., 2004)、微小扇头蜱与中心无形体(Zivkovicetal., 2010; Mercado-Curieletal., 2011)、肩突硬蜱I.scapularis与嗜吞噬细胞无形体(Ayllónetal., 2015)及兰加特病毒 Langat virus (McNallyetal., 2012)和篦子硬蜱与汉赛巴尔通体B.henselae(Liuetal., 2014b),采用方法主要包括差异显示PCR(ddPCR)(Macalusoetal., 2003)、表达序列标签测序(Neneetal., 2004)、抑制差减杂交(Zivkovicetal., 2010)、微阵列芯片(Mercado-Curieletal., 2011; McNallyetal., 2012)以及高通量测序等(Liuetal., 2014b; Ayllonetal., 2015)等。
不同病原体感染不同的媒介蜱类,其涎腺蛋白的转录和表达出现了不同的动态,或上调或下调,或沉默或过表达。但总体而言,应对病原体感染和传播,涎腺蛋白基因转录和表达的整体策略是最小的适合度代价(Mercado-Curieletal.,2011),对于具有高度适应关系的病原体与媒介来说,如中心无形体与微小扇头蜱,病原体的感染对涎腺基因的转录和表达影响不大;而对于两者适应程度较低的环附扇头蜱Rhipicephalusannulatus和牛巴贝西原虫B.bovis来说,病原体的感染则影响较大(Ouhellietal., 1987)。
在病原体感染对蜱类涎腺蛋白、尤其是免疫相关涎腺蛋白的调控已有不少报道。如兰加特病毒对肩突硬蜱(McNallyetal., 2012)、汉赛巴尔通体B.henselae对篦子硬蜱(Liuetal., 2014b)、中心无形体对微小扇头蜱BME26 (Rosaetal., 2016)的作用就是下调免疫相关基因,包括涎腺蛋白编码基因。除下调免疫相关基因外,病原体的感染可上调组氨酸释放因子的转录与表达,诱导巨细胞和嗜碱性粒细胞释放组氨酸。tHRF的上调已在肩突硬蜱感染莱姆病螺旋体(Daietal., 2010)和变异革蜱感染蒙特立克次体(Mulengaetal., 2003a)时得以证实。另外,值得一提的是涎液中的钙网结合蛋白基因CRT,该蛋白已从美洲花蜱、变异革蜱D.variabilis(Jaworskietal., 1995) 和微小扇头蜱 (Ferreiraetal., 2002) 以及篦子硬蜱 (Cottéetal., 2014)中得到鉴定。钙网结合蛋白通过与经典补体激活通路的第一组分C1q结合,抑制血栓及补体反应进而影响蜱类吸血和病原体传播(Kimetal., 2015)。同时,具有抗菌特性的5.3 kDa的抗菌肽也可通过蜱类Janus激酶/信号转导子和转录激活因子通路(Janus kinase/signal transducers and activators of transcription signal transduction pathway)进行诱导表达,分泌至蜱类涎液(Pichuetal., 2009)。兰加特病毒(McNallyetal., 2012)、莱姆病螺旋体(Ribeiroetal., 2006)以及嗜吞噬细胞无形体(Liuetal., 2012)对肩突硬蜱的感染可引起该抗菌肽家族基因转录的上调。
4 涎腺与蜱媒疾病的防控
4.1 蜱暴露的分子标记
叮咬是蜱暴露的主要形式,蜱类叮咬人群或动物会在动物体内遗留蜱类活性分子,其中,对于蜱暴露最具有意义的是涎腺及涎液活性分子。早在1990年,通过叮咬注入的涎腺蛋白及其引起的抗体反应就被用作蜱暴露的分子标记(Schwartzetal., 1990)。尽管蜱暴露分子标记对于蜱媒疾病的诊断和风险评价具有重要意义,然而其最大挑战在于蜱类涎液的抗原标记的精准鉴定及其不同种属间区分度;其他媒介生物的涎液分子亦可干扰蜱暴露的分析判断,因而,基于涎液免疫检测的特异性是利用涎液分子标记进行蜱暴露分析的先决条件(Fontaineetal., 2011)。这可能还需要对基于不同蜱种涎液组分的海量数据整体性分析。尽管早在1990年超声破碎的涎腺蛋白抗体已被提议作为人蜱暴露的分子标记,然而,由于这种方法过于简单且特异性很差限制了它在蜱媒病流行病学调查中的应用。后来,重组的钙网蛋白CRT也被用作肩突硬蜱暴露的分子标记,其特异性有所提高,但敏感性仍低于全涎腺蛋白(Sandersetal., 1999)。同时,涎腺蛋白抗体也被用于调查对蜱暴露的影响(Malouinetal., 2003)。对人群而言,蜱类涎腺蛋白抗体还需要考虑效期和交叉反应问题。一般地,涎腺蛋白抗体可在人血清中持续1年半之久(Alarcon-Chaidezetal., 2006),而血红扇头蜱的涎腺蛋白Rs24p抗体在宿主狗体内只有很短时间(Medlocketal., 2013; Liuetal., 2014)。
4.2 候选疫苗抗原
蜱类涎腺分泌的活性分子,除了抗凝、止血、舒张血管的作用(Stibraniovaetal., 2019),涎腺蛋白也是理想的候选疫苗抗原,如蜱类涎腺分泌的粘质蛋白4TRP接种可保护小鼠免受感染蜱的叮咬侵袭(Labudaetal., 2006),这表明,不仅蜱虫粘质的天然和密封剂特性可作为新型医用粘合剂进行开发,而且其粘质蛋白可作为抗蜱虫和病原体传播的潜在疫苗靶标(Suppanetal., 2018)加以应用。抗蜱疫苗和抗病原体疫苗一直是无害化且有效的蜱媒病防治手段。用于控制家畜蜱虫感染的第一批疫苗已于1990年代初上市(de la Fuenteetal., 2007)。这些疫苗,如含有微小扇头蜱BM86或BM95抗原的重组疫苗 (de la Fuenteetal., 2007)等并不能预防蜱虫感染,而是通过影响蜱类对动物吸血、繁殖和发育,降低蜱虫种群密度和蜱传病原体(TBP)的流行率(de la Fuenteetal., 2007)。近来研究发现,蜱源性抗原和病原体源性抗原结合起来可以提高疫苗对TBDs的控制效果(Merinoetal., 2013)。其中,蜱类涎腺蛋白可作为疫苗候选抗原具备阻断病原体传播的潜能,如Salp15 (Daietal., 2009)、TSLPI (Schuijtetal., 2011)、tHRF (Daietal., 2010)、 Salp25D (Wagemakersetal., 2016)以及64TRP (涎腺粘质蛋白) (Labudaetal., 2006)等。这些蛋白的免疫活动,如肩突硬蜱唾液蛋白Salp15和莱姆病螺旋体外膜蛋白OspA/OspC联合免疫对小鼠的免疫保护,比任一抗原单独免疫更有效(Daietal., 2009)。Salp15抗体的产生对病原体,如莱姆病螺旋体的侵染、适应和传播具有显著的抑制作用(Daietal., 2009)。Subolesin也被发现并被描述为一种蜱虫保护性抗原,用于控制肩突硬蜱感染(Almazánetal., 2003, 2005)。而后Subolesin/Akirin被运用于疫苗研制,以控制不同节肢动物的侵扰以及病原体感染/传播(de la Fuenteetal., 2006a, 2011)。Subolesin抗体可通过目前未知的机制进入蜱细胞,并与胞质Subolesin相互作用以防止其转移到细胞核,从而发挥其调节功能(de la Fuenteetal., 2011)。这些结果证明了靶向媒介感染和病原体感染/传播的蜱源性抗原和病原体衍生抗原,应用于控制蜱媒病防控是可行的(de la Fuente和 Contreras, 2015)。因而,基因组学分析及其相关的反向遗传学研究将在解析蜱类涎腺对病原体的感染反应、氧化应激、凋亡、繁殖和存活等功能方面发挥重要作用(Umemiya-Shirafujietal., 2019)。利用基因编辑CRISPR-Cas9等(Sanderetal., 2014)手段,改造蜱类涎腺及其传播蜱媒病原的功能基因,也将是未来实现蜱媒病防治目的的有效手段。
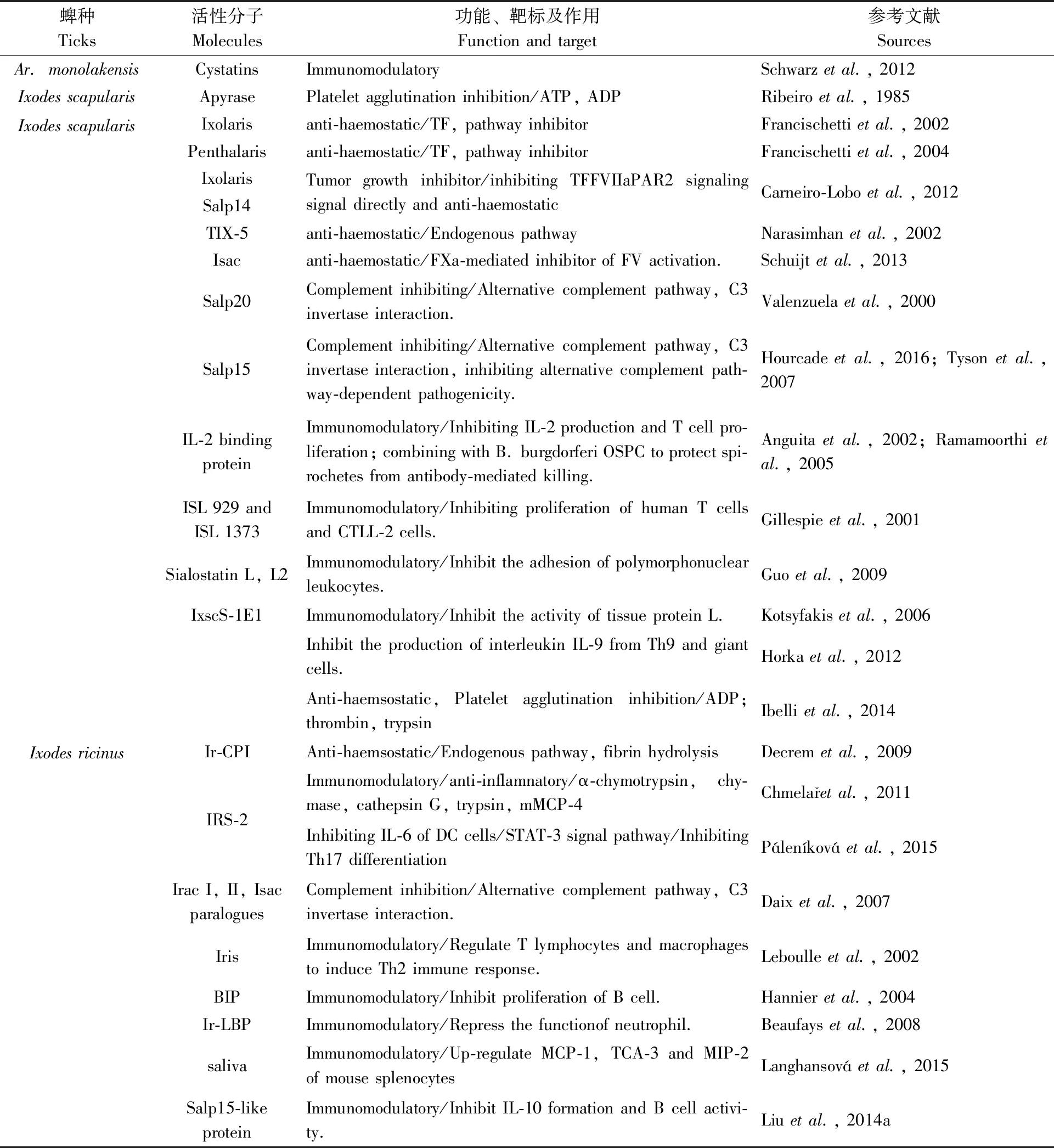
表1 蜱类涎腺活性分子的靶标、功能及其作用Tab.1 Biological activities of tick saliva and salivary molecules in modulation of host defense reactions
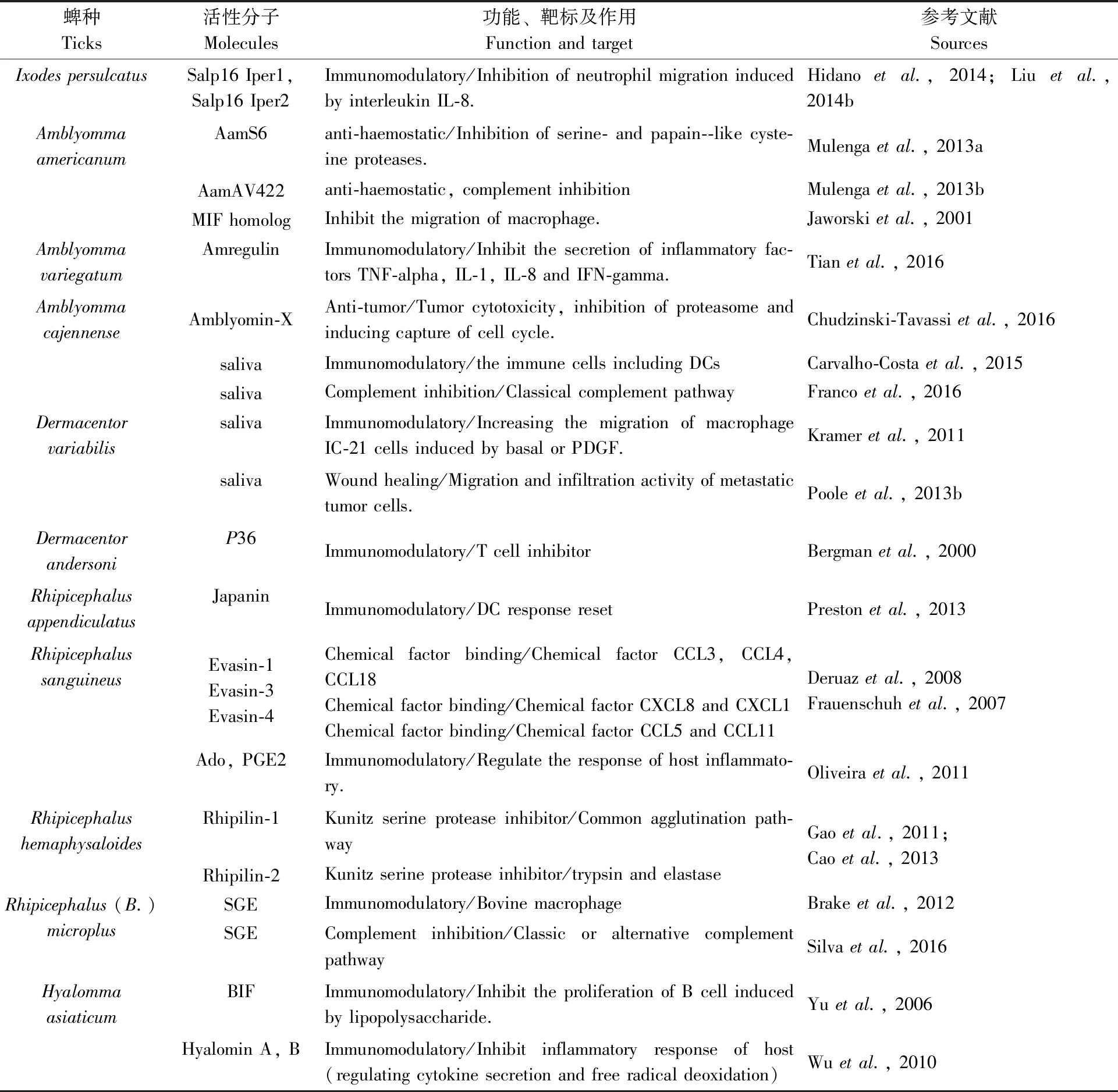
表1续 Tab.l Continued

