祖卡木颗粒通过抑制急性肺损伤大鼠MAPK信号通路抗炎作用机制研究❋
侯帅红, 韩林涛, 周祯祥, 黄 芳, 尹 强,△, 韩祥志, 穆丹丹, 董雨薇
(1.新疆维吾尔药业有限责任公司, 乌鲁木齐 830000;2.湖北中医药大学, 武汉 430000)
炎症反应是一种保护宿主免受全身感染、协助机体恢复组织内稳态的自身反应,可由损伤、感染和刺激所引起[1],因此炎症反应是一种重要的防御机制,对机体健康具有保护作用[2,3]。如果急性炎症反应在程度或持续时间上失常,则可导致众多疾病的发生[1,3]。如上呼吸道感染严重时可引起支气管炎乃至肺炎,失调的急性炎症反应可导致急性肺损伤,进而导致肺纤维化的发生,影响气体间的交换。若病情不能得到及时有效的治疗,可进一步发展为急性呼吸窘迫综合征、哮喘及慢性阻塞性肺疾病等肺部疾病。
祖卡木颗粒(zukamu granules,ZKMG)作为维吾尔医特色制剂,具有调节异常气质及清热、发汗、通窍等功效,用于治疗感冒咳嗽、发热无汗、咽喉肿痛、鼻塞流涕等[4],其适应症属于中医学表证范畴,相当于现代医学上呼吸道感染及传染病初期的症状,多由鼻腔、咽喉部感染病原微生物引起,属黏膜急性炎症。有大量研究表明,ZKMG 具有解热、镇痛、抗炎等功效,无明显毒副作用[5-7]。另外,侯帅红等围绕ZKMG 挥发性成分和网络药理学在线分析方法预测到其发挥抗炎作用可能与花生四烯酸代谢、丝裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)信号通路、核因子-κB(nuclear factor-kappa B,NF-κB)信号通路的激活有关[8],但是还未有相关生物学实验验证。大鼠急性肺损伤模型由于其具有操作简单,模型稳定等优点,目前在评价药物抗炎活性时被广泛使用[9]。本试验通过大鼠急性肺损伤模型,观察ZKMG 对于大鼠肺组织炎性病理损伤的治疗作用,并探讨其抗炎的相关作用机制。本研究已通过湖北中医药大学实验动物伦理委员会批准,伦理批准号HUCMS 201903001。
1 材料与方法
1.1 动物
SD 大鼠6周龄雌雄各半,体质量(200±25) g, 购自湖北省疾控中心,实验动物生产许可证号SCXK(鄂)2015-0018)。适应性饲养3 d,饲养环境为温度22~26 ℃,相对湿度 50%~60%,人工光照明暗各12 h,给予标准饲料和纯净水喂养。
1.2 药物
祖卡木颗粒(ZKMG,新疆维吾尔药业有限责任公司,国药准字Z65050179);脂多糖(lipopolysaccharides,LPS)(Sigma公司,L2630);地塞米松(dexamethasone,DEX)(Sigma公司,D1756)。
1.3 主要试剂
甘油醛-3-磷酸脱氢酶(glyceraldehyde-3-phosphate dehydrogenase ,GAPDH)抗体(CST公司,#2118);p38 MAPK 抗体(Abcam公司,ab170099);磷酸化p38 MAPK 抗体(Abcam公司,ab47363);细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK )抗体(Abcam公司,ab17942);磷酸化ERK 1/2 抗体(Abcam公司,ab201015);c-Jun氨基末端激酶(c-Jun N-terminal kinase,JNK)抗体(Abcam公司,ab179461);磷酸化JNK 抗体(Abcam公司,ab124956);山羊抗兔IgG 抗体(Bioswamp公司,PAB16011)。大鼠(tumor necrosis factor,TNF)-α 定量酶检测试剂盒(bioswamp 公司,RA20035);大鼠白细胞介素(interleukin,IL)-6 试剂盒(bioswamp 公司,RA20607);大鼠IL-1β 试剂盒(bioswamp 公司,RA20020-S)。
1.4 实验方法
1.4.1 LPS 诱导大鼠急性肺损伤[10]适应性饲养结束后第2天,将48只SD 大鼠称重,按随机数字表法随机分为对照组、模型组、阳性药物DEX 组和祖卡木低、中、高剂量组各8只。祖卡木低、中、高剂量组大鼠每日分别给予祖卡木灌胃干预处理(1.35 g/kg,2.7 g/kg,5.4 g/kg,相当于人服用剂量的9 g/60 kg,18 g/60 kg,36 g/60 kg),连续给药5 d,每天1次;对照组和模型组每日采用等体积生理盐水进行灌胃处理,DEX组大鼠仅在第5天进行腹腔给药DEX 处理,给药剂量为5 mg/kg。第5天给药结束1 h后,除空白对照组注射等体积生理盐水外,其他各组大鼠均尾静脉注射LPS(5 mg/kg),诱导大鼠急性肺损伤。6 h后采用10%水合氯醛麻醉大鼠,收集肺组织和肺泡灌洗液(bronchoalveolar lavage fluid,BALF),将肺组织部分置于10%多聚甲醛中固定,另一部分冻存于-80 ℃保存备用。
1.4.2 大鼠肺泡灌洗液收集 LPS 诱导6 h后采用10%水合氯醛麻醉大鼠,打开胸腔分离肺组织,于左主支气管处结扎左肺进行气管插管,采用800 μL生理盐水灌洗右肺反复3次,以回收液体积大于80%表示合格。收集的混合液采用4 ℃1500×g离心5 min,收集上清液,-80 ℃保存。
1.4.3 苏木精-伊红染色法(hematoxylin-eosin staining,HE)观察病理损伤情况 将大鼠肺组织置于10%多聚甲醛中进行固定,然后梯度乙醇脱水、二甲苯透明和浸蜡,对组织样本进行石蜡包埋、切片,切片厚度为5 μm。按照HE 染色试剂盒说明书进行操作,采用光学显微镜观察肺组织形态结构及病理学改变并拍片。
1.4.4 蛋白质印记法(western blot,WB)检测蛋白表达 将大鼠肺组织剪碎并用液氮研磨,收集组织至1.5 mL离心管内,加入适量RIPA(强)裂解液,经组织匀浆和超声处理后置于冰上继续裂解直至裂解完全,经4 ℃ 12000×g离心20 min取上清。采用BCA 蛋白浓度检测法进行总蛋白定量。取20 μg总蛋白进行十二烷基硫酸钠-聚丙烯酰胺凝胶电泳分离蛋白,并转膜至聚偏氟乙烯,使用5%脱脂牛奶(TBST配制)常温封闭处理1.5 h,经TBST洗膜后使用相应的一抗稀释液进行孵育,4 ℃过夜。以兔抗p-JNK(1∶1000)、兔抗JNK(1∶1000)、鼠抗p-ERK1/2(1∶1000)、兔抗ERK1/2(1∶1000)、兔抗p-p38 MAPK(1∶1000)、p38 MAPK(1∶1000)为一抗,羊抗IgG(1∶20000)为二抗分别孵育后,取ECL 发光液A和B等量混匀,加在膜的正面与之充分接触,并使用全自动化学发光分析仪进行检测。
1.4.5 ELISA 检测炎症因子水平 将收集的大鼠BALF上清液,依据酶联免疫吸附测定(enzyme linked immunosorbent assay,ELISA)试剂盒说明书进行操作,测量单位pg/mL,分别检测炎症因子TNF-α、IL-6 和IL-1β 的表达水平。
1.5 统计学方法
2 结果
2.1 ZKMG对急性肺损伤大鼠的肺组织病理形态学影响
图1示,对照组大鼠的肺泡大小均一,肺泡壁较薄,无炎性细胞浸润。模型组大鼠的肺泡壁明显增厚,肺泡大小不均且明显变小,存在大量的炎性细胞浸润。阳性药物DEX 组的肺泡壁仍旧增厚,但较模型组显著降低且肺泡大小有所恢复。不同剂量的ZKMG 处理组也表现出不同程度的炎症反应,但与模型组比较,均表现出不同程度的缓解,其中高剂量ZKMG 组大鼠肺组织的炎症情况改善效果最佳。
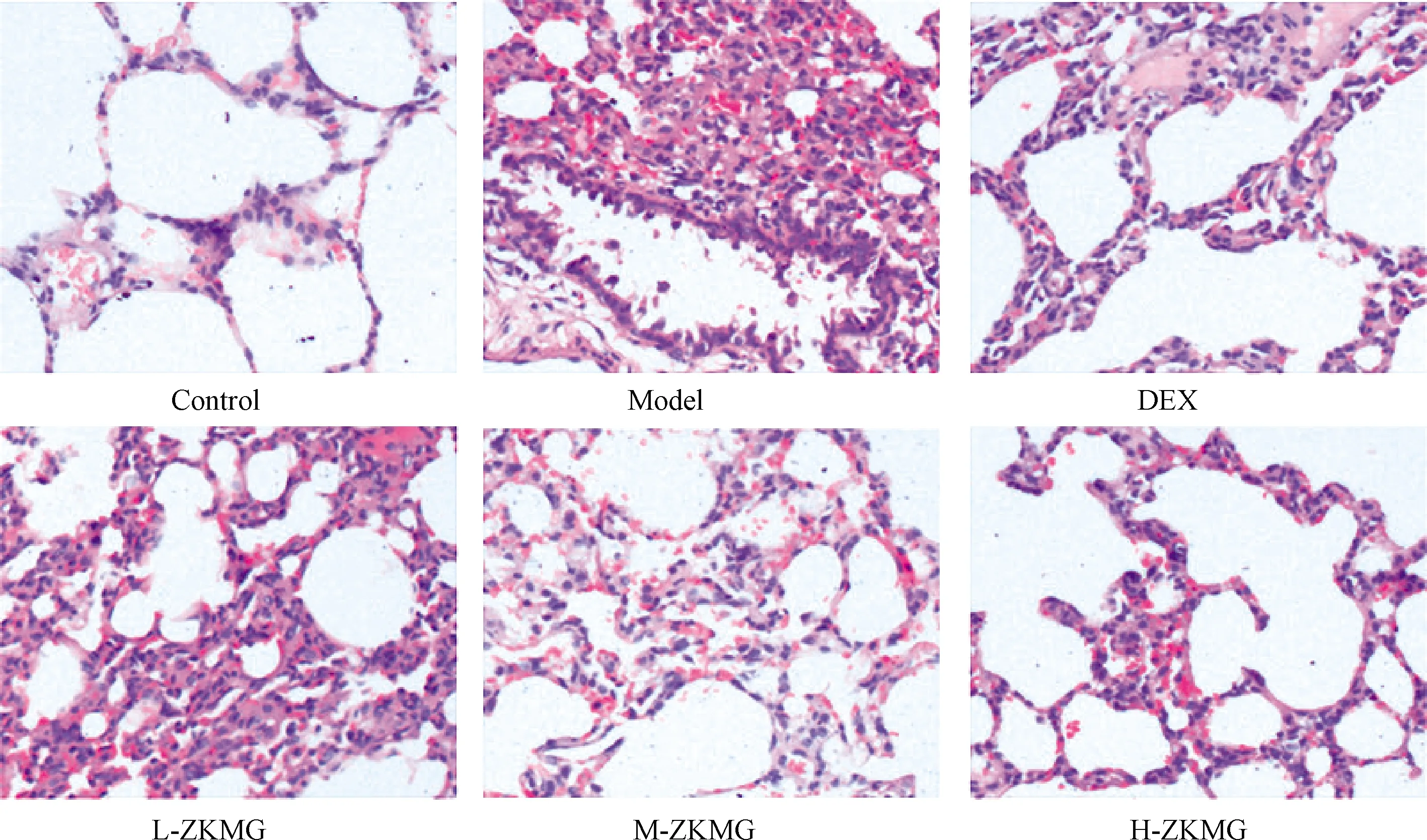
图1 大鼠肺组织的病理形态学检测比较(200×)
2.2 ZKMG 对炎症因子表达水平的影响
图2示,在LPS诱导大鼠急性肺损伤模型中,与正常组比较,模型组大鼠BALF中IL-6、IL-1β和TNF-α 含量急剧增加(P<0.001);与模型组比较,DEX 组及中、高剂量ZKMG 组大鼠BALF 中炎症因子水平均出现不同程度的下降(P<0.05),这些结果表明,中、高剂量ZKMG 能够减少相关炎症因子的表达。
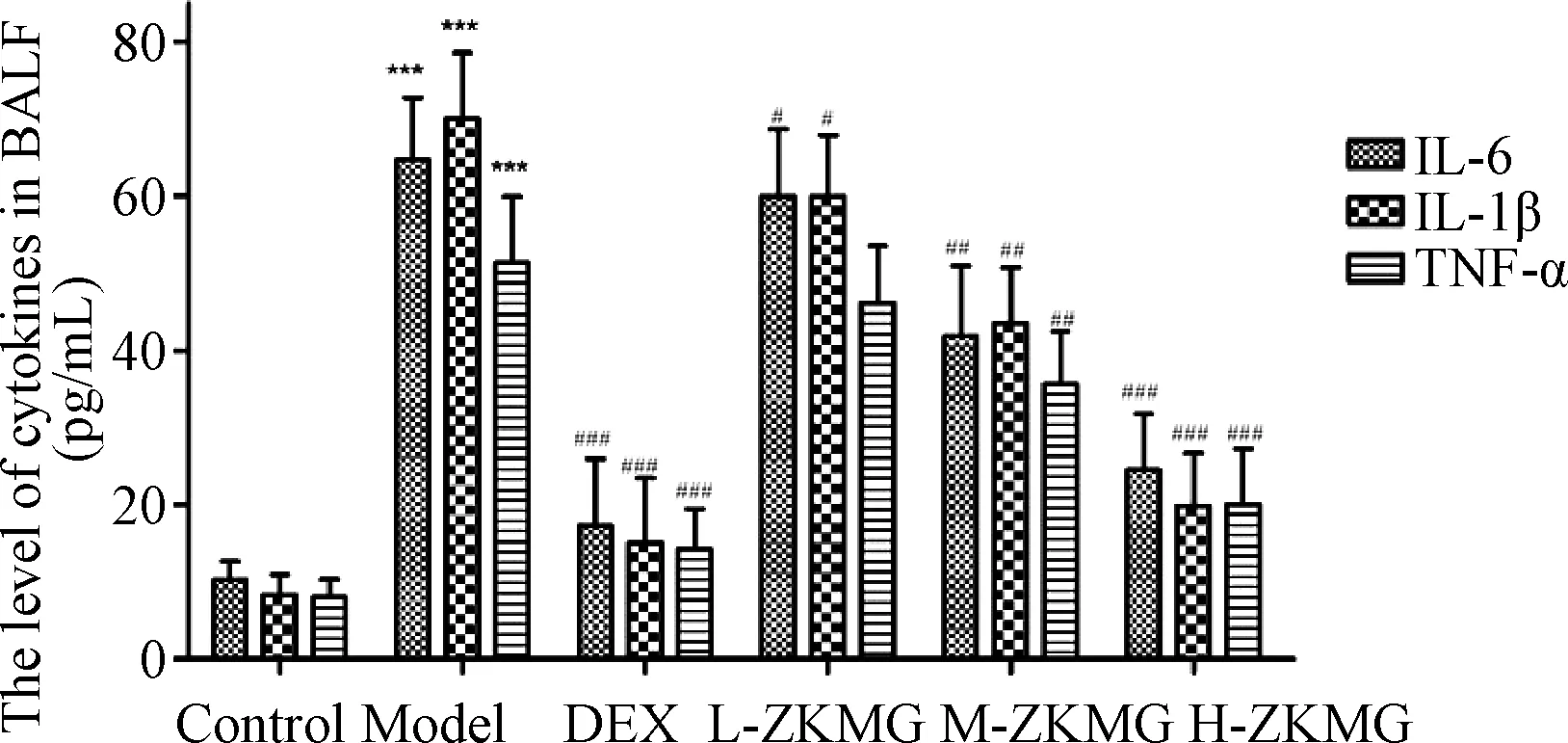
注:与对照组比较:***P<0.001; 与模型组比较:#P<0.05,##P<0.01,###P<0.001图2 大鼠肺泡灌洗液中炎症因子水平比较
2.3 ZKMG 对炎症相关信号通路蛋白的影响
MAPK 家族信号通路是调控炎症发生发展的重要通路之一[11]。为检测ZKMG 是否通过MAPK 信号通路来发挥其抗炎作用,该实验分别对其家族蛋白p38、ERK 和JNK 的磷酸化水平进行了检测。图3示,与对照组比较,模型组大鼠肺组织中p-p38、p-ERK、p-JNK 水平显著升高(P<0.001);与模型组比较,DEX 及ZKMG 各剂量组p-p38、p-ERK、p-JNK 表达量明显降低(P<0.001,P<0.05),提示ZKMG 能够通过抑制MAPK 家族相关蛋白的磷酸化水平来发挥其抗炎作用。

注:与对照组比较:***P<0.001 ; 与模型组比较:#P<0.05;##P<0.01;###P<0.001图3 大鼠肺组织MAPK 家族成员蛋白表达水平比较
3 讨论
MAPK 信号通路是调控细胞多项生命活动的重要信号通路之一,与多种疾病的发生发展紧密相关[12]。在多种因素的刺激下,MAPK 蛋白家族成员发生磷酸化而被激活,进而影响转录因子、酶类和细胞骨架相关蛋白等表达,最终调控细胞增殖、凋亡和炎症反应等多种生命活动。该通路主要包括p38 MAPK、ERK 和JNK 三条经典的信号传导通路,均可参与炎症的调控,可通过促进趋化因子的分泌诱导,造成更多巨噬细胞的活化、募集并产生多种促炎因子分泌,加剧局部的炎症反应[13,14]。且有研究表明,抑制MAPK 信号通路可改善多种炎性损伤[15,16],达到缓解炎症型疾病的作用,因此MAPKs 是一些炎症性疾病的潜在治疗靶点。LPS 能够诱导巨噬细胞中p38 MAPK 和JNK 发生磷酸化,进而促进炎症反应的发生[17]。刘振宁等[18]研究也发现,急性肺损伤大鼠肺组织中存在严重的炎性反应,且与MAPK 信号通路的活化密切相关。在本实验中,急性肺损伤大鼠肺组织中存在严重的炎性损伤,且p-p38、p-ERK 和p-JNK 表达量也明显上升,给予ZKMG 干预治疗后,大鼠急性肺损伤组织中的炎性病理损伤得到了有效改善。
巨噬细胞是吞噬性白细胞,在先天免疫炎症反应中起重要作用。活化的巨噬细胞分泌各种细胞因子,如TNF-α、IL-1β、IL-6和其他炎性细胞因子[19],通过激活适应性免疫反应和恶化炎症反应显示多效性。中药控制炎性细胞因子与抗炎治疗效果存在直接联系,是其抗炎效果发挥的基础条件。其中,TNF-α 是一种重要的促炎介质,参与多种炎症的信号通路,而且可以调节其他炎性细胞因子的合成和释放,促进黏附分子的表达,促进LPS 引发的肺损伤的进展。IL-6主要是刺激免疫细胞的增殖和分化,参与机体的免疫应答,并能有效促进血管内皮细胞对炎症介质及黏附分子的表达,进而增加炎症反应,是一种促炎因子。IL-1β 在免疫调节和炎症反应中起重要作用,它能够促进T细胞和B细胞的增殖分化,对中性粒细胞、巨噬细胞、淋巴细胞有趋化和增强作用,还能够诱导IL-2、IL-6和TNF 等细胞因子的产生,因此它们是检测炎症反应的常见指标。研究发现[20],在急性肺损伤模型中,LPS 能够诱导IL-6、IL-1β和TNF-α 等的合成和分泌。在本试验中,急性肺损伤大鼠BALF 中炎症因子的表达量出现一定程度的升高,与既往研究结果一致。给予中药ZKMG 干预后,模型大鼠BALF 中炎性因子的水平显著下降,且高剂量的ZKMG效果最为显著。
DEX 是临床广泛使用的长效糖皮质激素,常用于治疗炎症、过敏及自身免疫性疾病等。DEX 可以从基因水平调控炎症相关基因的表达,抑制促炎症因子的释放。虽然DEX 具有强效的抗炎作用,但长期服用容易产生毒副作用[21]。ZKMG 是维吾尔医药秘方经改良后研制的复方制剂,由山柰、罂粟壳、洋甘菊、大枣、薄荷、甘草、蜀葵子、睡莲花、大黄、破布木果10 味天然药材组成,具有解热、镇痛和抗炎的作用,已被广泛应用于治疗急性上呼吸道感染等[22-24]。尽管祖卡木的临床疗效已被证实,但其具体抗炎作用机制目前尚不明确,MAPKs 蛋白是否是祖卡木抗炎的作用靶点,目前还未见报道。既往研究发现,薄荷酚类成分和蒙花苷能够抑制MAPK 通路蛋白JNK、ERK1/2、p38 MAPK 的磷酸化水平,减少促炎因子TNF-α、IL-6、IL-1β 的表达量[25]。甘草中多种成分如甘草素、甘草酸、异甘草酸镁、黄烷酮和甘草查而酮均能抑制炎症因子表达和MAPK 相关蛋白的磷酸化水平发挥抗炎活性[26-30]。Feng 等研究发现,大黄通过抑制MAPKs 的激活及炎症介质的表达降低胰腺炎的程度[31]。Hu 等研究发现,芦荟大黄素可显著抑制IL-6和IL-1β 基因的mRNA 表达水平,ERK、p38、JNK 和Akt 的磷酸化来抑制巨噬细胞中LPS 诱导的炎症反应[32]。前人研究显示[33,34],山柰、大枣等也与MAPK 信号通路关系密切。在本试验中,为探究MAPK信号是否参与大鼠急性肺损伤中祖卡木介导的抗炎作用,通过蛋白质印迹评估了ERK、p38 MAPK 和JNK 的磷酸化水平。给予祖卡木各剂量组干预后,p38 MAPK、ERK 和JNK 的磷酸化水平显著降低,提示ZKMG 可能是通过抑制MAPK 信号通路发挥其抗炎效应的。
综上所述,ZKMG 具有显著的抗炎作用,其具体作用机制可能与抑制MAPK 信号通路的活化和炎症因子的释放有关。

