壶瓶碎米荠多糖硫酸化结构修饰及抗氧化活性研究
(张子木 黄秀芳 张 琴 李美东 张 驰 罗 凯
(湖北民族大学生物科学与技术学院,恩施 445000)
壶瓶碎米荠(Cardaminehupingshanensis)是十字花科碎米荠属植物,主要分布于我国湖南省和湖北省。由于其富硒的特性而被熟知和开发利用。目前壶瓶碎米荠的相关研究主要集中在黄酮的抗氧化和多糖的提取方式等方面。例如张春燕等[1]研究表明壶瓶碎米荠含硒粗黄酮对自由基具有一定的清除作用,除超氧阴离子外,其余测定的自由基均显示出良好的抗氧化效果;罗凯等[2]通过响应面法优化了酶法提取壶瓶碎米荠多糖,实验结果得出酶解时间91.8 min,酶解温度57.1 ℃,酶解pH 4.17。在此条件下,碎米荠粗多糖提取率最高。而目前对壶瓶碎米荠多糖进行结构修饰并研究其活性鲜有文献报道。近年来,多糖由于其抗氧化、抗凝血、降血糖、免疫调节和抗肿瘤活性等多种功能和生物活性,在食品和生物医学领域得到了广泛的研究[3-7]。多糖的化学修饰可以提高其内在的生物活性从而产生新的功能性质[8]。多糖的改性方法主要有硫酸酯化、磷酸化、乙酰基化和羧甲基化这4种结构修饰的方法[9]。Chen等[10]对大蒜多糖对其进行磷酸化修饰,大蒜多糖在磷酸化前后均具有清除羟自由基和超氧阴离子的能力。在一定范围内,大蒜多糖浓度越高抗氧化能力越强。且磷酸化后的衍生物具有更强的抗氧化能力;Liu等[11]采用乙酰化修饰了青钱柳多糖,乙酰化青钱柳多糖能显著刺激巨噬细胞增殖,其作用明显强于相应的未改性多糖;Li等[12]利用硫酸基团链接在绿红菇多糖长链上。体外活性实验表明,硫酸化绿红菇多糖具有较好的抗氧化、抗凝血、抗菌和抗肿瘤活性。硫酸化修饰是一种通过硫酸基部分取代羟基来修饰多糖生物活性的有效而简便的方法。多糖硫酸化不仅可以提高其水溶性,而且可以改变多糖链的构象,从而改变其生物活性。尤其是硫酸酯化多糖的抗凝、抗氧化、抗菌和抗肿瘤活性。壶瓶碎米荠多糖本身具有其良好的抗氧化、抑制肿瘤等活性,但水溶性较差。目前鲜有壶瓶碎米荠多糖改性的相关研究,因此本实验针对壶瓶碎米荠多糖进行硫酸化修饰,改善其水溶性特点,并利用硫酸化壶瓶碎米荠多糖研究其清除ABTS自由基、羟自由基、DPPH自由基的能力,以期为深入研究硫酸化壶瓶碎米荠多糖的分子结构和抗肿瘤活性以及壶瓶碎米荠功能食品开发提供参考。
1 材料与方法
1.1 实验材料与试剂
壶瓶碎米荠;三氧化硫-吡啶络合物(SO3-pry)、无水二甲基亚砜;二乙氨基乙基纤维素(DEAE-52);ABTS、DPPH为色谱纯;其他试剂为分析纯。
1.2 壶瓶碎米荠多糖的制备
将壶瓶碎米荠烘干后,用超微粉碎器打粉过100目筛。将处理好的粉与蒸馏水混合均匀(1∶30)后80 ℃煮2.5 h后过滤保留滤液。将滤液减压浓缩至原体积的20%,经过多次除蛋白后,加入无水乙醇进行醇沉。4 ℃静置过夜后离心的得到壶瓶碎米荠粗多糖。将粗碎米荠多糖溶于蒸馏水(5 mg/mL)中,注入二乙氨乙基(DEAE)纤维素-52柱(2.6 cm×30 cm)。随后用蒸馏水洗脱柱。再将滤液进行收集、浓缩、冻干得到壶瓶碎米荠多糖(CHP)。
1.3 壶瓶碎米荠多糖硫酸化
采用三氧化硫-吡啶法[13]并做一定修改。将200 mgCHP溶入60 mL无水二甲基亚砜中,室温搅拌1 h,等待CHP完全分散于无水二甲基亚砜中,再加入不同质量比的三氧化硫-吡啶(CHP∶SO3·Pry=1∶10、1∶15、1∶20、1∶25、1∶30 g/g),将混合物在55 ℃的条件下搅拌2 h,待反应结束后,用冰水浴冷却至室温,并添加1 mol/L的NaOH中和,然后用3 500 u截流量的透析袋用自来水透析2 d后再用蒸馏水透析3 d。透析液取出旋转蒸发后醇沉过夜离心再冷冻干燥,得到冻干硫酸盐壶瓶碎米荠多糖(SCHP)。硫酸化壶瓶碎米荠多糖分别命名为SCHP1-10、SCHP1-15、SCHP1-20、SCHP1-25、SCHP1-30。
1.4 壶瓶碎米荠硫酸多糖特性测定
1.4.1 硫酸化修饰碎米荠多糖取代度测定
用氯化钡-明胶法[14]估算硫酸多糖的硫含量,以硫酸钠为标准品,建立标准曲线。取代度(DS)是每个糖渣上硫酸盐基团的平均数,根据硫含量(S)计算,公式为:

1.4.2 傅里叶变换红外光谱分析
在扫描范围为4 000~400 cm-1的Nicolet is5光谱仪上进行傅里叶变换红外光谱(FTIR)分析。将干燥后的多糖样品与KBr按照1∶150的质量比混匀后真空干燥1 h后,压制成薄片进行FTIR测定。
1.5 抗氧化活性测定
1.5.1 ABTS自由基清除活性
用Hong[15]的方法检测ABTS+·的清除率。ABTS原液由7 mmol/L ABTS水溶液与 4.9 mmol/L过硫酸钾在室温下反应生成。储备液在4 ℃黑暗环境中保存16 h,然后用乙醇稀释,在734 nm处得到吸光度为(0.70±0.02)。将200 μL不同取代度的SCHP与4.0mL稀释的ABTS+·溶液混合,在黑暗中反应6 min立即在734 nm处检测吸光度值。以VC为阳性对照。
式中:A1为4 mL ABTS+200 μL SCHP;A0为4 mL UP水+200 μL SCHP;A2为4 mL ABTS+200 μL UP水。
1.5.2 羟自由基清除活性
参照Dong[16]的方法检测羟自由基清除率,略作修改。将不同取代度的硫酸化壶瓶碎米荠多糖(SCHP)用超纯水配制不同浓度的样液后取2 mL与2.0 mL的0.009 mol/L FeSO4溶液、2.0 mL的0.009 mol/L水杨酸乙醇溶液和2.0 mL的8.8 mmol/L H2O2混合。然后将反应混合物在37 ℃下孵育30 min。测量混合物在510 nm处的吸光度。以VC为阳性对照。
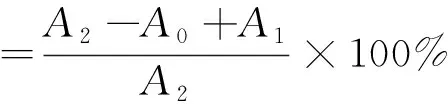
式中:A1为蒸馏水代替H2O2吸光度;A2为蒸馏水代替样品吸光度;A0为样品吸光度。
1.5.3 DPPH自由基清除活性
参照Xiong等[17]的检测方法进行并作修改。DPPH溶液由无水乙醇配制,然后用无水乙醇稀释,在517nm处得到吸光度为(0.6±0.02)。等量添加不同浓度SCHP样液与2×10-5mol/L DPPH溶液充分摇匀。在黑暗环境中反应0.5 h。结束后立即在517 nm处测量吸光度值。VC作为阳性对照。
式中:A1为2 mL多糖样液+2 mL无水乙醇;A2为2 mL DPPH+2 mL蒸馏水;A0为2 mL DPPH+2 mL SCHP
1.6 溶解度测定
将500 μL离心管烘干至恒重后称重,取100 μL蒸馏水加入离心管后称重。每次加入10 mg样品摇匀观察是否溶液饱和。饱和后离心去除上清液烘干至恒重。溶解度计算公式:

1.7 数据处理
所有实验均进行3次平行实验,利用Origin 8.0软件与SPSS 25软件进行统计分析。
2 结果与分析
2.1 取代度分析
分别在1、2、4 d测定标准曲线,取3次平均值。硫酸根与吸光度的回归方程为y=1.341 7x+0.024,R2为0.992 1,方程线性关系良好。根据方程测得样品SCHP1-10、SCHP1-15、SCHP1-20、SCHP1-25、SCHP1-30取代度如图1所示,分别为0.46、0.55、0.69、0.72、0.80。硫酸化多糖的取代度(DS)是一个重要的生物活性参数。在硫酸化改性反应中,酯化剂的用量是影响硫酸化化衍生物DS的关键因素。因此,采用5种不同质量比的多糖与SO3-Pry制备了具有不同DS的硫酸化多糖并对所有多糖的DS进行了分析,结果显示壶瓶碎米荠多糖硫酸化反应呈梯度增加,其中未改性多糖取代度为0,而随着硫酸化改后SO3-Pry剂量的增加多糖的取代度数值逐渐增加,SCHP的DS从0.46增加到0.80,其中SCHP1-30的DS最高。结果显示提高SO3-Pry剂量有利于多糖的硫酸化反应,但随着SO3-Pry剂量的增加多糖的得率出现下降,推测由于过量的SO3-Pry会导致多糖在反应时产生裂解等从而降低了DS硫酸化多糖的得率。
2.2 溶解度分析
在多糖纯化的过程中,纯化程度增加会导致溶解性减小,限制了其使用范围。通过对壶瓶碎米荠多糖进行硫酸化修饰,其水溶性增加明显。如图1所示,未经硫酸化修饰的壶瓶碎米荠多糖溶解度为18.5 g/100 g,而经硫酸化修饰后的壶瓶碎米荠溶解度有很大的提高。根据图1分析发现,经硫酸化修饰后壶瓶碎米荠多糖的溶解度平均提高3倍以上。说明硫酸化修饰壶瓶碎米荠多糖可以提高壶瓶碎米荠多糖的水溶性。但随着硫酸化壶瓶碎米荠多糖取

图1 不同取代试剂用量对壶瓶碎米荠多糖硫酸化改性以及得率的影响
代度的增加,其溶解度变化较小。说明硫酸化程度的增加对进一步提高其溶解度影响较小。
2.3 改性壶瓶碎米荠多糖FTIR分析


图2 壶瓶碎米荠多糖与硫酸化改性壶瓶碎米荠多糖红外光谱检测分析
2.4 硫酸化改性壶瓶碎米荠多糖体外抗氧化活性研究结果
2.4.1 硫酸化改性前后壶瓶碎米荠多糖对ABTS自由基清除活性
ABTS主要用来检测总自由基[19], ABTS原液在避光反应16 h后生成稳定的自由基,反应时,样品如果具有抗氧化性会使ABTS溶液褪色,褪色程度越大证明抗氧化性越好。如图3所示,SCHP随着取代度的增加其抗氧化性也随之增加,SCHP对ABTS自由基的清除率与浓度呈正相关。相对于未改性的壶瓶碎米荠多糖,经过硫酸化修饰后的壶瓶碎米荠多糖对ABTS自由基的清除率有明显的提升,其SCHP1-30的清除能力最好,SCHP1-10清除能力最差。这表明较高取代度的壶瓶碎米荠多糖可以提高对ABTS自由基的清除能力。结果与Seedevi等[20]的研究结果一致,取代度较高的硫酸化多糖对ABTS自由基的清除率较高,但5种不同取代度的硫酸化壶瓶碎米荠多糖对ABTS自由基的清除率均低于50%。

图3 壶瓶碎米荠多糖与硫酸化改性壶瓶碎米荠多糖对ABTS自由基清除率的影响
2.4.2 硫酸化改性前后壶瓶碎米荠多糖对羟自由基清除活性
研究表明羟自由基是所有自由基中最具有攻击性的,主要由线粒体电子传递系统产生[21]。羟自由基在人体中主要与某些蛋白质、核酸和酶类等产生自由基链式反应[22]。并且羟自由基可直接导致细胞膜的损伤从而破坏某些细胞[23]。针对羟自由基的清除是目前预防疾病最好的方法之一[24]。如图4所示,不同取代度的SCHP在一定浓度范围内对羟自由基清除对浓度有一定的相关性,但清除羟自由基的能力并没有完全随着SCHP的取代度的增加而增加。在3 mg/mL的条件下,SCHP1-25的清除率就高于SCHP1-30。而在5 mg/mL的浓度下SCHP1-30的清除率高于SCHP1-25,其IC50也高于SCHP1-25。但是在SCHP1-10~SCHP1-20范围,其清除能力随着取代度的增加而增加。造成这种现象的原因可能是由于高取代度的CHP由于硫酸基团引入过多,造成了多糖长链的分解,从而影响了低浓度SCHP1-30对羟自由基清除能力。随着浓度的提高SCHP对羟自由基清除能力也随之提高,但较高取代度的硫酸化壶瓶碎米荠多糖对羟自由基清除能力比未修饰的壶瓶碎米荠多糖有一定程度的提高,而较低取代度的SCHP1-10、SCHP1-15、SCHP1-20的清除羟自由基能力则低于未修饰的壶瓶碎米荠多糖。SCHP1-25和SCHP1-30的IC50分别为4.60、4.51 mg/mL。其余3种取代度的硫酸化壶瓶碎米荠多糖的IC50由于抑制率过低无法计算。
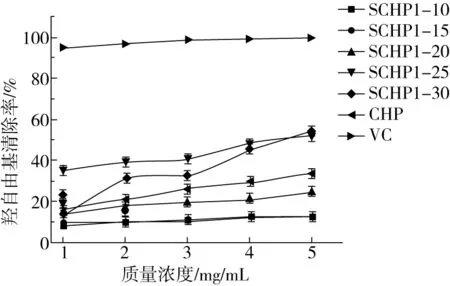
图4 壶瓶碎米荠多糖与硫酸化改性壶瓶碎米荠多糖对羟自由基清除率的影响
2.4.3 DPPH自由基清除活性
DPPH是一种非常稳定的自由基[25],与氧化剂反应,易生成氢离子,其颜色从深紫色变为浅黄色,经过无水乙醇溶解后,在紫外517 nm处有明显的吸收峰,故可利用这一特性检测DPPH的清除率。由图5可见,在1~5 mg/mL的范围中,对DPPH的清除能力随着取代度的增加而增加。其浓度越大清除能力越大。SCHP1-30的清除能力接近VC。相比较于未改性的CHP,经过硫酸化修饰后的CHP在对DPPH清除能力上都有所提高。在中等浓度条件下,改性后的壶瓶碎米荠多糖比未改性壶瓶碎米荠多糖对DPPH清除率也有所提高。即使是较低浓度条件下SCHP1-20、SCHP1-25、SCHP1-30也分别提高了31.5%、50.6%、72.8%。这表明硫酸化修饰有助于提高壶瓶碎米荠多糖的DPPH清除能力,结果与Hu等[26]的研究结果一致。SCHP1-25的IC50由于其构建的方程R2为0.611 3,相关性较差而无法计算,SCHP1-30的IC50在浓度为1mg/mL时的清除率已经达到86.81%,超出计算范围而无法计算。

图5 壶瓶碎米荠多糖与硫酸化改性壶瓶碎米荠多糖对DPPH自由基清除率的影响
3 结论
采用三氧化硫-吡啶法对壶瓶碎米荠多糖进行了硫酸化修饰,并得到了5种不同取代度(0.46~0.80)的硫酸化壶瓶碎米荠多糖。红外结果显示硫酸化修饰成功,其硫酸基团主要连接在壶瓶碎米荠多糖的C-6位上。通过硫酸化修饰壶瓶碎米荠多糖可以在一定程度上提高壶瓶碎米荠多糖抗氧化能力,但其抗氧化活性均不如VC好。硫酸化改性后的壶瓶碎米荠多糖其溶解性得到了较好的改善。研究为后续壶瓶碎米荠多糖的结构以及生物活性研究提供了参考,后续可对硫酸化改性壶瓶碎米荠多糖进行分离纯化、结构鉴定以及抗肿瘤等生物活性的深入研究。

