山萸肉及其不同酒制品的UPLC特征图谱建立及色度值的差异性研究
黄瑶 张雪兰 罗宇琴 邓李红 方朝缵 魏梅

摘 要 目的:建立山萸肉及其不同酒制品的特征圖谱,探讨其色度值的差异性,并进行化学模式识别分析。方法:采用超高效液相色谱法(UPLC)。以马钱苷为参照,绘制10批山萸肉及其20批不同酒制品(酒炖、酒蒸)的UPLC特征图谱;采用《中药色谱指纹图谱相似度评价系统(2012A)》进行相似度评价,确定共有峰;采用分光测色仪测定其色度值[明暗度(L)、红绿色调值(a)、黄蓝色调值(b)、色差值(ΔE)];采用SPSS 20.0、SIMCA 14.0软件进行聚类分析、主成分分析、偏最小二乘法-判别分析,并以特征峰峰面积、色度值为指标,以变量重要性投影值大于1为标准,筛选影响饮片质量的差异标志物。结果:山萸肉饮片有6个共有峰,酒萸肉(酒炖)饮片和酒萸肉(酒蒸)饮片有7个共有峰;指认了其中没食子酸、5-羟甲基糠醛、莫诺苷、马钱苷等4个成分,其中5-羟甲基糠醛为炮制后的新增成分。山萸肉与不同酒制品(酒炖、酒蒸)的相似度较低(0.869~0.937、0.845~0.944),而不同酒制品的相似度均高于0.99。山萸肉饮片与酒萸肉(酒炖)饮片的ΔL为-9.42~-3.58、Δa为-24.92~-15.00、Δb为-11.33~-7.00、ΔE为17.01~28.12,山萸肉饮片与酒萸肉(酒蒸)饮片的ΔL为-8.58~-2.42、Δa为-25.08~-13.83、Δb为-10.92~-6.08、ΔE为15.58~28.67,酒萸肉(酒炖)饮片与酒萸肉(酒蒸)饮片的ΔL为-2.17~3.00、Δa为-0.75~2.50、Δb为0.25~1.42、ΔE为1.25~3.83。聚类分析结果显示,30批样品可聚为两类,S1~S10聚为一类、S11~S30聚为一类。主成分分析结果显示,前两个主成分的累积方差贡献率为83.147%。偏最小二乘法-判别分析结果显示,莫诺苷、5号峰、色度值(L、a、b)为影响其质量的差异标志物。结论:所建UPLC特征图谱稳定、可行,结合色度值差异可快速鉴别山萸肉及其不同酒制品;所建化学模式可用于区分不同酒制品。
关键词 山萸肉饮片;酒制品;超高效液相色谱法;特征图谱;色度值;聚类分析;主成分分析;偏最小二乘法-判别分析
ABSTRACT OBJECTIVE: To establish characteristic chromatogram of Cornus officinalis and its different wine-processed products, investigate the differences of chromaticity values, and analyze them with chemical pattern recognition technology. METHODS: UPLC method was adopted. Using loganin as reference, UPLC characteristic chromatograms were drawn for 10 batches of C. officinalis and 20 batches of different wine-processed products (stewing with wine, steaming with wine). TCM Fingerprint Similarity Evaluation System (2012A edition) was used for similarity evaluation, and common peaks were confirmed. The chromaticity values [lightness (L), red and green tone value (a), yellow and blue tone value (b), color difference value (ΔE)] were determined by spectrophotometer. SPSS 20.0 and SIMCA 14.0 software were used for cluster analysis, principal component analysis and partial least squares-discriminant analysis; taking the area of characteristic peak and chromaticity value as indexes, and the variable importance projection greater than 1 as the standard, the difference markers affecting its quality were screened. RESULTS: There were 6 common peaks in the chromatograms for decoction piece of C. officinalis, 7 common peaks for wine-processed C. officinalis (stewing with wine) and wine-processed C. officinalis (steaming with wine). Four components were identified as gallic acid, 5-hydroxymethylfurfural, morroniside, loganin. 5-hydroxymethylfurfural was produced after processing. The similarity between C. officinalis and different wine-processed products (stewing and steaming with wine) was low (0.869-0.937, 0.845-0.944), but the similarity between different wine-processed products was higher than 0.99. ΔL, Δa, Δb and ΔE of C. officinalis decoction pieces and wine-processed C. officinalis decoction pieces (stewing in wine) were -9.42--3.58, -24.92- -15.00, -11.33- -7.00 and 17.01-28.12, respectively. ΔL, Δa, Δb and ΔE of C. officinalis decoction pieces and wine-processed C. officinalis (steaming in wine) decoction pieces were -8.58--2.42, -25.08--13.83, -10.92--6.08, 15.58-28.67. ΔL, Δa, Δb and ΔE of wine-processed C. officinalis decoction pieces (stewing and steaming with wine) were -2.17-3.00, -0.75-2.50, 0.25-1.42 and 1.25-3.83, respectively. Results of cluster analysis showed that 30 batches of sample were clustered into two categories, S1-S10 were clustered into one category, and S11-S30 were clustered into other category. Principal component analysis showed that cumulative contribution rate of former two main components was 83.147%. Results of partial least squares-discriminant analysis showed that morroniside, No.5 peak and chromaticity values (L, a, b) were the difference markers affecting its quality. CONCLUSIONS: Established UPLC characteristic chromatogram is stable and feasible, and can be used to rapidly identify C. officinalis and its different wine-processed products. Established chemical mode can be used to identify different wine-processed products.
KEYWORDS Cornus officinalis decoction piece; Wine-processed products; UPLC; Characteristic chromatogram; Chromaticity value; Cluster analysis; Principal component analysis; Partial least squares-discriminant analysis
中图分类号 R284 文献标志码 A 文章编号 1001-0408(2021)02-0206-08
DOI 10.6039/j.issn.1001-0408.2021.02.14
山茱萸为山茱萸科植物山茱萸Cornus officinalis Sieb. et Zucc.的干燥成熟果肉,始载于《神农本草经》[1],具有补益肝肾、收涩固脱的功效,主要用于治疗眩晕耳鸣、腰膝酸痛、阳痿遗精、遗尿尿频、崩漏带下、大汗虚脱、内热消渴等症[2]。2020年版《中国药典》(一部)收载有山萸肉和酒萸肉等两种饮片[2]。现代研究表明,山萸肉饮片长于敛汗固脱,其降血糖、抗凝血、抗心律失常作用较强;而酒制品补益肝肾作用较强,常入滋补方剂[3]。可见,山茱萸不同炮制品功效差异较大,临床不宜混用。
2020年版《中国药典》(一部)中记载,酒萸肉饮片的炮制方法为酒炖或酒蒸[2]。安徽、北京、云南、浙江等地多采用酒蒸,而江苏、广西则多采用酒炖[3]。2020年版《中国药典》(一部)中对酒萸肉饮片的外观性状描述为“形如山茱萸,表面紫黑色或黑色,质滋润柔软,微有酒香气”[2]。中药成分复杂,在炮制的动态过程中,随着饮片色泽加深,化学成分的组成与含量也随之变化。在传统的中药炮制中,多以饮片外观性状、色泽作为炮制终点的判别指标,但主观性较强,易导致不同产地酒萸肉饮片的质量差异较大[4-6]。
2020年版《中国药典》(一部)对山萸肉和酒萸肉的鉴别项、检查项、浸出物项规定均相同,未有明确区分;虽然两者的含量测定采用同种指标成分,但以不同限度进行要求[2]。鉴于两者颜色均较深,指标成分均为马钱苷和莫诺苷,且酒萸肉的规定限度低于山萸肉,若存在混用情况,仅通过观察饮片的外观性状、色泽,则无法较好地对两者进行区分。目前,关于山萸肉的研究主要涉及其饮片炮制前后特征成分的含量变化[7-10],而应用视觉分析仪客观量化饮片外观色泽,同时结合其特征图谱快速鉴别的研究较少。基于此,本研究采用超高效液相色谱法(UPLC)建立山萸肉及其不同酒制品饮片的特征图谱,同时结合色差原理测定其色度值;采用聚类分析、主成分分析、偏最小二乘法-判别分析等化学模式识别进行分析,旨在为山萸肉饮片及其不同酒制品饮片的快速鉴别及质量综合评价提供参考。
1 材料
1.1 仪器
实验所用仪器有:H-class 型UPLC仪(包括QSM型四元溶剂管理器、SM-FTN型样品管理器、CH-A型高温柱温箱、光电二极管阵列检测器,美国Waters公司)、TS7600型分光测色仪(深圳市三恩时科技有限公司)、XP26型百万分之一分析天平和ME204E型万分之一分析天平(瑞士Mettler Toledo公司)、Milli-Q Direct 8型超纯水系统(德国Merck公司)、KQ-500DE型数控超声波清洗器(昆山市超声仪器有限公司)、H22-X3型电陶炉(杭州九阳生活电器有限公司)。
1.2 藥品与试剂
没食子酸对照品(批号110831-201906,纯度91.5%)、5-羟甲基糠醛对照品(批号111626-201912,纯度99.2%)、莫诺苷对照品(批号111998-201703,纯度97.4%)、马钱苷对照品(批号111640-201808,纯度99.0%)均购自中国食品药品检定研究院;乙腈、磷酸均为色谱纯,其余试剂均为分析纯,水为超纯水。
10批山茱萸药材经广东一方制药有限公司魏梅主任药师鉴定为山茱萸科植物山茱萸C. officinalis Sieb. et Zucc.的干燥成熟果实。样品信息来源见表1。
2 方法与结果
2.1 山萸肉、酒萸肉饮片的制备
按2020年版《中国药典》(一部)[2]“山茱萸”项下饮片炮制方法进行炮制:分别取10批山茱萸药材各200 g,除去杂质和残留果核,得山萸肉饮片(编号S1~S10)。取山萸肉饮片,按2020年版《中国药典》(四部)通则“0213酒炖法或酒蒸法”[11]炖或蒸至黄酒吸尽,取出,干燥,得酒萸肉饮片(酒炖饮片编号S11~S20;酒蒸饮片编号S21~S30)。
2.2 UPLC特征图谱的建立
2.2.1 色谱条件 以ACQUITY UPLC BEH C18(150 mm×2.1 mm,1.7 μm)为色谱柱;以乙腈(A)- 0.2%磷酸水溶液(B)为流动相梯度洗脱(0~3 min,2%A→8%A;3~9 min,8%A→15%A;9~13 min,15%A→23%A;13~19 min,23%A→100%A;19~24 min,100%A→2%A);检测波长为260 nm;流速为0.2 mL/min;柱温为25 ℃;进样量为1 μL。
2.2.2 混合对照品溶液的制备 取没食子酸、5-羟甲基糠醛、莫诺苷、马钱苷对照品适量,精密称定,加80%甲醇制成上述成分质量浓度分别为51.68、61.70、50.49、48.43 μg/mL的混合对照品溶液。
2.2.3 供试品溶液的制备 取山萸肉饮片粉末(过三号筛,下同),约0.2 g,精密称定,置于具塞锥形瓶中,精密加入50%甲醇20 mL,密塞,称定质量,超声(功率500 W,频率40 kHz)处理30 min,取出,放冷,再次称定质量,用50%甲醇补足减失的质量,摇匀,以5 000 r/min离心5 min,取上清液,经0.22 μm微孔滤膜滤过,取续滤液,即得。
2.2.4 精密度考察 取“2.2.3”项下供试品溶液适量(编号S1),按“2.2.1”项下色谱条件连续进样测定6次,记录色谱图。以马钱苷(4号峰)为参照,计算各共有峰的相对保留时间和相对峰面积。结果,6个共有峰相对保留时间和相对峰面积的RSD均小于3%(n=6),表明方法精密度良好。
2.2.5 重复性考察 取山萸肉饮片粉末(编号S1),约0.2 g,共6份,精密称定,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,记录色谱图。以马钱苷(4号峰)为参照,计算各共有峰的相对保留时间和相对峰面积。结果,6个共有峰相对保留时间和相对峰面积的RSD均小于3%(n=6),表明方法重复性良好。
2.2.6 稳定性考察 取“2.2.3”项下供试品溶液适量(编号S1),分别于室温下放置0、2、4、8、10、12、16、20、24 h时按“2.2.1”项下色谱条件进样测定,记录色谱图。以马钱苷(4号峰)为参照,计算各共有峰的相对保留时间和相对峰面积。结果,6个共有峰相对保留时间和相对峰面积的RSD均小于3%(n=9),表明供试品溶液于室温下放置24 h内稳定性良好。
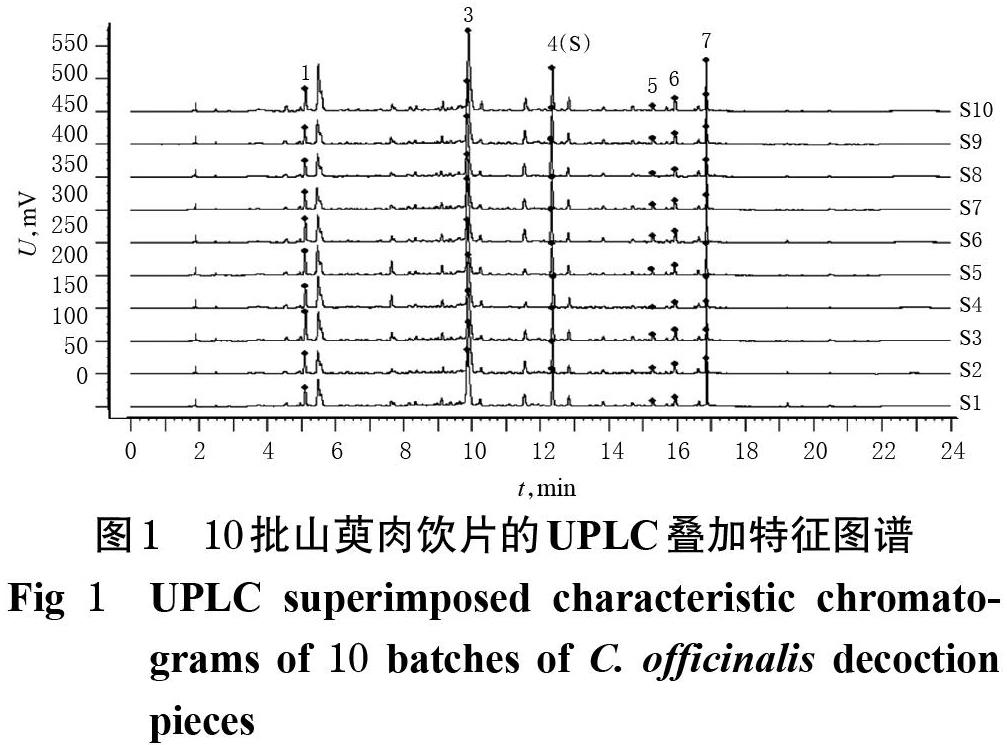
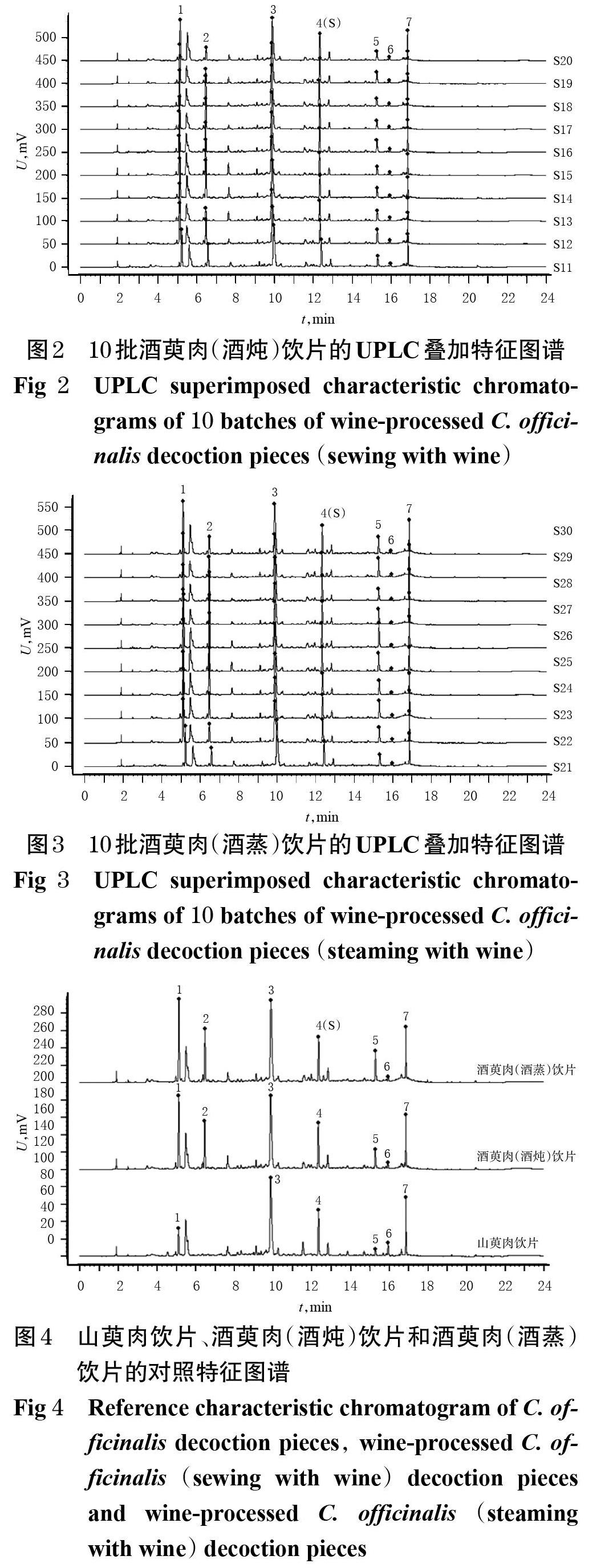
2.2.7 UPLC特征图谱建立 取10批山萸肉饮片、10批酒萸肉(酒炖)饮片和10批酒萸肉(酒蒸)饮片样品,按“2.2.3”项下方法制备供试品溶液,再按“2.2.1”项下色谱条件进样测定,采用《中药色谱指纹图谱相似度评价软件(2012A)》对色谱图进行共有峰匹配,以编号为S1 的山萸肉饮片色谱图为参照图谱,将时间窗宽度设为0.1 min,采用多点校正法进行色谱峰匹配,得UPLC叠加特征图谱,详见图1~图3;选择中位数法生成山萸肉、酒萸肉(酒炖、酒蒸)饮片的对照特征图谱,详见图4。
2.2.8 共有峰指认 10批山萸肉饮片色谱图中有6个共有峰,酒萸肉(酒炖)饮片和酒萸肉(酒蒸)饮片有7个共有峰;通过与混合对照品(见图5,按“2.2.1”项下色谱条件进样分析所得)比对,共指认了其中4个共有峰,分别为没食子酸(1号峰)、5-羟甲基糠醛(2号峰)、莫诺苷(3号峰)、马钱苷(4号峰)。考虑到各特征峰与参照峰保留时间相差太大,不同批次样品特征图谱中的特征峰的相对保留时间结果易产生偏差,故以马钱苷(4号峰)为参照计算其余共有峰的相对保留时间和相对峰面积。
2.2.9 特征图谱比较 由图1可知,10批山萸肉饮片均未检测到2号峰(5-羟甲基糠醛),提示2号峰为酒制后的新增成分;炮制前后饮片的图谱中,5号峰和6号峰的规律明显,其中5号峰在山萸肉饮片中峰面积较小、响应值较低,而在酒制品中峰面积明显增大,提示该峰在炮制过程中含量呈上升趋势;6号峰则相反。
2.2.10 相似度评价 采用《中药色谱指纹图谱相似度评价软件(2012A)》对10批山萸肉饮片、10批酒萸肉(酒炖)饮片和10批酒萸肉(酒蒸)饮片色谱图进行相似度评价。结果,10批山萸肉饮片、10批酒萸肉(酒炖)饮片和10批酒萸肉(酒蒸)饮片的特征图谱与各自相应对照特征图谱的相似度均大于0.98;同批次山萸肉饮片与不同酒制品之间图谱的相似度较低(0.869~0.937、0.845~0.944),而同批次山萸肉饮片制备的不同酒制品饮片之间图谱的相似度均大于0.99,表明山萸肉饮片炮制前后图谱相似度存在一定差异,但不同酒制法炮制的饮片相似,详见表2、表3。
2.3 山萸肉饮片及其不同酒制品色度值的测定
2.3.1 色度值测定 Lab 模式是由国际照明委员会(CIE)于1976 年公布的一种色彩模式,是CIE确定的一个理论上包括了人眼可见的所有色彩的色彩模式[12]。其中,明暗度值(L)越大表示越白,越小表示越黑;红绿色调值(a)表示從红色到绿色的范围,正值为红色方向、负值为绿色方向;黄蓝色调值(b)表示从黄色到蓝色的范围,正值为黄色方向、负值为蓝色方向[12]。
分别取10批山萸肉饮片、10批酒萸肉(酒炖)饮片和10批酒萸肉(酒蒸)饮片,采用相当于6 504 k自然光的D65光源,以A4白纸为背景,采用分光测色仪测得山萸肉饮片及不同酒制品饮片图像(图略)和山萸肉饮片(LSZ、aSZ、bSZ)、酒萸肉(酒炖)饮片(LJD、aJD、bJD)和酒萸肉(酒蒸)饮片(LJZ、aJZ、bJZ)的色度值参数,每个样品平行测定3 次,取平均值;同时,测定A4白纸的色度值(L0、a0 、b0),根据色差公式[12]:色差值(ΔE)=(ΔL2+Δa2+Δb2)1/2;亮度差异(ΔL)=L样品-L0。红/绿差异(Δa)=a样品-a0;黄/蓝差异(Δb)=b样品-b0,计算山萸肉饮片的ΔES、酒萸肉(酒炖)饮片的ΔED、酒萸肉(酒蒸)饮片的ΔEZ,结果见表4。由表4可知,10批山萸肉饮片的LSZ为25.33~31.25、aSZ为15.83~27.33、bSZ为8.92~13.58、ΔES为31.18~43.16;10批酒萸肉(酒炖)饮片的LJD为19.92~22.25、aJD为0.42~3.25、bJD为1.25~2.25、ΔED为20.02~22.49;10批酒萸肉(酒蒸)饮片的LJZ为20.08~24.83、aJZ为2.00~3.17、bJZ为2.17~3.25、ΔEZ为20.38~25.13;其中山萸肉饮片和不同酒制品饮片的色度值参数和色差值均差异较大,而不同酒制品饮片的色度值参数和色差值差异较小。
同时,根据上述公式计算山萸肉饮片与酒萸肉(酒炖)饮片的ΔESD、山萸肉饮片与酒萸肉(酒蒸)饮片的ΔESZ、酒萸肉(酒炖)饮片与酒萸肉(酒蒸)饮片的ΔEDZ。当两个样品之间的ΔE为6~12个色差单位(1 ΔE=1 NBS)时,其色差可被肉眼识别;当色差单位>12时,则色差显著[13],结果见表5。由表5可知,山萸肉饮片与酒萸肉(酒炖)饮片的ΔLSD为-9.42~-3.58、ΔaSD为-24.92~-15.00、ΔbSD为-11.33~-7.00、ΔESD为17.01~28.12,山萸肉饮片与酒萸肉(酒蒸)饮片的ΔLSZ为-8.58~-2.42、ΔaSZ为-25.08~-13.83、ΔbSZ为 -10.92~-6.08、ΔESZ为15.58~28.67,表明炮制前后山萸肉饮片的色差变化由肉眼可观察到。酒萸肉(酒炖)饮片与酒萸肉(酒蒸)饮片的ΔLDZ为-2.17~3.00、ΔaDZ为 -0.75~2.50、ΔbDZ为0.25~1.42、ΔEDZ为1.25~3.83,表明不同酒制品之间的色差变化无法由肉眼识别。
2.3.2 方差分析 采用SPSS 20.0软件对山萸肉饮片及不同酒制品饮片的7个特征峰的峰面积和饮片色度值进行单因素方差分析,P<0.05为差异有统计学意义。结果,山萸肉饮片与不同酒制品饮片的特征图谱中4号和7号峰的峰面积比较,差异均无统计学意义(P>0.05);不同酒制品饮片特征图谱的1、2、5号峰的峰面积显著大于山萸肉饮片,6号峰的峰面积及L、a、b值均显著低于山萸肉饮片(P<0.05);酒萸肉(酒蒸)饮片特征图谱中的1、3、5号峰的峰面积和L值均显著高于酒萸肉(酒炖)饮片(P<0.05),详见表6。
2.4 聚类分析
将10批山萸肉饮片、10批酒萸肉(酒炖)饮片和10批酒萸肉(酒蒸)饮片的共有峰峰面积和色度值数据导入SIMCA 14.0软件进行聚类分析,以Euclidean 平方距离为测度。结果,30批样品可聚为2类,S1~S10聚为一类、S11~S30聚为一类,详见图6。
2.5 主成分分析
将10批山萸肉饮片、10批酒萸肉(酒炖)饮片和10批酒萸肉(酒蒸)饮片的共有峰峰面积和色度值数据导入SPSS 20.0软件和SIMCA 14.0软件进行主成分分析,以特征值>1为判断标准[14]。特征值和方差贡献率见表7,主成分分析得分散点图见图7。由表7可知,共提取2个主成分,主成分1、主成分2的累积方差贡献率为83.147%,表明这2个主成分可作为样品的评价指标。由图7可知,山萸肉饮片和酒萸肉饮片区分明显;而酒萸肉(酒炖)饮片和酒萸肉(酒蒸)饮片的部分样品相互重叠,无法较好的区分,与聚类分析结果基本一致。
2.6 偏最小二乘法-判别分析
为进一步区分不同酒制品饮片,在主成分分析模型構建的基础上,采用SIMCA 14.0软件进行偏最小二乘法-判别分析,结果见图8。由图8可知,山萸肉饮片可与酒萸肉饮片很好的区分;不同酒制品饮片可完全区分,其中酒萸肉(酒炖)饮片位于得分图的左上象限,酒萸肉(酒蒸)饮片位于得分图的左下象限。
变量投影重要性指标(VIP)表示各变量在区分样品中的贡献程度,以VIP>1.0为指标筛选对分组具有显著贡献的变量[14]。采用SIMCA 14.0软件进行偏最小二乘法-判别分析后,得到各色谱峰峰面积和色度值数据的VIP值。结果,VIP>1.0的指标有3号峰(莫诺苷)、5号峰、色度值(L、a、b),提示上述指标可作为影响山萸肉饮片及其不同酒制品饮片质量的差异标志物,详见图9。
3 讨论
本课题组前期分别考察了不同提取溶剂(水、50%甲醇、80%甲醇、甲醇)的提取效果。结果发现,不同极性溶剂在超声提取时对图谱的整体峰型和色谱峰数量的影响较小,综合考虑提取能力、不同提取溶剂图谱的总峰面积和各色谱峰峰形,最终选择50%甲醇为提取溶剂。同时,本课题组又对不同提取方式(超声提取、加热回流提取)、不同提取时间(30、45、60 min)进行了考察。结果发现,超声提取、加热回流提取以及不同提取时间得到的供试品特征图谱各特征峰的总峰面积差异较小,综合考虑操作的简便性和资源的利用率,最终选择50%甲醇超声提取30 min。
本研究结果显示,山萸肉饮片中未检测到5-羟甲基糠醛,该成分可能为酒制后的新增成分。有研究表明,氨基化合物(蛋白质和氨基酸)与还原糖类成分在一定条件下可发生美拉德反应而生成5-羟甲基糠醛[15];同时,在中药炮制与贮藏的动态研究中发现,随着饮片色泽加深,5-羟甲基糠醛的含量也显著升高[16]。这表明5-羟甲基糠醛的产生可能与山萸肉炮制过程中成分和色泽的变化具有相关性,这一现象可作为山萸肉饮片与其不同酒制品饮片的特征性差异,但仍有待相关研究进一步证实。此外,山萸肉炮制前后饮片的5、6号峰呈现出较明显的变化,其中5号峰在山萸肉饮片中峰面积较小、响应值较低,该特征峰在炮制过程中峰面积增大,而6号峰则相反,这一特征性亦可作为山萸肉饮片及其不同酒制品饮片的鉴别点之一,其原因是山萸肉炮制后成分互相转化还是成分受热分解所致,尚仍有待进一步研究。
方差分析结果显示,山萸肉饮片及其不同酒制品饮片特征图谱中部分特征峰峰面积和部分色度值具有显著性差异,提示山萸肉饮片经不同方法炮制前后,其化学成分含量及色度值均存在差异。聚类分析结果显示,30批样品可聚为两类,即S1~S10聚为一类、S11~S30聚为一类。主成分分析结果显示,前两个主成分的累积方差贡献率为83.147%,且山萸肉饮片与不同酒制品饮片可被完全区分,但不同酒制品饮片区分不明显,提示所建立化学模式的分析和预测能力有限。偏最小二乘法-判别分析结果显示,山萸肉饮片、不同酒制品饮片(酒炖、酒蒸)均能明显区分,莫诺苷、5号峰和色度值(L、a、b)为影响其质量的差异标志物。
综上所述,所建UPLC特征图谱稳定、可行,结合色度值差异可快速鉴别山萸肉饮片及其不同酒制品饮片;所建化学模式可用于区分不同酒制品饮片,莫诺苷、5号峰和色度值参数可作为差异标志物。
参考文献
[ 1 ] 朱敏,刘志辉,姚毅,等.山萸肉炮制前后4种环烯醚萜苷类成分的含量变化研究[J].中国药房,2014,25(47):4464-4466.
[ 2 ] 国家药典委员会.中华人民共和国药典:一部[S]. 2020年版.北京:中国医药科技出版社,2020:29-30.
[ 3 ] 张嘉妮,戴冰,李玉星,等.酒制山茱萸炮制研究进展[J].中国现代应用药学,2016,33(12):1604-1608.
[ 4 ] 陆艳,张雨霏,杨光明,等.山茱萸炮制过程中的红外光谱与美拉德反应[J].南京中医药大学学报,2016,32(1):79-82.
[ 5 ] 朱梅芬,刘向前,吴柱熹,等.地黄的炮制对梓醇和5-羟甲基糠醛含量的影响[J].中国中药杂志,2007,32(12):1155- 1157.
[ 6 ] 郭艳霞.美拉德反应与地黄炮制机理的关系研究[D].济南:山东大学,2012.
[ 7 ] 王丽灵,庞会明,郑啸,等.山萸肉炮制前后11种成分的变化[J].药物分析杂志,2016,36(4):624-631.
[ 8 ] 常增荣,李姣,郝博,等.中药山茱萸炮制前后特征化学成分的分析[J].药物分析杂志,2015,35(2):338-343.
[ 9 ] 晏朝操.炮制前山萸肉和炮制后酒萸肉的化学成分鉴别与分析[J].现代医学与健康研究,2018,2(6):177.
[10] 贾红梅,庾延和,于猛,等.基于化学计量学的酒萸肉特征性成分识别及定量测定[J].中草药,2020,51(5):1294- 1301.
[11] 国家药典委员会.中华人民共和国药典:四部[S]. 2020年版.北京:中国医药科技出版社,2020:31-32.
[12] 张宏建. Lab色彩模式在图像处理中的应用[J].福建电脑,2011,27(1):146-147.
[13] 张雪,李晓庆,王云,等.焦栀子炒制过程中HPLC图谱变化与外观颜色的动态关联研究[J].中草药,2018,49(17):4029-4037.
[14] 张崇佩,张依欣,李潮,等.不同年份吴茱萸UPLC指纹图谱及多成分化学模式识别研究[J].中草药,2019,50(11):2700-2707.
[15] 徐芳辉,胡志成,易欣宜,等. 5-羟甲基糠醛在中药质量标准中的应用现状[J].中国医药导报,2017,14(15):47-50.
[16] 吴翠.中药变色和贮藏过程中5-羟甲基糠醛等理化指标的分析研究[D].北京:中国中医科学院,2018.
(收稿日期:2020-09-14 修回日期:2020-12-02)
(编辑:陈 宏)

