3份木薯新种质抗细菌性萎蔫病机理初探
林兆威 李超萍 蔡吉苗 时涛 黄贵修
摘 要:木薯细菌性萎蔫病(cassava bacterial blight, CBB)是当前国内木薯生产上最为严重的病害。为了明确抗细菌性萎蔫病木薯种质的抗病机理,本研究比较木薯抗感种质叶片的自身组织结构,与木薯细菌性萎蔫病菌(Xanthomonas axonopodis pv. manihotis, Xam)互作过程中组织结构和生理生化物质变化的差异。结果发现,在叶片自身组织结构上,抗病种质叶片单位面积气孔开口总面积、表面蜡质含量及角质层厚度显著高于感病种质;受Xam侵染后,抗病种质叶片病/健处产生木栓质积累和形成部分侵填体结构,且产生的胼胝质比感病种质多,过氧化物酶(POD)、苯丙氨酸解氨酶(PAL)和多酚氧化酶(PPO)活性及H2O2含量显著高于感病种质。表明3份抗病新种质的抗病性与叶片单位面积气孔开口总面积、表面蜡质含量、角质层厚度以及Xam侵染所诱导的木栓质、侵填体、胼胝质、防御酶活性、H2O2含量有关。
关键词:木薯;细菌性萎蔫病;抗病种质;抗病机理
中图分类号:S435.33 文献标识码:A
Abstract: Cassava bacterial blight (CBB) is the most serious disease in the cassava plantations of China. In order to clarify the resistance mechanism of cassava germplasms to bacterial blight, this study compared the structure of the leaves of the resistant and susceptible germplasms, and the tissue structure, physiological and biochemical substances changes during interaction with Xanthomonas axonopodis pv. manihotis. Results showed that the total area of stomatal opening, surface waxy matter content, and keratinization thickness were significantly higher in the resistant germplasms than those in the susceptible germplasms. When the cassava plants were infected with X. axonopodis pv. manihotis, the microstructure observation showed that the resistant cassava germplasms could produce more callose than the sensitive germplasms, the cork accumulated and partial tylosis structure was also formed at the infection sites of the resistant germplasms, and the activity of POD, PAL, PPO and the content of H2O2 in the leaves of the resistant cassava germplasms were significantly higher than those of the susceptible germplasms, which showed that the resistance of the three new cassava germplasms was related to the total area of stomatal opening, surface waxy matter content, keratinization thickness, and cork accumulated, partial tylosis structure, callose, the activity of defense enzyme, the content of H2O2.
Keywords: cassava; bacterial blight disease; resistance germplasm; resistance mechanism
DOI: 10.3969/j.issn.1000-2561.2021.01.028
木薯(Manihot esculenta Crantz),是大戟科(Euphorbiaceae)木薯屬灌木状一年或多年生作物,与马铃薯、甘薯并称世界三大薯类作物,是世界10亿人口日常生活所需热量的主要来源[1]。19世纪20年代左右传入我国,现主要栽培于广西、海南、广东、云南等热带及亚热带地区。目前,木薯在我国除了可加工成淀粉和饲料之外,也作为酒精的主要生产原料。与木薯相关的产业在当地农业经济中占有重要地位,国内木薯产业的健康可持续发展对保障相关产业的发展具有重要意义[2]。但国内木薯产量不能满足需求,自2005年开始,中国一直是世界上最大的木薯干片和木薯淀粉进口国[3]。
木薯细菌性萎蔫病(cassava bacterial blight, CBB)是由地毯草黄单孢木薯萎蔫致病变种(Xanthomonas axonopodis pv. manihotis,简称Xam)侵染引起的检疫性病害(也称细菌性枯萎病)。目前,该病在广西、广东、海南等地频发流行,部分地区严重为害,是我国木薯种植园区中危害最严重的病害[4]。但在近年来,国内外有关木薯细菌性萎蔫病的抗病机理报道较少,主要集中在叶片结构[5-7]、侵染反应[8]、生理生化物质[6, 7, 9]及抗病相关基因的挖掘[10-14]。对于该病的防治,种植抗病(或耐病)品种是最有效的方法之一,由于对木薯细菌性萎蔫病的抗病机制缺乏研究,严重限制了相关工作的开展。
中国热带农业科学院环境与植物保护研究所通过木薯种质收集和有性杂交获得的杂交后代进行抗病性评价,筛选获得‘RXC9‘RXC10和‘RXC11等具有较好抗性的新种质。为了明确这3份抗病新种质的抗病机理,本研究通过比较抗感木薯种质叶片的自身组织结构、与Xam互作过程中组织结构和生理生化物质变化的差异,以期进一步明确抗病新种质的抗病机理,为木薯抗病育种工作提供理论依据。
1 材料与方法
1.1 材料
木薯种质‘RXC9‘RXC10‘RXC11‘SC205‘GR4和‘SC8,由中国热带农业科学院环境与植物保护研究所提供,‘RXC9为优良主栽品种与耐病种质有性杂交后代,‘RXC10‘RXC11为不同地区收集种质,3份种质均由田间自然病圃和人工接种鉴定为抗病;‘SC205‘GR4和‘SC8为感病种质[15];细菌性萎蔫病菌菌株XamGX11由中国热带农业科学院环境与植物保护研究所提供。
过氧化物酶(POD)活性试剂盒(分光法)、苯丙氨酸解氨酶(PAL)活性试剂盒(分光法)、多酚氧化酶(PPO)活性试剂盒(微量法)、H2O2含量试剂盒(微量法)均购自苏州科铭生物技术有限公司,其他试剂为国产分析纯。
1.2 方法
1.2.1 气孔密度观察 参照李伯凌[7]的气孔观察方法。选取各木薯种质健康成熟且叶龄一致的叶片进行气孔观察,每个种质观察3个视野,重复3次,计算每个视野的气孔数,并计算气孔密度。
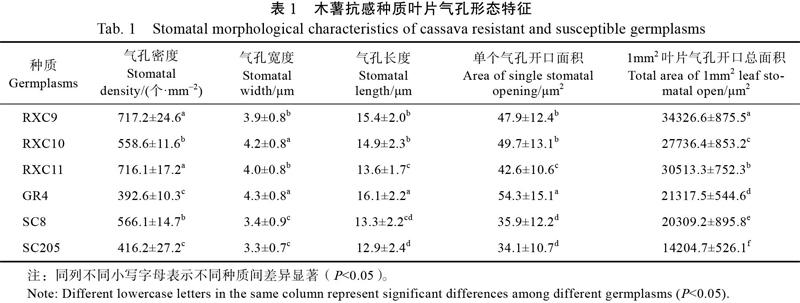
1.2.2 气孔开口观察 使用田间种植约5个月的木薯为材料,在连续晴天的上午11:00,各木薯种质由完全展开的嫩叶往下数第10叶龄健康叶片,选取生长方向一致,叶片部位一致为材料。采用指甲油印迹法,在下表皮涂上一层薄薄的透明指甲油,待指甲油干后用镊子轻轻撕下指甲油薄膜,指甲油薄膜倒置贴在干净的载玻片上。用VHX-5000超景深三维显微镜观察,在1000倍视野下拍照,并随机测量气孔长、宽,每个种质测量10个气孔,重复3次。参照蔡金玲[16]的近似椭圆法计算气孔开口面积(mm2)S=长×宽×π/4。
1.2.3 叶片表面蜡质含量测定 参照高扬[17]的蜡质含量测量方法。选用各木薯种质健康成熟且叶龄一致的叶片提取表面蜡质含量,每个木薯种质不同叶龄叶片重复3次。单位叶片表面积蜡质(μg/cm2)=蜡质总含量(μg)/叶片总面积(cm2)。
1.2.4 健康叶片组织结构观察 参照李伯凌[7]的石蜡切片方法。选用各木薯种质健康成熟且叶龄一致的叶片进行石蜡切片,测量栅栏组织厚度、海绵组织厚度、上表皮厚度、角质层厚度与叶片厚度,每个种质各测量10次,重复3次,并计算叶片结构紧密度(CTR)、叶片结构疏松度(SR)。叶片结构紧密度(CTR)=栅栏组织厚/叶片厚× 100%;叶片结构疏松度(SR)=海绵组织厚/叶片厚×100%。
1.2.5 发病叶片组织结构的显微观察 参照李伯凌[7]的石蜡切片方法。选取田间植株成熟叶片且相同叶龄,均为发病初期的病斑为实验材料,将叶片剪成1 cm×1 cm大小,立刻浸泡FAA固定液中,抽真空至叶片下沉,室温固定2 d,观察病/健处组织结构的变化。
1.2.6 病原菌引起胼胝质产生的染色观察 参照卜浩宇[18]的胼胝质观察方法。选用健康且生长一致的盆栽木薯,且叶龄一致,采用注射活体接种,接种菌液浓度为(3×107~3×108)CFU/mL,接种健康且刚完全转绿叶背,于2、4、6 d取样观察。
1.2.7 病原菌侵染前后生理生化物质测定 选用健康且生长一致的盆栽木薯,且叶龄一致,采用注射接菌的方法,菌液浓度为(3×107~3×108)CFU/mL,接种相同叶龄健康成熟叶背,注射范围大小一致,每张叶片接3片裂叶,空白對照注射无菌水,分别于0、2、4、6、8、10 d取样。实验具体操作、结果换算及注意事项参照苏州科铭生物技术有限公司POD、PAL、PPO活性及H2O2含量试剂盒说明书。
1.3 数据处理
实验数据采用Microsoft Excel 2010软件进行统计分析,采用SAS 9.1.3软件进行差异显著性检验。
2 结果与分析
2.1 木薯抗感种质自身组织结构的差异
2.1.1 木薯抗感种质叶片气孔形态特征 利用I2-KI染色法和指甲油印迹法观察木薯抗感种质叶片气孔,比较抗感种质之间气孔的差异。由表1可知,在1 mm2的叶面积中,抗病种质的气孔开口总面积显著大于感病种质,而抗感种质间气孔密度、气孔宽度、气孔长度和单个气孔开口面积无显著差异。表明抗病种质叶片单位叶面积气孔开口总面积与抗病性具有一定的相关性。
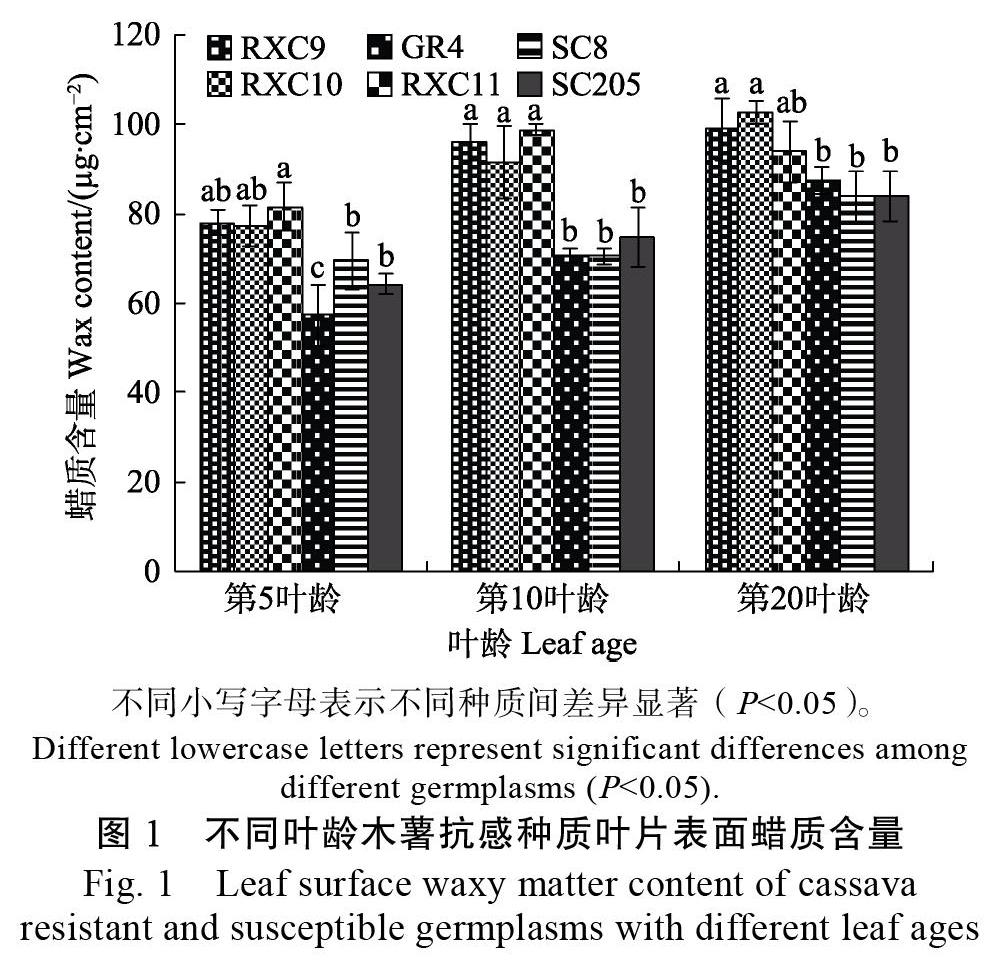
2.1.2 木薯抗感种质叶片表面蜡质含量 利用氯仿提取木薯抗感种质叶片表面蜡质,比较叶片表面蜡质含量的差异。结果发现,第5叶龄(嫩叶)的表面蜡质比第10叶龄(成熟叶)及第20叶龄(成熟叶)的蜡质少,抗病种质叶片蜡质含量显著高于感病种质(图1)。由此表明,抗病种质叶片蜡质含量与抗病性具有一定的相关性。
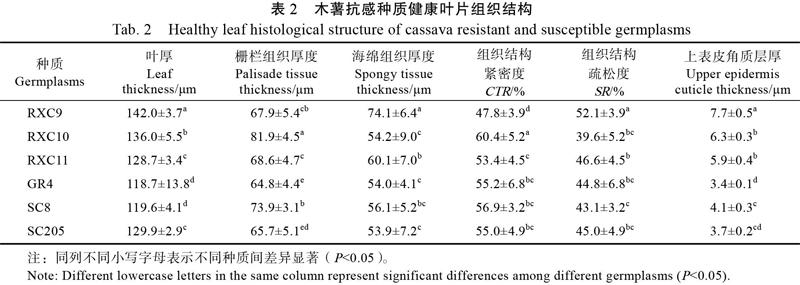
2.1.3 木薯抗感种质健康叶片组织结构 通过石蜡切片显微观察叶片组织,比较木薯抗感种质健康叶片组织结构的差异,由表2可知,木薯抗感种质上表皮角质层厚度呈显著差异,抗病种质上表皮角质层均比感病种质的厚,其中‘RXC9的上表皮角质层最厚,达7.65 μm,各木薯种质上表皮角质层厚度依次为‘RXC9>‘RXC10>‘RXC11>‘SC8>‘SC205>‘GR4。抗感种质之间叶片厚度、栅栏组织厚度、海绵组织厚度、组织结构紧密度、组织结构疏松度均无显著差异。综上结果表明,抗病种质叶片上表皮角质层厚与抗病性具有一定的相关性。
2.2 木薯抗感种质与Xam互作过程中组织结构变化的差异
2.2.1 木薯抗感种质发病叶片组织结构 利用石蜡切片法观察比较木薯抗感种质田间发病初期叶片组织结构的差异。结果发现,抗病种质发病叶片的病/健界限明显,在细胞壁、细胞间隙中木栓质积累明显多于感病种质,且‘RXC10和‘RXC11病/健处细胞紧密,病原菌未进一步破坏健康组织细胞,而感病种质遭到病原菌破坏严重(图2)。此外,观察到抗病种质导管中出现侵填体,而感病种质未观察到。表明抗病种质受Xam侵染后,可诱导病/健处组织产生木栓质积累并形成部分侵填体结构。
2.2.2 木薯抗感种质受Xam侵染后胼胝质沉积 由图3可知,经染色观察,当叶片接种Xam第2天时,木薯抗感种质均观察到胼胝质的积累,其中,抗病种质中的胼胝质沉积密集分布于发病部位,健康部位亦有零星分布,病/健交界处荧光界线明显,而在感病种质中仅零星分布于发病部位和健康部位,病/健交界处无明显的荧光界线。当接种第4天时,抗感种质叶片胼胝质荧光相比第2天均增强,病/健交界处均有明显的荧光界线,但抗病种质胼胝质荧光强度明显比感病种质强,且抗病种质发病部位胼胝质形成的范围明显比感病种质的大,并向健康部位扩展,而感病种质健康部位无明显荧光。当接种第6天时,抗感种质发病部位胼胝质均出现降解,并向四周逐渐扩散。由此说明,抗感种质叶片受Xam侵染后,均可出现胝质的积累,其中抗病种质发病部位出现胼胝质沉积比感病种质多,胼胝质是植物细胞壁增强的主要物质,其产生与积累有利于提高植物本身对病原菌的防御能力。
2.3 木薯抗感种质与Xam互作过程中生理生化物质变化的差异
通过接种Xam处理木薯叶片,比较木薯抗感种质叶片组织受Xam侵染前后POD、PAL和PPO活性及H2O2含量变化的差异。由图4可知,接种前,抗感种质之间POD、PAL和PPO活性及H2O2含量无显著差异。接种后,POD活性变化呈先上升后下降的趋势,接种第4天,POD酶活性迅速上升,抗病种质POD活性明显高于感病种质;接种后,抗感种质PAL活性明显提高,呈先上升后下降的趋势,‘RXC10的PAL活性在接种第6天时达到峰值,‘RXC9‘RXC11叶片的PAL酶活性于接种第8天时达到峰值,在接种第6天后‘RXC9‘RXC10‘RXC11的PAL活性均高于感病种质;接种后,抗感种质PPO活性明显提高,总体呈先上升后下降的趋势,抗病种质PPO活性较感病种质高;接种后,抗感种质叶片H2O2含量较接种前明显提高,呈先上升后下降再上升的波浪式起伏状,且在接种后第4天和第8天时出现2个高峰。整个侵染过程POD、PAL和PPO活性及H2O2含量变化均高于空白对照,且空白对照POD、PAL和PPO活性及H2O2含量变化保持相对平稳。从整体变化来看,抗病种质POD、PAL和PPO活性及H2O2含量的增幅和峰值均高于感病种质。
3 讨论
气孔是植物光合作用和呼吸作用与外界进行气体交换的主要门户,控制二氧化碳的进出,并且是病原细菌入侵的自然孔口。前人研究,木薯的抗病性与气孔密度存在一定的相关性[6-7]。叶片表面蜡质含量作为叶片抵抗病原菌入侵的外层屏障,前人研究发现叶片蜡质含量与抗病性具有一定的相关性[19],且组成蜡质中的萜类化合物和黄酮类化合物对细菌和真菌具有一定的抑制作用[20]。角质层对病原物的入侵发挥机械阻碍的作用,Isaacson等[21]在番茄角质层突变体中发现,与野生型番茄相比,突变体角质层中角质含量明显下降,厚度变薄,并且对微生物感染更加敏感。本研究观察木薯叶片组织结构时发现,抗病种质叶片单位面积气孔开口总面积、表面蜡质含量及角质层厚度显著高于感病种质,由此说明,这3个参数对提高木薯抗病性可能存在促进作用。在本研究中,抗病种质单位叶面积气孔开口总面积比感病种质的大,在相同环境条件下,可能更有利于抗病种质光合作用和呼吸作用的物质代谢和能量代谢,促进植株抵抗病原的侵染。对于叶部病害,在自然条件下水孔是细菌侵染的自然孔口之一,水孔主要集中在葉尖、叶缘,田间观察发现CBB叶可从叶缘发病,那么水孔的分布、形态特征是否与木薯抗病性相关,这将有待下一步的研究与验证。
木栓质、侵填体和胼胝质等与植物抗病性密切相关,对病原菌入侵起到重要阻碍作用[22-24]。在本研究观察抗感种质叶片病/健处组织时发现,抗病种质不但产生木栓质积累,而且形成部分侵填体结构,而感病种质病/健处周围组织遭到严重破坏,未观察到明显的木栓质积累和侵填体结构;此外,本研究比较抗感种质在Xam侵染2~6 d后胼胝质沉积的差异时发现,抗病种质形成的胼胝质比感病种质多,另外发现,病原菌的侵染并没有系统性地导致胼胝质的分布,这可能是木薯对于Xam的侵染反应存在一定的延时性,当Xam已经完全侵入木薯叶片,病原菌与寄主建立寄生关系后,才产生相应的寄主抗性反应,以阻止Xam进一步的扩展。综上所述,说明抗病种质与Xam互作可诱导产生木栓质积累、侵填体结构及胼胝质积累,对抵御Xam侵染具有一定的作用,进一步说明抗病种质的抗病性是由木栓质、侵填体和胼胝质等多种诱导结构共同或相继作用的结果,这3个参数可作为木薯抗病性鉴定的辅助指标。
POD、PPO和PAL是植物抗病原菌侵染的重要防御酶。POD与木质素、木栓质的合成相关,并参与4-羟基肉桂酸,3,4-二羟基肉桂酸和4-羟基-3-甲氧基肉桂酸的沉积[25-26];PPO可钝化病原菌的蛋白和酶活性[27];PAL催化L-苯丙氨酸脱氨生成反式肉桂酸,是植物体内苯丙烷类代谢途径的关键酶和限速酶,并合成异黄酮类植保素、木质素的关键酶[28-30]。本研究对木薯抗感种质受Xam侵染后POD、PPO和PAL活性进行测定,发现3个防御酶的活性均上升,呈先上升后下降的趋势,且抗病种质的防御酶活性的增幅和峰值均高于感病种质。该结果与前人的研究结果基本一致[6-7],仅PPO活性变化与樊春俊[6]研究的PPO活性变化趋势存在一定的差异,这可能是由于所选木薯种质在遗传背景上存在差异。POD、PPO和PAL活性的提高可增强木薯对Xam侵染的抵抗力,因此可将这3种防御酶作为木薯抗病性鉴定的辅助指标。
H2O2是植物抗病防卫反应中的重要物质,可对病原物产生直接的伤害,也参与了如细胞壁木质化、富含羟脯胺酸蛋白的合成,并可作为细胞过敏性坏死反应的触发信号。大量的研究表明,寄主与病原物互作中,H2O2的积累与寄主抗病性相关[31-33]。本研究比较木薯抗感种质受Xam侵染后H2O2含量变化的差异,发现抗病种质的H2O2含量明显高于感病种质,说明H2O2的积累对提高木薯抗病性起一定的作用。H2O2含量在接种后第4天和第8天出现峰值,可能是木薯-Xam互作所导致的波动,推测此时H2O2作为细胞过敏性坏死反应的触发信号,这将有待进一步研究。
参考文献
Valentine O N, Kynet K, ham S K, et al. Resistance to Sri Lankan cassava mosaic virus (SLCMV) in genetically engineered cassava cv. KU50 through RNA silencing[J]. PLoS One, 2015, 10 (4): e0120551.
陈丽珍, 叶剑秋. 我国木薯加工业的发展现状与展望[J]. 园艺与种苗, 2011(3): 87-90.
盘 欢. 亚洲11国木薯生产概况[J]. 广西热带农业, 2009(5): 29-31.
李超萍, 时 涛, 刘先宝, 等. 国内木薯病害普查及细菌性萎蔫病安全性评估[J]. 热带作物学报, 2011, 32(1): 116-121.
Zinsou V, Wydra K, Ahohuendo B, et al. Leaf waxes of cassava (Manihot esculenta Crantz) in relation to ecozone and resistance to Xanthomonas blight[J]. Euphytica, 2006, 149(1/2): 189-198.
樊春俊. 木薯种质对细菌性枯萎病抗性机理初探[D]. 海口: 海南大学, 2012.
李伯凌. 木薯抗细菌性枯萎病的生理机制研究[D]. 海口: 海南大学, 2017.
Kpémoua K, Boher B, Nicole M, et al. Cytochemistry of defense responses in cassava infected by Xanthomonas campestris pv. manihotist[J]. Canadian Journal Microbiology, 1996, 42(11): 1131-1143.
Pereira L F, Goodwin P H, Erickson L. The role of a phenylalanine ammonia lyase gene during cassava bacterial blight and cassava bacterial necrosis[J]. Journal of Plant Research, 1999, 112(1): 51-60.
任希望. 木薯細菌性枯萎病菌的分离鉴定与PTI途径相关基因的克隆[D]. 海口: 海南大学, 2014.
Lozano R, Hamblin M T, Prochnik S, et al. Identification and distribution of the NBS-LRR gene family in the cassava genome[J]. BMC Genomics, 2015, 16(1): 360.
Wei Y X, Hu W, Wang Q N, et al. Comprehensive transcriptional and functional analyses of melatonin synthesis genes in cassava reveal their novel role in hypersensitive-like cell death[J]. Scientific Reports, 2016, 6(8): 35029.
Li X L, Liu W, Li B, et al. Identification and functional analysis of cassava DELLA proteins in plant disease resistance against cassava bacterial blight[J]. Plant Physiology and Biochemistry, 2018, 124(3): 70-76.
Yoodee S, Kobayashi Y, Songnuan W, et al. Phytohormone priming elevates the accumulation of defense-related gene transcripts and enhances bacterial blight disease resistance in cassava[J]. Plant Physiology and Biochemistry, 2018, 122(1): 65-77.
卢 昕, 李超萍, 时 涛, 等. 国内603份木薯种质对细菌性枯萎病抗性评价[J]. 热带农业科学, 2013, 33(4): 67-70, 90.
蔡金玲. 基于改进遗传算法的叶片气孔开度测量方法研究[D]. 哈尔滨: 东北林业大学, 2016.
高 扬. 小麦叶片表皮蜡质的测定及其对光合和农艺性状的效应分析[D]. 杨凌: 西北农林科技大学, 2014.
卜浩宇. 向日葵抗(耐)菌核病鉴定以及抗菌核病机制的研究[D]. 呼和浩特: 内蒙古农业大学, 2014.
李 淼. 猕猴桃品种对溃疡病的抗性及其机理研究[D]. 合肥: 安徽农业大学, 2003.
Swain T. Secondary compounds as protective agents[J]. Annual Review in Plant Physiology, 1977, 28(1): 479-501.
Isaacson T, Kosma D K, Matas A J, et al. Cutin deficiency in the tomato fruit cuticle consistently affects resistance to microbial infection and biomechanical properties, but not transpirational water loss[J]. The Plant Journal, 2009, 60(2): 363-377.
Kolattukudy P E, Dean B B. Structure, gas chromatographic measurement, and function of suberin synthesized by potato tuber tissue slices[J]. Plant Physiology, 1974, 54(1): 116-121.
苗 琛, 尚富德, 江 静, 等. 西瓜枯萎病抗性的细胞学研究[J]. 四川大学学报(自然科学版), 2004, 41(4): 877-880.
Javier García-Andrade, Vicente Ramírez, Flors V, et al. Arabidopsis ocp3 mutant reveals a mechanism linking ABA and JA to pathogen-induced callose deposition[J]. The Plant Journal, 2011, 67(5): 783-794.
Liu Z Y, Jiang W B. Lignin deposition and effect of postharvest treatment on lignification of green asparagus (Asparagus officinalis L.)[J]. Plant Growth Regulation, 2006, 48(2): 187-193.
賀立红, 蔡 马, 何生根, 等. 相关酶对花生果针木质化的影响[J]. 华南农业大学学报, 2006, 27(1): 76-78.
许志刚. 普通植物病理学[M]. 4版. 北京: 高等教育出版社, 2009: 301.
Legrand M, Fritig B, Hirth L. Enzymes of the phenylpropanoid pathway and the necrotic reaction of hypersensitive tobacco to tobacco mosaic virus[J]. Phytochemistry, 1976, 15(9): 1353-1359.
Green N E, Hadwiger L A, Graham S O. Phenylalanine ammonia-lyase, tyrosine ammonia-lyase, and lignin in wheat inoculated with Erysiphe graminis f. sp. tritici[J]. Phytopathology, 1975(65): 1071-1074.
欧阳光察, 薛应龙. 植物苯丙烷类代谢的生理意义及其调控[J]. 植物生理学通讯, 1988(3): 9-16.
Averyanov A. Oxidative burst and plant disease resistance[J]. Frontiers in Bioscience, 2009, 51(1): 142-152.
马 健, 刘振宇, 吕 全, 等. 不同抗性杨树接种溃疡病菌后过氧化氢及其氧化酶的表达差异[J]. 东北林业大学学报, 2012, 40(12): 118-122, 146.
程 征. 转OXO拟南芥抗黄萎病机理的初步研究[D]. 郑州: 郑州大学, 2017.
责任编辑:谢龙莲

