碱土金属离子改性CeO2的合成及其储氧性能研究
黄明慧,陈宇坤,唐 鸿,高努男,徐要辉,1b,1c※
(1.乐山师范学院 a.电子与材料工程学院;b.功能材料实验室;c.西部硅材料光伏新能源产业技术研究院,四川 乐山 614000;2.四川大学 高分子科学与工程学院,四川 成都 610207)
0 引言
二氧化铈(CeO2)是重要的稀土氧化物,也是典型的储氧材料[1]。当体系富氧时,CeO2可以捕获环境中的氧气,而当体系缺氧时,CeO2可以释放氧气,CeO2的这种特性称之为储氧能力(Oxygen Storage Capacity),其储氧/释放机理如方程式(1)所示[2]。CeO2晶体中含有微量的Ce3+离子,可与Ce4+离子形成Ce4+↔Ce3+的氧化还原循环,同时伴随着氧空位缺陷(“V”)的形成与消失,氧空位缺陷的数量是其储氧能力的决定因素。有趣的是,即使CeO2晶体中存在大量的氧空位缺陷,它仍旧能够维持自身的萤石结构。基于CeO2的这些特性,其在催化剂领域具有广泛的应用,尤其是作为机动车尾气处理中的三效催化剂助剂[3-7]。

为了进一步提升CeO2的储氧能力,国内外研究者多数采用离子掺杂改性的方法微观调整CeO2表面的化学状态和晶体结构[8-10]。Dai[11]等以多孔硅KIT-6 为模板剂利用模板法合成了单相CeO2粉体,其储氧能力高达2.38 mmol/g,经过Cu2+和Fe3+离子的掺杂改性,其储氧能力分别提高到了6.05 和7.59 mmol/g。Barbato[12]等分别采用溶液燃烧法和湿法浸渍法得到了Cu2+离子掺杂的CeO2,其储氧能力分别为0.601 mmol/g 和0.784 mmol/g。Dutta[13]等采用溶液燃烧法得到了一系列Ti4+离子掺杂的CeO2粉体。单相CeO2的储氧能力为0.23 mmol/g,而当Ti4+离子的添加量为40 mol.%时,所得Ce0.6Ti0.4O1.73的储氧能力达到了最大,为2.0 mmol/g。Singh[14]等采用水热法得到了Ti4+离子掺杂的Ce0.60Ti0.40O2粉体,其储氧能力约为1.2 mmol/g。此外,还合成了一系列Fe3+离子掺杂的Ce1-xFexO2-δ粉体,当x=0.15时,其储氧能力约为1.1 mmol/g。可见,改性CeO2的储氧能力受制备方法的影响较大,不同制备方法所得同一离子改性CeO2的储氧能力具有较大差异,甚至相同制备方法所得掺杂CeO2的储氧能力也有较大差异,使得研究者们无法做出正确的横向比较。因此,本论文选用元素周期表中同一主族元素Mg、Ca 和Ba 元素相应的硝酸盐作为改性剂,在相同工艺条件下制备单相和Mg2+、Ca2+、Ba2+离子改性的CeO2粉体,并考察和对比其储氧能力的变化。
1 实验
1.1 实验试剂
Ce(NO3)3·6H2O(99.95%)、Ca(NO3)2·4H2O(AR)和Ba(NO3)2(AR)均由上海阿拉丁生化科技股份有限公司提供,乙二醇(AR)和无水乙醇(AR)购买于成都市科隆化学品有限公司,Mg(NO3)2·6H2O购买于九鼎化学(上海)科技有限公司。此外,本实验全程使用蒸馏水作为溶剂和洗涤等用途。
1.2 Mg2+、Ca2+、Ba2+离子改性CeO2 的合成
首先采用溶剂热法合成铈前驱体,具体操作为:将4 mmol Ce(NO3)3·6H2O 溶解于5 mL 的蒸馏水中,之后添加乙二醇使溶液的总容积为30 mL,待溶液混合均匀后转移至水热反应釜中,在200 °C下保温24 h。待反应结束后,用无水乙醇和蒸馏水反复洗涤,在60 °C 下干燥24 h 后最终得到铈前驱体粉末。
其次,采用浸渍法将Mg2+、Ca2+、Ba2+离子负载于铈前驱体外表面和内表面,具体操作为:配置30 mL 0.34 mol/L Mg2+、Ca2+、Ba2+的水溶液,之后分别称取0.50 g 铈前驱体粉末放入上述碱土金属离子的溶液中,搅拌2 h 后再静置12 h。待浸渍结束后,采用过滤的方式收集固体,之后在60 °C下干燥24 h,最终得到Mg2+、Ca2+、Ba2+离子浸渍的铈前驱体。
最后,采用焙烧工艺最终得到Mg2+、Ca2+和Ba2+离子改性的CeO2粉体,分别记为Mg-CeO2、Ca-CeO2和Ba-CeO2。焙烧温度为500 °C,焙烧时间为2 h。其中,未浸渍碱土金属离子的样品记为单相CeO2。
1.3 表征
X 射线衍射仪(XRD,DX-2700 型)应用于样品的物相分析;扫描电子显微镜(SEM,JSM-7500型)应用于观察样品的形貌和尺寸;氢气-程序升温还原系统(H2-TPR,TP-5000 型,配有热导检测仪TCD)用于评估样品的储氧能力。测试步骤为:首先称取50 mg 被测样品放置于样品室中,在5%O2/Ar 的气氛中升温至500 °C 并保温1 h,其中流速为100 mL/min,升温速度为10 °C/min。待样品冷却至室温后,采用氩气吹扫样品至基线平稳。最后,通入5% H2/Ar 混合气并升温至1000 °C 左右,其中,流速为30 mL/min,升温速率为10 °C/min。通过TCD 测定流出尾气中H2的信号,进而得到H2-TPR 曲线,根据其还原峰面积计算H2的消耗量(单位为mmol/g),即CeO2样品的储氧能力。
2 结果与讨论
2.1 物相分析
图1(a)是采用溶剂热工艺所得的铈前驱体的XRD 图谱。从图1(a)可知,溶剂热法所得铈前驱体的XRD 特征衍射峰主要为Ce(CO3)OH(JCPDS No.52-0352),此外,还发现了Ce(COOH)3(JCPDS No.49-1245)的特征衍射峰,表明所得铈前驱体的主要物相成分为Ce(CO3)OH和Ce(COOH)3,其中Ce(CO3)OH的含量居多。图1(b)分别是单相CeO2以及Mg2+、Ca2+、Ba2+离子浸渍铈前驱体再经60 °C 干燥和500 °C 焙烧所得改性CeO2粉体(即Mg-CeO2、Ca-CeO2和Ba-CeO2样品)的XRD 图谱。从图1(b)中可以看出,所有样品的物相成分均为萤石结构的CeO2(JCPDS No.34-0394),其特征衍射峰分别对应CeO2的(111)、(200)、(220)、(311)、(222)、(400)和(331)晶面。图1(b)中XRD 特征衍射峰的峰形完整且尖锐,表明结晶性良好,未发现其它杂质的衍射峰,如Ce(CO3)OH 和Ce(COOH)3,表明所得CeO2样品的纯度较高。此外,在Mg-CeO2、Ca-CeO2和Ba-CeO2的XRD图谱中,并未发现Mg、Ca和Ba相应的氧化物或化合物的特征衍射峰。以上分析表明Mg2+、Ca2+、Ba2+离子可能以掺杂的方式在高温焙烧的作用下进入了CeO2晶格,形成了相应的固溶体。

图1 XRD 图谱(a) 溶剂热法所得铈前驱体的XRD 图谱;(b) 单相CeO2、Mg-CeO2、Ca-CeO2 和Ba-CeO2粉体的XRD 图谱
图2(a)是单相CeO2、Mg-CeO2、Ca-CeO2和Ba-CeO2粉体的晶格常数柱状图。从图2(a)中可以看出,单相CeO2的晶格常数为5.406 5 Å,引入Mg2+、Ca2+和Ba2+离子后,CeO2的晶格常数出现了不同程度的变化。晶格常数的变化主要归因于掺杂离子Mg2+(0.89 Å)、Ca2+(1.12 Å)和Ba2+(1.42 Å)的有效离子半径与CeO2晶体中Ce4+(0.97 Å)的有效离子半径存在差异[15]。Mg2+、Ca2+和Ba2+离子以取代的方式进入CeO2晶格替代了Ce4+离子的晶格位点,进而引起了晶格收缩或膨胀。当杂质离子的有效离子半径小于Ce4+离子的有效离子半径时,会出现晶格收缩,晶格常数减小,例如,Mg2+离子改性后所得Mg-CeO2的晶格常数下降到了5.4004 Å;当杂质离子的有效离子半径大于Ce4+离子的有效离子半径时,会出现晶格膨胀,晶格常数增大,例如,Ca2+和Ba2+离子改性后所得Ca-CeO2和Ba-CeO2的晶格常数分别增加到了5.4131 和5.4141 Å。引入杂质离子后,CeO2晶格常数的变化进一步表明了掺杂实验的成功。图2(b)是单相CeO2、Mg-CeO2、Ca-CeO2和Ba-CeO2粉体的晶粒尺寸柱状图。从图2(b)中可以看出,单相CeO2的晶粒尺寸约为99 Å,Mg2+和Ca2+离子掺杂使得CeO2的晶粒尺寸增加到了106Å 和101 Å,而Ba2+离子掺杂使得CeO2的晶粒尺寸降低到了92 Å。可见,Mg2+、Ca2+和Ba2+离子的引入会在一定程度上影响CeO2的晶粒尺寸。

图2 单相CeO2、Mg-CeO2、Ca-CeO2 和Ba-CeO2 粉体的(a)晶格常数(b)晶粒尺寸
2.2 形貌分析
图3(a)是单相CeO2粉体的SEM 照片。从图3(a)中可以看出,单相CeO2的形貌是由有许多薄片交互组成的片层状结构,颗粒尺寸分布较广,最大颗粒直径可达5 μm。图3(b)是单颗CeO2的局部放大SEM 照片,进一步表明了CeO2是由薄片组成的片层状形貌,其中薄片的平均厚度约为35 nm,并且这些纳米薄片相互交错形成了开放式的孔结构。

图3 SEM 照片(a) 单相CeO2 的SEM 照片和 (b) 相应的局部放大SEM 照片
2.3 储氧能力分析
图4(a)-(d)分别是单相CeO2、Mg-CeO2、Ca-CeO2和Ba-CeO2粉体的H2-TPR 曲线。从图4中可以看出,所有CeO2样品的H2-TPR 曲线均呈现出两个明显的还原峰,这表明了CeO2样品与H2的两种还原行为:(1)在温度为50-600 °C 的范围内,即图中浅黄色区域,其还原峰为CeO2表面氧空位缺陷吸附氧与H2的反应引起的;(2)在温度为600-980 °C 的范围内,即图中浅粉色区域,该还原峰为H2扩散至CeO2体相与其晶格氧发生反应引起的,或者认为是CeO2体相中的晶格氧转移至表面与H2发生反应引起的。相比于单相CeO2粉体,Mg-CeO2、Ca-CeO2和Ba-CeO2粉体的H2-TPR 曲线在低温和高温区域均有不同程度的变化,这主要归因于Mg2+、Ca2+、Ba2+离子的引入改变了CeO2的表面化学状态和晶体结构。

图4 (a) 单 相CeO2、(b) Mg-CeO2、(c) Ca-CeO2 和(d)Ba-CeO2 粉体的H2-TPR 曲线
通过对CeO2样品H2-TPR 曲线中的还原峰进行积分,可以计算出CeO2样品单位质量所消耗H2的量,该数值可以用于定量地衡量CeO2的储氧能力,其单位为mmol/g。图5 为单相CeO2、Mg-CeO2、Ca-CeO2和Ba-CeO2粉体在50°C-980 °C 范围内的储氧能力柱状图。相比于单相CeO2粉体的储氧能力(0.226 mmol/g),Ca2+离子改性后所得Ca-CeO2样品的储氧能力有所下降,其值为0.150 mmol/g,下降率为33.6%,而Mg2+离子改性后所得Mg-CeO2样品的储氧能力略有上升(0.256 mmol/g),上升幅度为13.3%。此外,最值得注意的是,Ba2+离子改性后所得Ba-CeO2样品的储氧能力提高了77.4%,其值为0.401 mmol/g。根据方程式(2),1 个二价金属离子M2+(M=Mg、Ca 和Ba)取代CeO2晶格中的1 个Ce4+,将释放1 个氧原子,同时会产生1 个氧空位缺陷,氧空位缺陷数量的增加有利于CeO2储氧能力的提高。然而,从图5 的分析中可以发现,并不是所有离子的掺杂均会增强CeO2的储氧能力,可见,还有其他因素的存在会影响CeO2的储氧能力。由于本实验采用的是相同的制备工艺,并且浸渍工艺本身不会影响样品的形貌,所以,这个因素很可能是样品的比表面积,而晶粒尺寸是反应样品比表面积的最主要因素。正如图2(b)所示,Mg2+、Ca2+和Ba2+离子的引入会在一定程度上影响CeO2的晶粒尺寸。因此,我们可以得出结论,Mg2+、Ca2+和Ba2+杂质离子进入CeO2晶格不但会所引起的晶体结构和表面化学状态的变化,而且还会在一定程度上影响样品的晶粒尺寸,两者相互作用最终决定了CeO2储氧能力。
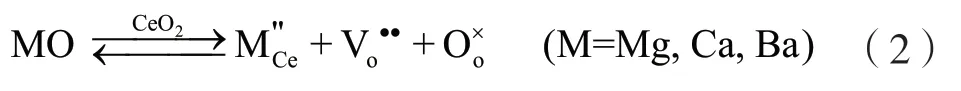

图5 单相CeO2、Mg-CeO2、Ca-CeO2 和Ba-CeO2 粉体在50 °C-980 °C 范围内的储氧能力
3 结论
采用溶剂热法联合焙烧工艺得到了单相CeO2,其形貌为具有开孔结构的片层状结构,之后联合浸渍工艺成功得到了Mg2+、Ca2+、Ba2+离子掺杂改性的CeO2粉体。相比于单相CeO2粉体的储氧能力(0.226 mmol/g),Ca2+离子改性后所得Ca-CeO2样品的储氧能力下降至了0.150 mmol/g,而Mg2+离子改性后其储氧能力略有上升(0.256 mmol/g),Ba2+离子改性后其储氧能力具有77.4%的增幅,达到了0.401 mmol/g。本论文提供了一种优化CeO2储氧能力的方法,为CeO2的实际应用提供了理论基础。

