利用GFP标记的Ralstonia solanacearum鉴定马铃薯青枯病抗性
陈卓 肖熙鸥 陈曙 李可 邹华芬 金辉


摘 要:青枯病是危害马铃薯产业的重要病害,选育与推广抗青枯病品种是防控青枯病最高效的手段。目前已有的人工接种和田间抗性鉴定的方法不能有效区分处于潜伏侵染与完全抵抗侵染的材料,而利用GFP标记的Ralstonia solanacearum能够有效解决上述问题。笔者通过电击转化法将广宿主载体pBBR1MCS2-Tac-EGFP导入青枯菌P2中,成功获得了能够稳定遗传且不影响其致病力并带有绿色荧光报告的青枯菌菌株P2-Tac-EGFP。通过对感抗材料进行接种,结果表明,P2-Tac-EGFP能够有效区分感抗材料,并且P2-Tac-EGFP在感病材料的根部和茎部大量分布,而在抗病材料的根部仅有少量分布。综上所述,利用GFP标记的R. solanacearum能够快速准确地鉴定马铃薯青枯病抗性。
关键词:马铃薯;Ralstonia solanacearum;GFP;抗性
中图分类号:S532 文献标志码:A 文章编号:1673-2871(2021)01-035-07
Identification of potato bacterial wilt resistance using GFP-labeled Ralstonia solanacearum
CHEN Zhuo1, XIAO Xiou2, CHEN Shu2, LI Ke2, ZOU Huafen2, JIN Hui2
(1. College of Agriculture, Heilongjiang Bayi Agricultural University, Daqing 163000, Heilongjiang, China; 2. Key Laboratory of Tropical Fruit Biology, Ministry of Agriculture and Rural Affairs/Key Laboratory for Post-harvest Physiology and Technology of Tropical Horticultural Products of Hainan Province/Institute of South Subtropical Crop Research Institute, Chinese Academy of Tropical Agricultural Sciences Zhanjiang 524091, Guangdong, China)
Abstract: Bacterial wilt is an important disease that endangers the potato industry. The selection and promotion of bacterial wilt resistant varieties is the most effective means to prevent and control bacterial wilt. The selection of germplasm resistant to bacterial wilt is the basis for the selection of resistant varieties. The current methods of artificial inoculation and field resistance identification cannot effectively distinguish between latent infection and disease-resistant materials, and Ralstonia solanacearum labeled with GFP can effectively solve the above problems. In this study, the broad host vector pBBR1MCS2-Tac-EGFP was introduced into R. solanacearum P2 by the electric shock transformation method, and successfully obtained the R. solanacearum strain P2-Tac-EGFP with stable inheritance without affecting its pathogenicity. Through inoculation of resistant materials, the results show that P2-Tac-EGFP can effectively distinguish the resistant materials, and P2-Tac-EGFP is distributed in a large amount in the roots and stems of the disease-resistant materials, while a small amount is in the roots of the resistant materials.In summary, the use of GFP-labeled R. solanacearum can quickly and accurately identify potato bacterial wilt resistance.
Key words: Potato; Ralstonia solanacearum; GFP; Resistance
馬铃薯(Solanum tuberosum L.)是我国四大主要粮食作物之一,也是世界上重要的作物之一,在我国的栽培面积仅次于小麦、水稻和玉米[1-2]。由茄科雷尔(青枯菌)式菌(Ralstonia solanacearum)引起的青枯病是马铃薯生产中的主要病害之一,能造成马铃薯大量减产,严重时可减产80% [3-5]。茄科雷尔式菌是一种危害维管系统的病原体,侵入根木质部并扩散到茎组织,在那里产生过量的胞外多糖及多种胞外蛋白堵塞和破坏导管,使植物失水萎蔫[6]。目前,使用抗病品种是马铃薯生产上最为经济有效的抗青枯病方式,但目前的马铃薯种质资源中抗性资源稀少[7],因此,筛选马铃薯抗青枯病种质资源对马铃薯抗病育种起着关键性作用。
传统的马铃薯青枯病抗性鉴定方法一般为伤根接种鉴定,并在供试材料接种后开始持续观察其发病状况[8-10],通过调查病情指数、计算发病率和防病率[11],鉴定种质资源对青枯病的抗性,然而此方法不能有效辨别潜伏侵染,并且不能确定R. solanacearum是否已侵入植株。利用标记基因追踪病原菌在植物体内入侵、定殖的侵染途径,是研究病原菌致病机制的有效手段和方法[12]。已有研究表明,用于R. solanacearum的标记基因大多数为GFP基因[13-16]、GUS基因[17]、LUX基因[18]等,其中GFP作为标记基因之一被广泛应用于各类研究中,GFP蛋白最早是从水母中提取的,并且能在蓝光激发下发出绿色荧光[19]。GFP作为荧光标记分子,既有敏感的标记检测率,又无放射性危害[20]。
笔者将广宿主载体pBBR1MCS2-Tac-EGFP通过电击转化法导入R. solanacearum中,得到能够稳定遗传并带有绿色荧光报告基因的强致病力菌株P2-Tacc-EGFP,将其接种感抗马铃薯材料,能够有效区分材料对青枯病的抗性。本研究可为进一步研究R .solanacearum对植物的入侵、定殖提供适宜标记载体工具,并为马铃薯青枯病抗性评价提供了一个新的思路。
1 材料与方法
1.1 材料
试验选用华中农业大学选育的‘华薯12号和加拿大引进品种‘Chieftain试管苗。其中,多年田间青枯病抗性鉴定结果表明,‘华薯12号为高抗青枯病材料,‘Chieftain为感病对照材料。马铃薯供试材料试管苗在MS培养基中培养(普通MS培养基附加3%(w,后同)蔗糖和0.7%琼脂进行扩繁和保存)。在光周期为16 h、温度为22 ℃的组织培养室中培养20 d后,移栽至装有V基质∶V蛭石∶V珍珠岩=3∶1∶1的营养土的塑料营养钵中,植株在室温24 ℃左右、光周期为16 h的温室中生长20 d后接种青枯菌。
广寄主载体pBBR1MCS2-Tac-EGFP由中国热带农业科学院南亚热带作物研究所南方热带粮食中心保存,该质粒在工程菌中具有卡那霉素(Kana)抗性,通过Tac启动子驱动EGFP表达,如图1所示。
1.2 方法
1.2.1 R. solanacearum的分离 试验于2020年7月在中国热带农业科学院南亚热带作物研究所马铃薯实验基地进行,采集马铃薯青枯病感病植株,带回南亚热带作物研究所综合实验楼实验室分离病原菌,具体分离R. solanacearum的方法参考陈媛媛[21]的方法。其中NA琼脂培养基为:葡萄糖10.0 g,蛋白胨5.0 g,牛肉浸膏3.0 g,琼脂粉8.0 g,蒸馏水1.0 L,pH 7.0;TTC培养基为:0.05 g三苯基四氮唑(TTC)溶于10 mL无菌水中以1%体积分数溶于NA培养基中。致病力强的菌落,接种至TTC培养基后形状不规则,带黏性,白色,中间呈粉红色;非致病性的菌落很小,圆形,呈乳黄色或深红色,边缘颜色较浅[22-23]。
1.2.2 R. solanacearum的演化型鑒定 采用多重PCR检测技术快速检测田间采集的R. solanacearum菌株的演化型,根据PCR扩增产物的片段大小可以确定该菌株的演化型,用于鉴定R. solanacearum演化型地位的引物序列如表1所示[24-25]。
PCR扩增体系为20 ?L,其中包括Mix10 ?L,上下游引物各1 ?L,DNA模板50 ng,ddH2O补足20 ?L。反应程序为:96 ℃ 5 min;94 ℃ 15 s,57 ℃ 30 s和72 ℃ 30 s,35个循环;72 ℃延伸10 min。取5 ?L PCR产物于1%琼脂糖凝胶电泳检测,根据PCR扩增片段大小确定R .solanacearum菌株的演化型[26]。
1.2.3 R. solanacearum感受态的制备和电击转化及检测 R. solanacearum的感受态制备和电击转化参照张治飞[17]的方法。根据EGFP最大开放阅读框抗性基因设计引物(EGFPF:ATGAGTAAAGGAGAAGAACTTTTC,EGFPR:TTATTTGTAGAGCTCATCCATGCC)并且委托广州天一辉远公司进行合成;PCR体系为:2×PCR Mix(康为世纪)12.5 ?L,EGFPF(10 ?mol·L-1)1 ?L,EGFPR(10 ?mol·L-1)1 ?L,无菌水9.5 ?L,菌液1 ?L。PCR 反应程序为:95 ℃ 5 min;95 ℃ 30 s,55 ℃ 30 s,72 ℃ 30 s,35个循环;72 ℃ 5 min。PCR产物2%琼脂糖凝胶电泳检测。
1.2.4 稳定性检测 将电击转化后的菌株在不含卡那霉素(Kana)的NA固体培养基中连续转接活化培养20次,分析pBBR1MCS2-Tac-EGFP在R. solanacearum中的遗传稳定性。在第4次、第10次和第20次活化培养时,将菌株用无菌水冲洗,并稀释至OD600=1.0左右,并用Tecan Spark酶标仪测定其荧光强度,激发波长为485 nm,发射波长为535 nm,其中Gain值设定为80。采用Microsoft Excel 2019记录试验数据,采用SPSS 26.0进行统计学分析,采用Duncan极差法进行显著性检验。
1.2.5 R. solanacearum的定量分析 电转后的菌株挑单菌落在NA液体培养基中28 ℃ 200 r·min-1过夜培养至OD600=0.8左右,6 000 r·min-1离心10 min收集菌株,使用无菌水进行重悬浮至OD600=1.0,然后使用无菌水进行4倍梯度稀释。荧光强度采用Tecan Spark酶标仪测定,激发波长为485 nm,发射波长为535 nm,其中Gain值设定为80。
从距地面1 cm处收集茎基部的截面,并用光度计直接测量切割部分的发光强度[11]。在接种后,取马铃薯茎基上1 cm茎段用于R. solanacearum数量分析。将茎段使用75%酒精消毒后置于0.2 mL的无菌水中浸泡1 h,然后测其荧光强度。使用Microsoft Excel 2019进行线性回归分析。
1.2.6 致病力分析 将P2和P2-Tac-EGFP在NA固体培养基上连续活化2次后挑单菌落于NA液体培养基中,在28 ℃、200 r·min-1条件下过夜培养至OD600=1.0后,6 000 r·min-1离心10 min,取离心沉淀用无菌水稀释至OD600=0.1进行伤根接种至试管苗,每株接种20 mL菌液,每次接种10株,进行3次生物学重复,并选用无菌水做对照。接种后置于28 ℃光照培养箱,每天调查植株发病情况,记录病株数和病级。病情调查与分级标准:0级,无任何症状;1级,1~2个叶片萎蔫;3级,植株的1/3叶片萎蔫;5级,植株的1/2叶片萎蔫;7级,植株的2/3叶片萎蔫;9级,植株全部叶片萎蔫或死亡。计算病情指数,公式为:DI=Σ(si×ni)/9N×100,式中:DI—病情指数,si—发病级别,ni—相应发病级别的株数,i—病情分级的各个级别,N—调查总株数[27]。运用Microsoft Excel 2019进行数据整理及统计,绘制图像。
2 结果与分析
2.1 R. solanacearum菌株的分离及演化型鉴定
从马铃薯青枯病植株中共分离筛选出10株菌株,菌株在TTC固体培养基上为白色不规则形态,中间呈红色(图2)。PCR扩增及琼脂糖凝胶电泳检测结果显示,1~10号菌株条带均在280 bp左右,确定为R. solanacearum菌株(图3)。10株菌株条带均在144 bp左右,为演化型Ⅰ型菌株。
2.2 pBBR1MCS2-Tac-EGFP成功转入P2菌株
将广宿主载体pBBR1MCS2-Tac-EGFP电击转化P2菌株,得到阳性克隆,命名为P2-Tac-EGFP,并进行PCR检测,PCR产物琼脂糖凝胶电泳检测结果如图4所示,2、3号泳道扩增出750 bp左右的条带。在440 nm波长的蓝光激发下,P2-Tac-EGFP菌呈绿色荧光,如图5所示。以上结果均表明,pBBR1MCS2-Tac-EGFP已成功转入P2菌株。
2.3 P2-Tac-EGFP稳定表达荧光
将P2-Tac-EGFP菌株在NA琼脂培养基中连续培养20次,在第4次、第10次、第20次时测定P2-Tac-EGFP菌株的荧光强度,发现移植培养的第4次、第10次、第20次的荧光值并无显著性差异,这说明P2-Tac-EGFP菌株可以稳定遗传(图6)。
2.4 EGFP荧光值与菌落数呈线性相关
利用EGFP荧光定量分析细菌的克隆数具有高效快捷的特性。EGFP荧光强度与P2-Tac-EGFP数量呈线性相关,R?=0.995(图7)。当P2-Tac-EGFP菌液稀释至约9.0×105 CFU·mL-1时,EGFP荧光值接近于无菌水的荧光值。因此在9×105~1×109 CFU·mL-1范围内,可以使用EGFP荧光值计算R. solanacearum菌株数量。
2.5 pBBR1MCS2-Tac-EGFP的转入不影响青枯菌的致病力
将P2和P2-Tac-EGFP菌株同时伤根接种至‘Chieftain试管苗,以无菌水接种为对照,由图8可知,病情指数曲线趋势一致,表明P2与P2-Tac-EGFP的致病力无显著差异,只是P2-Tac-EGFP在接种后3~6 d时发病较快。
2.6 P2-Tac-EGFP可用于青枯病抗性评价
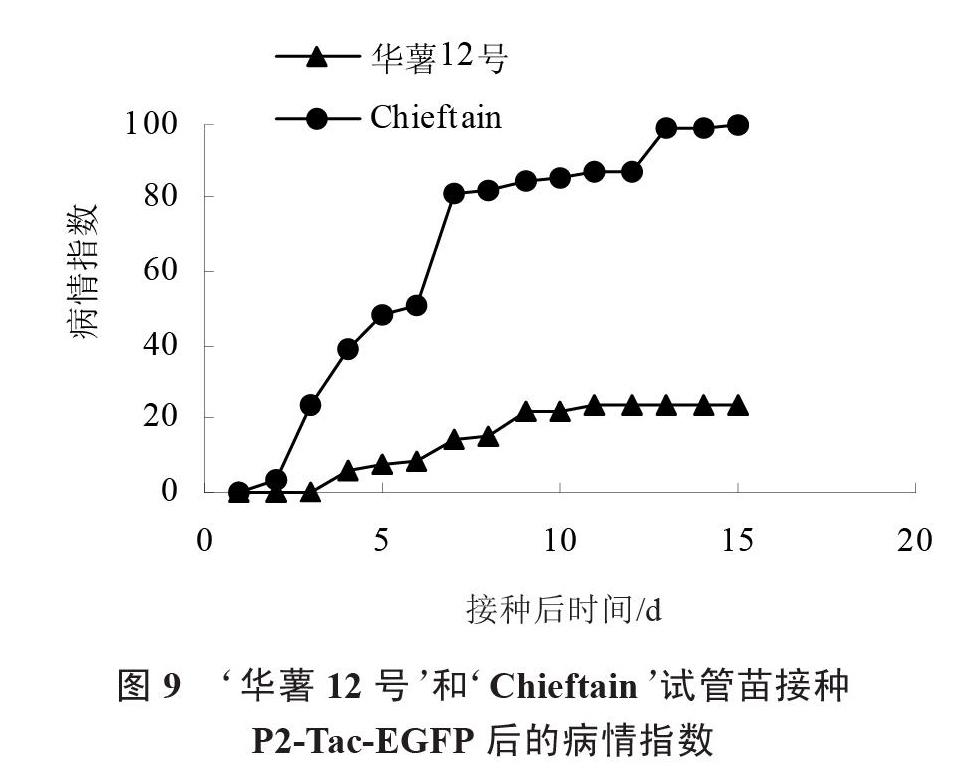
通过连续15 d的病情指数调查,发现当接种15 d时,‘Chieftain病情指数已达到最大值,其发病率达到100%,而此时‘华薯12号的病情指数为23.33(图9),计算出病指相对值为76.67,可证明‘华薯12号为高抗材料。
由图10可知,在440 nm波长蓝光激发下,接种1 d后,‘华薯12号和‘Chieftain试管苗均未发现荧光。接种2 d后,‘华薯12号根部发出微弱荧光(图10-a),而‘Chieftain根部荧光更加明显(图10-b),表明P2-Tac-EGFP已成功接种至试管苗中。接种4~6 d后,‘华薯12号试管苗中的荧光并没有向上迁移,叶片也无萎蔫;接种8 d后,荧光上移至茎基部,且植株叶片也无变化;接种15 d后,叶片无明显变化(图10-a)。接种4 d后,‘Chieftain试管苗中的荧光上升至植株中间部分,且部分叶片萎蔫;接种6 d后,荧光从维管束继续上升;接种10 d后,荧光已上升至植株顶部,全部叶片已萎蔫;接种15 d后,‘Chieftain试管苗全部萎蔫死亡(图10-b),EGFP荧光分布在整个茎秆的维管束,而‘华薯12号仅在根部有微弱的荧光,表明‘華薯12号为高抗材料。
为进一步分析R. solanacearum在根部的数量,分别在P2-Tac-EGFP菌株接种‘华薯12号和‘Chieftain试管苗的3、5、7、9 d取茎基部茎段在无菌水中浸泡1 h后测其荧光值,运用2.4中得出的公式推算其茎基部R. solanacearum细菌数。如图11所示,在‘华薯12号和‘Chieftain接种3 d和5 d后,茎基部细菌数无显著变化;在接种7 d后,‘Chieftain试管苗茎基部细菌数较之前显著增加;在接种9 d后,‘Chieftain试管苗茎基部细菌数趋于稳定;而在接种5~9 d后‘华薯12号试管苗茎基部细菌数无显著变化。
3 讨论与结论
笔者共从田间筛选出10株演化型Ⅰ型R. solanacearum菌株,从中选出了致病力最强的菌株P2,并成功将pBBR1MCS2-Tac-EGFP载体电击转入P2菌株中,标记菌落形态与普通R. solanacearum菌落形态相同,并且P2-Tac-EGFP能够在马铃薯试管苗中稳定表达,与P2菌株同时接种至感病植株‘Chieftain后发病情况基本一致,不影响R. solanacearum的致病力,也证实了其能够用于马铃薯抗性鉴定。R. solanacearum中导入EGFP发光报告基因有助于实时监测植物宿主中细菌的增长情况,能够更加立体地观察细菌定殖情况,为病原菌侵染植物过程的研究提供了可能。另外,发光报告基因的载入也简化了细菌计数的量化,发光强度与细菌定殖数呈正相关,说明可以通过荧光强度来推测细菌的定殖数,这大大提高了计算效率,能够在短时间内得出细菌在植株中的定殖数,这与PMA-PCR方法[28]和稀释平板计数法[29]相比更加快速便捷,传统的平板稀释培养法检测不出在逆境胁迫下进入VBNC(活的非可培养状态)的R. solanacearum,会造成一定程度的误差,PMA-PCR检测时,浓度若低于PCR检测限制,易出现假阳性结果。
GFP基因也被广泛应用于植物青枯病抗性鉴定研究中。Takenu等[16]以丝状噬菌体φRSS1为载体,构建GFP表达质粒,命名为pRSS12,并将其电击转化进青枯菌,在感染番茄组织和土壤样品后可检测到强烈绿色荧光。在番茄青枯病抗性机制研究中,Planas等[30]同时将LUX和GFP基因导入R. solanacearum中,对番茄植株进行了定殖的动态分析,共从4個水平上揭示了限制R. solanacearum入侵的主要方式,为番茄抗青枯病鉴定及育种提供了新的思路。车建美等[20]采用电击法进行R. solanacearum遗传转化,用gfp/luxAB基因标记了R. solanacearum,标记后的菌体细胞形状与亲本菌株形状相同,整个细胞呈现绿色荧光,在无选择压力条件下连续移植20次,仍然保持均匀而且强烈的绿色荧光,且对宿主的生长特性及致病力无影响,与本试验结果一致。
笔者将P2-Tac-EGFP菌株同时接种至‘华薯12号和‘Chieftain后,病情指数分析结果表明,‘华薯12号为抗病,‘Chieftain为感病。同时GFP标记的P2-Tac-EGFP在抗病材料‘华薯12号根部少量表达,并不向上侵染,而在感病材料‘Chieftain中则蔓延至整个植株。通过对根部R. solanacearum的克隆数进行分析,结果表明,‘华薯12号的R. solanacearum克隆数显著低于‘Chieftain。综合上述结果,表明‘华薯12号为抗病材料而不是处于潜伏侵染状态。通过调查马铃薯植株萎蔫程度或通过病情指数进行青枯病抗性鉴定时,潜伏感染的材料往往会因环境条件变化而无法检测出来[12,18]。笔者将具有EGFP荧光蛋白基因的R. solanacearum应用于青枯病抗性鉴定的接种试验中,能够有效直观地区分抗病、耐病或者潜伏侵染。这种方法具有便捷、成本低的特点,并且能快速实行,不需要复杂的试剂或设施,为筛选马铃薯抗R. solanacearum种质资源提供了新的思路。本试验中仅选用2个材料,下一步将运用此方法对其他材料进行抗性鉴定,进一步完善鉴定方法。
参考文献
[1]蔡兴奎,谢从华.中国马铃薯发展历史、育种现状及发展建议[J].长江蔬菜,2016(12):30-33.
[2]VAN HARSSELAAR J K,LORENZ J,SENNING M,et al.Genome-wide analysis of starch metabolism genes in potato (Solanum tuberosum L.)[J].BMC Genomics,2017,18(1):18-37.
[3]PARK S,GUPTA R,KRISHNA R,et al.Proteome analysis of disease resistance against Ralstonia solanacearum in potato cultivar CT206-10[J].The Plant Pathology Journal,2016,32(1):25-32.
[4]CHANG Y N,YU R M,FENG J L,et al.NAC transcription factor involves in regulating bacterial wilt resistance in potato[J].Functional Plant Biology,2020,47(10):925-936.
[5]李广存. 马铃薯青枯病抗性相关基因的分离及其功能分析[D].北京:中国农业科学院,2006.
[6]PRAMOD K S,SHAILENDRA S,AMRITA G,et al.A simplified protocol for reversing phenotypic conversion of Ralstonia solanacearum during experimentation[J].International Journal of Environmental Research and Public Health,2020,17(12):38-46.
[7]BOSCHI F,SCHVARTZMAN C,MURCHIO S,et al.Enhanced bacterial wilt resistance in potato through expression of Arabidopsis EFR and introgression of quantitative resistance from Solanum commersonii[J].Frontiers in Plant Science,2017,8:1-11.
[8]李林章.二倍体马铃薯青枯病抗性的分离及分子标记鉴定[D].武汉:华中农业大学,2004.
[9]陈琳.马铃薯体细胞杂种及其回交和自交后代遗传组分分析与青枯病抗性评价[D].武汉:华中农业大学,2013.
[10]李朋.马铃薯体细胞杂种回交后代青枯病抗性鉴定及分子标记检测[D].武汉:华中农业大学,2014.
[11]丁传雨.生物有机肥对土传马铃薯青枯病的防控技术及机理研究[D].南京:南京农业大学,2012.
[12]WANG H J,HU J X,LU Y,et al.A quick and efficient hydroponic potato infection method for evaluating potato resistance and Ralstonia solanacearum virulence[J].Plant Methods,2019,15:145.
[13]ALDON D,BRITO B,BOUCHER C,et al.A bacterial sensor of plant cell contact controls the transcriptional induction of Ralstonia solanacearum pathogenicity genes[J].The Embo Journal,2000,19(10):2304-2314.
[14]ZHENG X A,LI X J,WANG B S,et al.A systematic screen of conserved Ralstonia solanacearum effectors reveals the role of RipAB,a nuclear-localized effector that suppresses immune responses in potato[J].Molecular Plant Pathology,2019,20(4):547-561.
[15]MONTEIRO F,SOLE M,VAN D I,et al.A chromosomal insertion toolbox for promoter probing,mutant complementation,and pathogenicity studies in Ralstonia solanacearum[J].Molecular plant-microbe Interactions,2012,25(4):557-568.
[16]TAKERU K,HIDEKI S,MAKOTO F,et al.Monitoring of phytopathogenic Ralstonia solanacearum cells using green fluorescent protein-expressing plasmid derived from bacteriophage ?RSS1[J].Journal of Bioscience and Bioengineering,2007,104(6):451-456.
[17]张治飞.青枯菌的基因标记及马铃薯青枯病抗性相关信号途径探究[D].武汉:华中农业大学,2016.
[18]CRUZ A P Z,FERREIRA V,PIANZZOLA M J,et al.A novel, sensitive method to evaluate potato germplasm for bacterial wilt resistance using a luminescent Ralstonia solanacearum reporter strain[J].Molecular Plant-microbe Interactions,2014,27(3):277-285.
[19]CHALFIE M.Green fluorescent protein[J].Photochemistry and Photobiology,1995,62(4):651-656.
[20]車建美,蓝江林,刘波.转绿色荧光蛋白基因的青枯雷尔氏菌生物学特性[J].中国农业科学,2008,41(11):3626-3635.
[21]陈媛媛.广西植物青枯病菌的演化型和序列变种及葫芦科植物青枯病菌的特性[D].南宁:广西大学,2018.
[22]方中达.植病研究方法[M].3版.北京:中国农业出版社,2001.
[23]KELMAN A.The relationship of pathogenicity of Pseudomonas solanacearum to colony appearance in a tetrazolium medium[J].Phytopathology 1954,44(12):693-695.
[24]FEGAN M,PRIOR P.How complex is the “Ralstonia solanacearum” species complex?[M].American Phytopathological Society,2005:449-461.
[25]OPINA N,TAVNER F,HOLLWAY G,et al.A novel method for development of species and strain-specific DNA probes and PCR primers for identifying Burkholderia solanacearum (Formerly Pseudomonas solanacearum)[J].Asia-pacific Journal of Molecular Biology and Biotechnology,1997,5(1):19-30.
[26]王丽.中国马铃薯青枯菌致病力和遗传多样性研究[D].武汉:华中农业大学,2016.
[27]刘喜才.马铃薯种质资源描述规范和数据标准[M].北京:中国农业出版社,2006:2-14.
[28]高达芳,刘霞,杨艳丽.马铃薯青枯病病菌PMA-PCR活菌检测体系优化与初步应用[J].中国植保导刊,2017,37(10):5-13.
[29]郜刚.青枯菌诱导的马铃薯防卫相关基因克隆与表达[D].北京:中国农业科学院,2008.
[30]PLANAS M M, KRESSIN J P,KASHYAP A,et al.Four bottlenecks restrict colonization and invasion by the pathogen Ralstonia solanacearum in resistant tomato[J].Journal of Experimental Botany,2020,71(6):2157-2171.

