甜椒中螺虫乙酯主要代谢产物及残留量膳食摄入评估
吴绪金 马欢 汪红 周娟 安莉 崔敏 涂洪涛


摘 要:為了研究甜椒中螺虫乙酯主要代谢物的转化情况、施药措施与残留量的相关性,以及残留量膳食摄入评估,利用建立的螺虫乙酯及其4个主要代谢物的高效液相色谱三重四极杆串联质谱法,对施用过螺虫乙酯的甜椒样品进行检测分析及膳食摄入评估。结果表明,甜椒中螺虫乙酯及其4个主要代谢物的平均回收率为89%~107%,相对标准偏差为1.2%~4.0%,最低检测质量分数均为0.01 mg·kg-1。甜椒中螺虫乙酯风险评估定义残留量(w,后同)为0.05~0.91 mg·kg-1,监测定义残留量为0.02~0.79 mg·kg-1。甜椒中螺虫乙酯主要代谢物为酮基-羟基、烯醇-葡萄糖苷、烯醇。螺虫乙酯及其代谢物在甜椒中的残留量与施药次数和施药剂量呈正相关,与采收间隔期呈负相关。螺虫乙酯普通人群的国家估计每日摄入量是0.207 mg,占日允许摄入量的6.56%左右。按试验的施药剂量、施药次数和采收间隔期进行施药,认为对一般人群健康不会产生不可接受的风险。
关键词:甜椒;螺虫乙酯;主要代谢产物;膳食摄入评估
中图分类号:S641.3 文献标志码:A 文章编号:1673-2871(2021)01-042-07
Evaluation of dietary intake of major metabolites and residues of spirotetramat in sweet pepper
WU Xujin1, MA Huan1, WANG Hong1, ZHOU Juan1, AN Li1, CUI Min2, TU Hongtao3
(1. Institute of Quality Standard and Testing Technology for Agro-products, Henan Academy of Agricultural Sciences, Zhengzhou 450002, Henan, China; 2. Henan Agricultural Products Quality and Safety Testing Center, Zhengzhou 450002, Henan, China; 3. Zhengzhou Fruit Research Institute, CAAS, Zhengzhou 450009, Henan, China)
Abstract: In order to study the transformation of the main metabolites of spirotetramat in sweet pepper, analyze the correlation between application measures and residues, and evaluate the dietary intake of residues. A method for determination of spirotetramat and its four main metabolites based on liquid chromatography triple quadrupole mass spectrometry (LC-MS/MS) was developed, samples of pepper treated with spirotetramat were analyzed and dietary intake was assessed. The results showed that average recoveries of spirotetramat and its metabolites in pepper were range from 89% to 107%, with a relative standard deviation (RSD) of 1.2% to 4.0%, the limits of quantification (LOQ) were 0.01 mg·kg-1 for spirotetramat and its metabolites in pepper. Residue for dietary intake and enforcement in pepper of spirotetramat were 0.05-0.91 mg·kg-1 and 0.02-0.79 mg·kg-1, respectively. The main metabolites in pepper were ketohydroxy, enol glucoside, and enol. The residues of spirotetramat and its metabolites in pepper were positively correlated with the number of sprayed times and dosages, while negatively correlated with the days after spraying. The international estimated daily intake (IEDI) of spirotetramat is 0.207 mg, and the ADI% is calculated according to formula and found to be 6.56%, the potential health risk induced by spirodiclofen is not significant based on supervised residue trial data.
Key words: Pepper; Spirotetramat; Main metabolites; Risk assessment for dietary residue intake
螺虫乙酯化学名称为4-(乙氧基羰基氧基)-8-甲氧基-3-(2,5-二甲苯基)-1-氮杂螺[4,5]癸-3-烯-2-酮,英文通用名为spirotetramat,分子式为C21H27NO5。螺虫乙酯为脂质生物合成抑制剂,抑制乙酰辅酶A羧化酶。主要通过摄入,但也可通过接触药剂干扰昆虫的脂肪生物合成,导致卵和幼虫死亡,可降低成虫的繁殖能力。渗透进叶片后,螺虫乙酯被脱脂化,可在木质部和韧皮部双向传导。可用于防治棉花和大豆等大田作物、蔬菜和果树上的粉虱、蚜虫、介壳虫类、木虱和选定的蓟马品系等刺吸式口器害虫[1]。
国内外文献关于螺虫乙酯的研究主要包括检测方法研究、残留和消解试验及膳食摄入评估研究、加工或烹饪方式对残留量的影响研究。已报道的检测方法主要有螺虫乙酯及其4种代谢物在甜椒、苋菜、番茄、猕猴桃、柑橘、番茄和土壤、紫茄子和土壤、柑橘和土壤、梨和土壤、蔬菜和水果、动物源食品[2-14]中的QuEChERS前处理-超高效液相色谱三重四极杆串联质谱法。张燕等[15]报道了QuEChERS前处理-超高效液相色谱三重四极杆串联质谱法检测大米、茶叶、番茄、核桃、柑橘、葡萄中螺虫乙酯、烯醇-葡萄糖苷、酮基-羟基和烯醇残留量。Mohapatra等[16-17]、Mathew等[18]报道了螺虫乙酯在葡萄和土壤、杧果和土壤、辣椒中液相色谱二极管阵列检测器法;Pandiselvi等[19]、Kumar等[20]报道了螺虫乙酯及其烯醇代谢物在棉籽、棉绒、棉籽油和土壤中的液相色谱紫外检测器和二极管阵列检测器检测法;Singh等[21]、Pandiselvi等[22]报道了螺虫乙酯及其烯醇代谢物在多种蔬菜和土壤、4种热带土壤中的液相色谱法。Wu等[23]报道了螺虫乙酯在茶叶、木耳、芹菜、韭葱、柑橘、大豆和核桃中采用固相萃取和QuEChERS相结合前处理-液相色谱紫外检测器法。残留和消解试验及膳食摄入评估研究主要有以下试验。刘炎[8]报道了螺虫乙酯及其4种代谢物在番茄上的最终残留量和消解规律试验及慢性和急性风险评估;Zhang等[10]报道了柑橘和土壤中的最终残留量和消解规律试验及膳食风险评估。Chen等[3,28]报道了菠菜叶、茎、根和土壤中的消解规律试验;Pandiselvi等[19]报道了螺虫乙酯及其烯醇代谢物在棉花植株中的消解规律试验;Mathew等[18]、Vinothkumar等[24]、田宏哲等[25]报道了螺虫乙酯在青辣椒、辣椒、大豆和土壤中的消解规律试验。Pandiselvi等[22]和Mastan等[26]报道了螺虫乙酯及其代谢物在热带土壤沙壤土、壤土、砂质黏土、黏质沙土中的消解规律试验。Shukla等[9]和Bhardwaj等[27]报道了螺虫乙酯及其烯醇代谢物在紫茄子中的半衰期是1.71 d和1.09~1.36 d。丁丹等[6]报道了螺虫乙酯及其4种代谢物在柑橘中的半衰期为1.74~5.83 d;叶玉凤[7]报道了螺虫乙酯在柑橘和土壤中半衰期分别为8.9~14.7 d和1.1~5.0 d。刘炎[8]报道了螺虫乙酯及其代谢物在番茄上的贮藏稳定性试验。Chen等[3,28]报道了菠菜叶、茎、根和土壤中螺虫乙酯代谢物的转化情况,苋菜不同部位中螺虫乙酯代谢物的转化情况;螺虫乙酯在柑橘中主要代谢生成烯醇、酮基-羟基和烯醇-葡萄糖苷,在土壤中则主要生成酮基-羟基和烯醇-葡萄糖苷[7]。Han等[29]报道了螺虫乙酯及其烯醇代谢物在苹果及苹果加工成苹果醋的过程中,洗涤、去皮取芯、榨汁、初次过滤、酶解、第2次过滤、杀菌、发酵的每个步骤中残留量的变化。Liu等[30]报道了清洗、去皮和煮沸等家庭常用加工方式对柑橘中螺虫乙酯及其代谢物残留降解的影响,发现螺虫乙酯、烯醇、烯醇-葡萄糖苷和酮基-羟基的加工因子分别为<0.041、<0.125、<0.294和0.313。国内外关于甜椒中螺虫乙酯的主要代谢转化、施药措施与最终残留量的相关性、残留安全性评价及残留膳食摄入评估未见报道。筆者建立了超高效液相色谱三重四极杆串联质谱检测甜椒中螺虫乙酯及其4个代谢物的残留检测方法;通过建立的检测方法对甜椒中的螺虫乙酯主要代谢转化进行了研究,确定了主要转化的代谢物;对螺虫乙酯及其代谢物进行了检测,并对其残留量进行了膳食摄入风险评估,同时对不同施药剂量、施药次数和采样间隔与螺虫乙酯残留量相关性进行了研究,以期为评价螺虫乙酯在甜椒上的残留安全提供基础数据。
1 材料与方法
1.1 材料
被试物为22.4%螺虫乙酯悬浮剂,从拜耳作物科学(中国)有限公司购买。供试作物品种:河南‘豫甜大甜椒,由河南省农业科学院园艺研究所提供;江苏‘美国厚皮甜椒王,由江苏省农业科学院农产品质量安全与营养研究所提供;湖南‘湘甜4号,由湖南文谱检测技术研究有限公司提供;四川‘瑞克斯旺37-191,由四川省农业科学院分析测试中心提供;山西‘巴三牛椒,由山西省农业科学院植物保护研究所提供;广西‘盛宴甜椒,由广西大学提供。
1.2 试验设计
田间试验时间为2018年6—11月,地点分别为河南省新乡市平原新区王村、江苏省南京市溧水区白马镇、湖南省长沙县黄花镇崩坎村、四川省西昌市裕隆回族乡牛吉巷、山西省晋中市榆次区东阳镇东阳村和广西壮族自治区百色市田东县林逢镇。施药剂量均按有效成分(g a.i.·hm-2)进行计算。试验小区面积为50 m2,甜椒株距为35~40 cm,行距为50 cm。甜椒中螺虫乙酯最终残留量试验按剂量108 g a.i.·hm-2和162 g a.i.·hm-2分别施药2次和3次。具体施药时间如下,河南为2018年8月2—22日,江苏为2018年10月21日至11月10日,湖南为2018年9月9—29日,四川为2018年11月13日至12月3日,山西为2018年6月3日至7月20日,广西为2018年11月29日至12月19日,施药间隔10 d,对水混匀后,植株喷雾,最后1次施药后3 d、5 d和7 d随机采样,在试验小区内甜椒植株不同方向及上、中、下不同部位采集生长正常、无病害、成熟的甜椒2 kg以上。在清水对照小区内采集甜椒的对照样品。田间采集的甜椒样本去柄,切块后加干冰粉碎,-20 ℃保存待测。样品检测单位为河南省农业科学院农业质量标准与检测技术研究所。
1.3 检测方法
1.3.1 试剂与仪器 试剂:甲酸(色谱纯,CNW Technologies)、乙腈(色谱纯,默克股份两合公司)、氯化钠(分析纯,国药集团化学试剂有限公司)、甲醇(色谱纯,默克股份两合公司)、PSA吸附剂(天津博纳艾杰尔科技有限公司)、GCB吸附剂(天津博纳艾杰尔科技有限公司)、螺虫乙酯标准品(99.0%,德国Dr. Ehrenstorfer)、烯醇-葡萄糖苷标准品(94.8%,德国Dr. Ehrenstorfer)、酮基-羟基标准品(94%,德国Dr. Ehrenstorfer)、烯醇标准品(99.1%,德国Dr. Ehrenstorfer)、单-羟基标准品(99.7%,德国Dr. Ehrenstorfer)。
仪器:高效液相色谱仪(LC-30AD):日本岛津仪器公司;质谱仪(LCMS-8050):日本岛津仪器公司;电子天平(SQP系列):赛多利斯科学仪器(北京)有限公司;电子天平(BS 2202 S):赛多利斯科学仪器(北京)有限公司;Milli-Q Synthesis 超纯水系统:Millipore公司;超声波清洗仪(KQ-5200):昆山市超声仪器有限公司;多管涡旋振荡器(TARGIN? VX-Ⅲ):北京踏锦科技有限公司;台式低速离心机(L-550):湖南湘仪实验室仪器开发有限公司;食品切碎搅拌机(R10 V. V.):法国Robot Coupe公司。
1.3.2 提取及净化 准确称取10.00 g样品(精确至0.01 g)于100 mL离心管中,加20 mL乙腈,2.5 g氯化钠,放置多管涡旋振荡器中涡旋10 min,4 000 r·min-1离心5 min,移取2 mL上清液至含有0.05 g PSA和0.02 g GCB的2 mL离心管中,涡旋1 min,4 000 r·min-1离心5 min,经0.22 ?m针孔滤膜过滤于进样小瓶中,待LC/MS/MS分析。
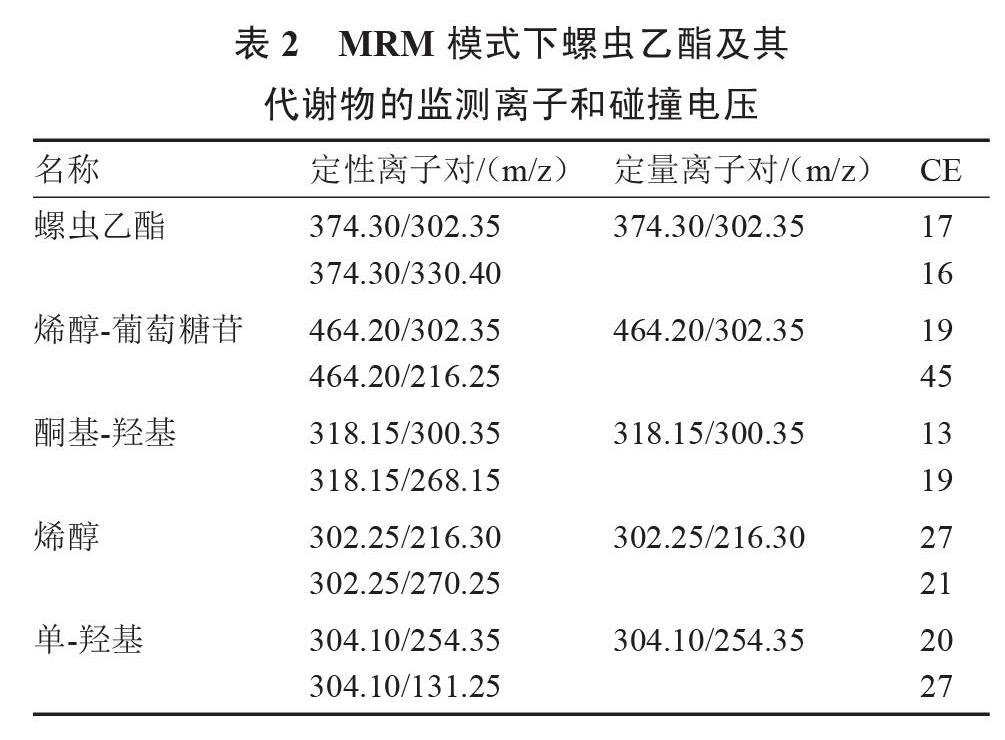
1.3.3 仪器条件 液相色谱柱:Shim-pack GISS(2.1 mm×50 mm,1.9 ?m);柱温:40 ℃;电离方式:ESI+;CID气:270 kpa;雾化气流量:3.0 L·min-1;加热气流量:10 L·min-1;接口温度:300 ℃;DL温度:250 ℃;加热块温度:400 ℃。流动相梯度洗脱条件见表1,MRM模式下螺虫乙酯及其代谢物的监测离子和碰撞电压见表2。
1.4 长期膳食摄入评估
依据卫生部2002年发布的《中国不同人群消费膳食分组食谱》中的膳食结构数据,结合螺虫乙酯残留化学评估推荐的规范残留试验中值和已制定的螺虫乙酯最大残留限量(MRLs),计算螺虫乙酯的国家估算每日摄入量(NEDI),计算公式参考张志恒等[31]。
1.5 数据分析
使用Microsoft Excel 2010进行数据整理和分析。
2 結果与分析
2.1 检测方法
2.1.1 标准曲线 将螺虫乙酯、烯醇-葡萄糖苷、酮基-羟基、烯醇、单-羟基标准品用乙腈溶解定容制成1 000 mg·L-1的混合母液,用甜椒空白基质溶液逐级稀释为0.005、0.010、0.020、0.050、0.100 mg·L-1系列标准溶液,在1.3.3条件下进行检测,横坐标为质量浓度(mg·L-1),纵坐标为峰面积(A),标准曲线见表3。
2.1.2 添加回收率 将不同浓度的螺虫乙酯、烯醇-葡萄糖苷、酮基-羟基、烯醇、单-羟基标液分别加入甜椒空白对照样品中,混合均匀,静置2 h,按1.3.2进行样品的提取和净化。由表4可以看出,当添加水平(w)是0.01、0.10和2.00 mg·kg-1时,螺虫乙酯的平均回收率为91%~99%,相对标准偏差为1.9%~3.2%;烯醇-葡萄糖苷的平均回收率为89%~96%,相对标准偏差为1.6%~3.2%;酮基-羟基的平均回收率为98%~103%,相对标准偏差为1.7%~2.9%;烯醇的平均回收率为99%~107%,相对标准偏差为2.1%~4.0%;单-羟基的平均回收率为92%~99%,相对标准偏差为1.2%~3.0%。农业行业标准《农作物中农药残留试验准则》规定添加质量分数大于1.00 mg·kg-1时,回收率应在70%~110%,相对标准偏差应≤10%;添加质量分数大于0.010 mg·kg-1而小于等于0.100 mg·kg-1时,回收率应在70%~120%,相对标准偏差应≤20%;添加质量分数大于0.001 mg·kg-1而小于等于0.010 mg·kg-1时,回收率应在60%~120%,相对标准偏差应≤30%,添加回收率结果符合上述要求。该方法螺虫乙酯及其4个代谢物的最低检测质量分数均为0.010 mg·kg-1;最小检出量螺虫乙酯和烯醇均为5×10-13 g,烯醇-葡萄糖苷和单-羟基均为2×10-12 g,酮基-羟基为1×10-12 g。
2.2 甜椒中螺虫乙酯最终残留量
2018年河南省、江苏省、湖南省、四川省、山西省、广西壮族自治区6地不同施药剂量、施药次数和采收间隔期螺虫乙酯、烯醇-葡萄糖苷、酮基-羟基、烯醇、单-羟基、风险评估定义(螺虫乙酯+烯醇葡萄糖苷×0.806+酮基羟基×1.177+烯醇×1.239+单羟基×1.231)、监测定义(螺虫乙酯+烯醇×1.239)残留量检测结果见表5。
2.3 不同施药措施与最终残留量相关性
2018年6地不同施药剂量、施药次数和采收间隔期与螺虫乙酯风险评估定义和监测定义最终残留量相关性分析结果见表6。从表6可以看出,当施药次数和施药剂量相同时,甜椒中螺虫乙酯风险评估定义残留量和监测定义残留量均随着采收间隔期的增加在减少,说明采收间隔期与最终残留量存在负相关。可能是因为随着采收时间的延长,螺虫乙酯及其代谢物在消解;同时甜椒没有停止生长,其生长的稀释作用进一步降低螺虫乙酯及其代谢物最终残留量。当采收间隔期和施药次数相同时,螺虫乙酯及其代谢物的残留量随着施药剂量的增加而增加,表明螺虫乙酯及其代谢物在甜椒中的残留量和施药剂量呈正相关。当施药剂量和采收间隔期相同时,螺虫乙酯及其代谢物的残留量随着施药次数的增加而增加,表明螺虫乙酯及其代谢物在甜椒中的残留量和施药次数呈正相关。
2.4 长期膳食摄入评估
我国城乡居民的干豆类及其制品、深色蔬菜、浅色蔬菜和水果的每日食物摄入量分别为0.016 kg、0.091 5 kg、0.183 7 kg和0.045 7 kg。本实验室在干豆类及其制品(豌豆)、浅色蔬菜(黄秋葵)和水果(山楂)上已有规范的残留试验报告,残留中值分别为0.050 mg·kg-1、0.140 mg·kg-1、3.700 mg·kg-1,见表7。本试验中深色蔬菜(甜椒)中螺虫乙酯残留中值为0.12 mg·kg-1,我国规定螺虫乙酯的ADI值为0.050 mg·kg-1 bw,我国居民的平均体重为63 kg,螺虫乙酯普通人群的长期膳食摄入评估结果见表8。
3 讨论与结论
本试验前处理方法有机提取溶剂为市场上易购买的乙腈,且用量较少,有利于节省试验成本,减少试剂对环境的污染。前处理方法提取10 min,离心5 min,涡旋1 min,再次离心5 min,用时较短,有利于提高试验效率,节省试验时间。本试验检测方法操作简单,检测结果的精密度、重现性和准确度均符合标准的规定。
螺虫乙酯在不同基质中可能转化成不同的代谢物,螺虫乙酯在菠菜叶中主要代谢生成酮基-羟基、烯醇-葡萄糖苷、烯醇;菠菜茎中主要代谢生成烯醇-葡萄糖苷和烯醇;菠菜根中主要代谢生成烯醇;种植菠菜的土壤中主要代谢生成酮基-羟基和单-羟基[3]。螺虫乙酯在柑橘全果中主要代谢生成烯醇、酮基-羟基和烯醇-葡萄糖苷,种植柑橘的土壤中则主要代谢生成酮基-羟基和烯醇-葡萄糖苷[7]。本试验结果是螺虫乙酯在甜椒中主要代谢生成酮基-羟基、烯醇-葡萄糖苷、烯醇,与菠菜叶中和柑橘全果中转化代谢一致,螺虫乙酯在这3类果蔬中农药残留监测和样品抽检时建议重点考虑上述3种代谢物。引起螺虫乙酯在甜椒、菠菜叶和柑橘全果中的转化代谢物一致,而在土壤中的转化代谢物不一致的原因有待进一步研究。
我国和国际食品法典委员会均未制定甜椒中螺虫乙酯的最大残留限量[32],无法通过检测结果直接判定按本试验的施药方法施药后的甜椒残留是否合格,因此需要对按照本试验的施药次数、施药剂量和采收间隔期使用后的甜椒进行膳食摄入评估。根据1.4中公式进行计算,螺虫乙酯普通人群的国家估计每日摄入量是0.207 mg,占日允许摄入量的6.56%左右,认为螺虫乙酯在甜椒中的残留对一般人群健康的影响是在一个可接受的风险水平。
本试验采用了食品中农药残留风险评估指南中长期膳食摄入评估的方法对螺虫乙酯进行了评估,按本试验的施药剂量、施药次数和采收间隔期进行施药,认为对一般人群健康不会产生不可接受的风险。
参考文献
[1] MACBEAN C.农药手册[M].胡笑形,译.北京:化学工业出版社,2015:934.
[2] LI S S,LIU X G,DONG F S,et al.Chemometric-assisted QuEChERS extraction method for the residual analysis of thiacloprid,spirotetramat and spirotetramat's four metabolites in pepper:Application of their dissipation patterns[J].Food Chemistry,2016,192:893-899.
[3] CHEN X J,MENG Z Y,ZHANG Y Y,et al.Degradation kinetics and pathways of spirotetramat in different parts of spinach plant and in the soil[J].Environmental Science and Pollution Research,2016,23(15):15053-15062.
[4] 刘炎,欧阳迪庆,叶玉凤,等.QuEChERS结合超高效液相色谱-串联质谱法同时测定番茄中噻虫嗪、噻虫胺、螺虫乙酯及其代谢物残留[J].分析测试学报,2017,36(12):1431-1438.
[5] 黄玉南,乔成奎,庞涛,等.螺虫乙酯及其代谢产物在猕猴桃中的残留消解动态[J].现代食品科技,2018,34(12):1-7.
[6] 丁丹,杨仁斌,雷鸣,等.螺虫乙酯及其四种代谢产物在柑桔中的消解残留规律研究[J].中国南方果树,2018,47(3):41-45.
[7] 叶玉凤.螺虫乙酯在柑橘和土壤中的残留规律和降解动态研究[D].重庆:西南大学,2018.
[8] 刘炎.30%螺虫乙酯·噻虫嗪悬浮剂在番茄和土壤中的残留及其对品质的影响[D].重庆:西南大学,2018.
[9] SHUKLA V R,PATEL A R,PARMAR K D,et al.Persistence of spirotetramat residues in/on brinjal and soil[J].Pesticide Research Journal,2016,28(2):243-247.
[10] ZHANG Q T,CHEN Y L,WANG S Y,et al.Dissipation,residues and risk assessment of spirotetramat and its four metabolites in citrus and soil under field conditions by LC-MS/MS[J].Biomedical Chromatography,2018,32(4):e4153.
[11] 熊永,萬亚美,郭聪聪,等.螺虫乙酯·伊维菌素在梨和土壤中的残留分析方法[J].河北农业大学学报,2018,41(4):82-86.
[12] ZHU Y L,LIU X G,XU J,et al.Simultaneous determination of spirotetramat and its four metabolites in fruits and vegetables using a modified quick easy cheap effective rugged and safe method and liquid chromatography tandem mass spectrometry[J].Journal of Chromatography A,2013,1299:71-77.
[13] 郭庆龙,管旭芳,赵勇,等.气相色谱-质谱法测定蔬菜和水果中螺虫乙酯的残留量[J].理化检验(化学分册),2017,53(8):885-889.
[14] 韩丙军,林冰,黄海珠,等.超高效液相色谱-串联质谱法测定动物源食品中螺虫乙酯及其代谢物残留[J].食品科技,2017,42(12):297-302.
[15] 張燕,舒平,赵浩军,等.分散固相萃取-超高效液相色谱-串联质谱法测定农产品中螺虫乙酯及其3种代谢产物残留量[J].食品安全质量检测学报,2018,9(13):3245-3250.
[16] MOHAPATRA S,KUMAR S,PRAKASH G S.Residue evaluation of imidacloprid,spirotetramat,and spirotetramat-enol in/on grapes (Vitis vinifera L.) and soil[J].Environmental Monitoring and Assessment,2015,187(10):632-643.
[17] MOHAPATRA S,DEEPA M,LEKHA S,et al.Residue dynamics of spirotetramat and imidacloprid in/on mango and soil[J].Bulletin of Environmental Contamination and Toxicology,2012,89(4):862-867.
[18] MATHEW T B,BEEVI S N,GEORGE T,et al.Persistence and dissipation of combination-mix (spirotetramat+imidacloprid) on chilli (Capsicum annum L.)[J].Pesticide Research Journal,2012,24(2):151-154.
[19] PANDISELVI S,SATHIYANARAYANAN S,RAMESH A.Determination of spirotetramat and imidacloprid residues in cotton seed,lint,oil and soil by HPLC UV method and their dissipation in cotton plant[J].Pesticide Research Journal,2010,22(2):168-173.
[20] KUMAR B V,KUTTALAM S.Harvest time residues of spirotetramat in cotton[J]. Madras Agricultural Journal,2012,99(7/9):580-582.
[21] SINGH B,MANDAL K,SAHOO S K,et al.Development and validation of an HPLC method for determination of spirotetramat and spirotetramat cis enol in various vegetables and soil[J].Journal of AOAC International,2013,96(3):670-675.
[22] PANDISELVI V,SATHIYANARAYANAN S,RAMESH A.Dissipation of spirotetramat and imidacloprid in four different tropical soils-confirmation of residues by electrospray tandem mass spectrometry[J].Pesticide Research Journal,2011,23(1):45-51.
[23] WU J X,WANG C J,WANG K,et al.Determination of spirotetramat in complex matrices combining QuEChERs and solid phase extraction followed by high performance liquid chromatography[J].Asian Journal of Chemistry,2015,27(8):2779-2782.
[24] VINOTHKUMAR B,KUTTALAM S,CHANDRASEKARAN S.Dissipation pattern of spirotetramat in/on green chillies[J].Pesticide Research Journal,2012,24(1):96-100.
[25] 田宏哲,张明浩,周鑫杰,等.螺虫乙酯在大豆和土壤中的残留及消解动态[J].河北农业大学学报,2018,41(4):73-76.
[26] MASTAN J,SRINIVAS B N,NAGESWARA R T,et al.Dissipation kinetics of spirotetramat and its metabolite in four different soils[J].Analytical Chemistry,2016,16(10):433-440.
[27] BHARDWAJ U,JYOT G,MANDAL K,et al.Residues of spirotetramat and imidacloprid in brinjal (Solanum melongena L.) and their risk assessment[J].Pesticide Research Journal,2016,28(1):35-41.
[28] CHEN X J,MENG Z Y,REN L,et al.Determination and safety assessment of residual spirotetramat and its metabolites in amaranth (Amaranthus tricolor) and soil by liquid chromatography triple-quadrupole tandem mass spectrometry[J].Journal of AOAC International,2018,101(3):848-857.
[29] HAN Y T,XU J,DONG F S,et al.The fate of spirotetramat and its metabolite spirotetramat-enol in apple samples during apple cider processing[J].Food Control,2013,34(2):283-290.
[30] LIU Y Y,SU X S,JIAN Q,et al.Behaviour of spirotetramat residues and its four metabolites in citrus marmalade during home processing[J].Food Additives & Contaminants:Part A-Chemistry Analysis Control Exposure and Risk Assessment,2016,33(3):452-459.
[31] 張志恒,汤涛,徐浩,等.果蔬中氯吡脲残留的膳食摄入风险评估[J].中国农业科学,2012,45(10):1982-1991.
[32] 中华人民共和国卫生和计划生育委员会,中华人民共和国农业农村部,国家市场监督管理总局.GB 2763-2019:食品安全国家标准食品中农药最大残留限量[S].北京:中国农业出版社,2019.

