肾透明细胞癌胰腺转移患者的临床特征和预后分析
付琳琳 陈幸运 赵天锁 胡金萌 白伟伟 赵凯丽 董久兴 王健
1天津医科大学肿瘤医院胰腺科 国家肿瘤临床医学研究中心 天津市肿瘤防治重点实验室 天津市恶性肿瘤临床医学研究中心,天津 300060;2天津市儿童医院,天津 300000;3河北中石油中心医院肿瘤科,廊坊 065000
胰腺转移性肿瘤在临床上比较罕见,占胰腺肿瘤的2%~5%[1]。其中最常见的原发性恶性肿瘤是肾细胞癌,它占所有胰腺转移瘤的63%~70%。其他原发疾病包括黑色素瘤(9.1%)、结直肠癌(8.8%)、肉瘤(4.5%)、乳腺癌(4.3%)和肺癌(3.1%)[2-4]。与原发性胰腺肿瘤相比,继发于肾细胞癌的胰腺转移性肿瘤预后较好[5]。本研究收集了20例肾透明细胞癌胰腺转移患者的临床和随访资料,回顾性分析其临床特征和预后情况。
资料与方法
收集2000年1月至2020年5月间天津医科大学肿瘤医院收治的经病理确诊的肾透明细胞癌胰腺转移患者的临床资料,排除非肾细胞癌的胰腺转移性肿瘤及其他病理类型的肾癌患者,共纳入20例,其中胰腺切除术9例,姑息治疗11例。所有患者均进行电话或门诊随访,随访时间截止至2020年5月。
记录20例肾透明细胞癌胰腺转移患者的性别、年龄、转移时间、复发时间、转移部位、胰腺转移灶数目及对于胰腺转移灶是否进行手术等,分析其预后影响因素。
应用SPSS 23.0软件进行统计学分析。计数资料以例表示,组间比较采用χ2检验。总生存时间的定义为患者确诊至因任何原因导致的死亡时间。生存分析采用Kaplan-Meier法,影响预后因素判断采用Log-Rank检验。P<0.05为差异有统计学意义。
结 果
20例患者中男性12例,女性8例,男女比例为1.5∶1。确诊肾透明细胞癌的年龄35~67岁,中位年龄为50岁。原发肾癌位于左肾12例(60%),右肾8例(40%)。确诊时肾癌分期为Ⅰ、Ⅱ期患者18例(90%),其中16例行根治性肾癌切除术,2例行部分肾癌切除术,分别在术后13~240个月后发现胰腺转移(异时性转移),从确诊肾透明细胞癌到发生胰腺转移的中位时间为102个月。2例(10%)患者在确诊肾癌时即发现胰腺转移(同时性转移),属于Ⅳ期,仅行肾癌切除术。远处转移部位除胰腺外,还包括肺、骨骼、肝脏、肾上腺。
3例次患者因上腹疼痛就诊,2例次出现腰背部疼痛,1例次上腹不适,1例次有乏力症状,4例次自诉近期出现明显体重下降,12例次无明显不适,于常规体检或肾癌术后复查时发现。20例患者中单发病灶12例(60%),其中位于胰头4例,胰颈1例,胰体2例,胰尾4例;多发病灶8例(40%),病灶分布于整个胰腺。肿瘤最大径为(2.4±0.7)cm。除胰腺转移外,7例患者合并其他部位转移,其中合并肺转移5例次,肾上腺转移2例次,骨骼、肝脏、腹膜转移各1例次。10例患者同时患有糖尿病,7例有吸烟史,4例有饮酒史,3例在确诊肾癌前有其他肿瘤病史,6例有肿瘤家族史。
肾透明细胞癌胰腺转移在增强CT中表现为富血供,动脉期明显强化(图1A),静脉期(图1B)及延迟期强化程度有所降低,但仍高于正常胰腺实质。

图1 胰腺头部多发转移癌的CT增强动脉期(1A)及静脉期(图1B)表现(白色箭头为胰腺转移病灶)
三、病理特征
镜下见胰腺转移瘤组织呈索状、巢状或管状分布(图2A),肿瘤细胞呈圆形或卵圆形,边界清晰,胞质透明,嗜酸性,核仁明显(图2B),肿瘤细胞呈浸润性生长,局部可见出血。免疫组织化学染色结果显示,PAX8、RCC、Ag、CK8、CK18、CA9(图2C)、vimentin(图2D)、CD10(图2E)均呈阳性表达,CgA、syn、HMB-45、SMA、CK7(图2F)、CK20、CDX2、β-catenin均呈阴性表达。

图2 肾透明细胞胰腺转移癌组织活检病理,镜下见胰岛呈巢状、胰腺导管以及萎缩的胰腺腺泡(2A, HE染色 ×40);转移癌肿瘤细胞呈圆形或卵圆形,胞质丰富、透明,核仁明显,局部见出血灶(2B, HE染色 ×200);CA9(2C)、vimentin(2D) 、CD10(2E)均表达阳性,CK7(2F)表达阴性 (免疫组织化学 ×200)
20例患者中9例行胰腺切除术,其中3例行胰十二指肠切除术,5例行胰体尾切除+脾脏切除术,1例行胰头肿瘤亚氦刀冷冻治疗+胰体尾切除+脾脏切除术,术后4例行辅助治疗。
20例患者中13例给予酪氨酸激酶抑制剂靶向治疗(用药至疾病进展或出现不可耐受的毒性),治疗时间为1~72个月,不良反应主要包括高血压、腹泻、恶心呕吐、食欲不振、体重下降、浑身乏力、手足皮肤反应、甲状腺功能异常等,用药期间曾进行药物剂量调整或暂停用药。1例给予树突状细胞肿瘤疫苗(DC瘤苗)生物治疗(用药至疾病进展),1例入组临床实验(PD-1联合免疫治疗组或对照组),5例行胰腺转移瘤切除术后未行辅助治疗。
20例患者均获得随访,随访时间为1~256个月,平均122.9个月。3例死亡,17例生存,20例患者中位生存时间为75.9个月,5年生存率为66.7%。单因素分析结果显示,肾透明细胞癌胰腺转移患者的预后与转移时间、转移部位有关(P值均<0.05),而与患者性别、年龄及肿瘤复发时间、胰腺转移病灶数目、是否手术无关(表1)。
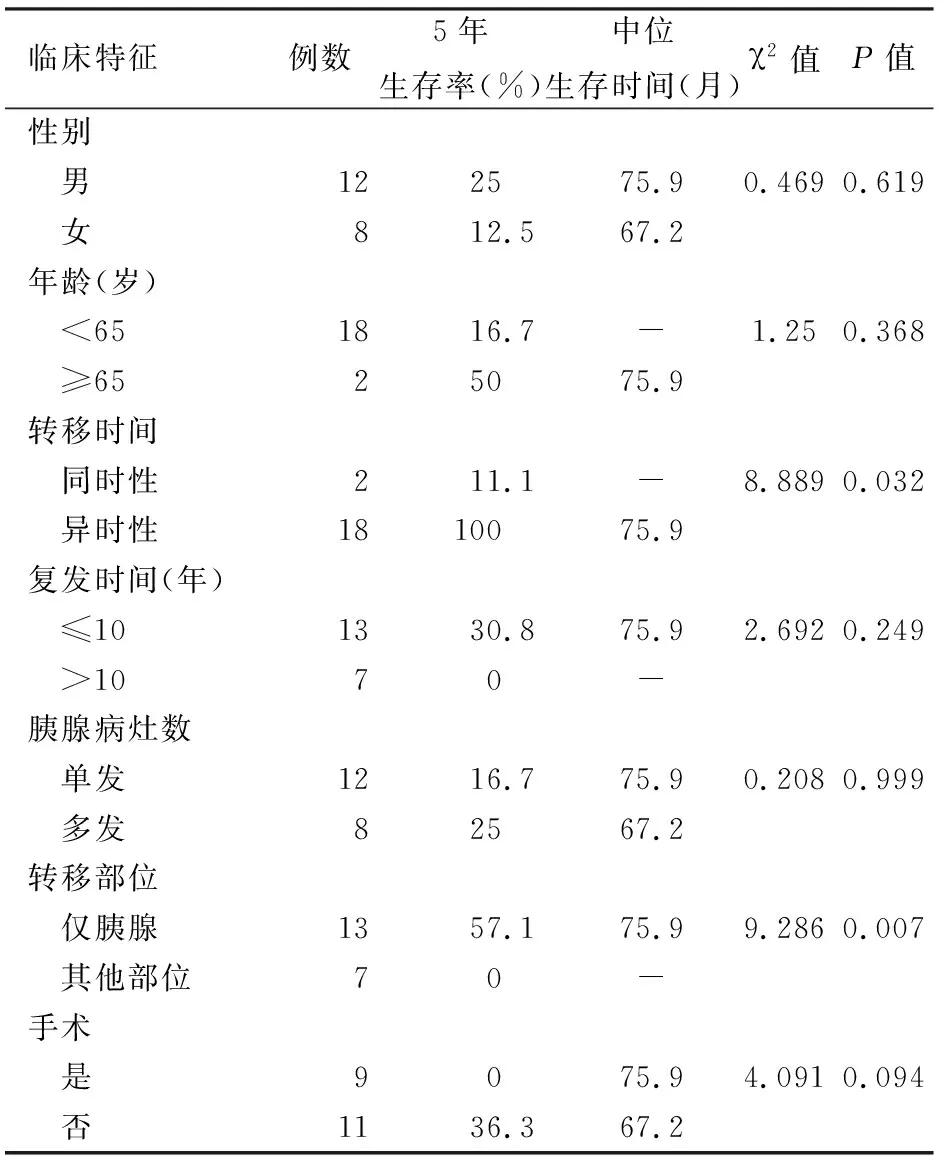
表1 肾透明细胞癌胰腺转移患者预后与肿瘤临床特征的相关性
讨 论
肾透明细胞癌是成人最常见的肾癌类型,5年生存率高达95%。其中20%~30%的患者在最初确诊肾癌时即发现转移,40%~50%患者在肾切除术后发生转移,转移性患者的5年生存率<10%~15%[1]。肾癌的常见转移部位为肺、骨、肝脏,胰腺转移并不常见。本研究20例患者中,13例患者仅发生胰腺转移,7例患者同时合并肺、骨、肝脏等其他部位转移,仅发生胰腺转移的肾透明细胞癌患者和同时合并其他部位转移的患者生存期的差异有统计学意义。肾透明细胞癌发生胰腺转移,常与原发病灶异时出现。Miyao等[6]研究表明,肾癌术后10年复发的概率为4.7%~11%。张智旸等[7]研究纳入18例肾透明细胞癌胰腺转移性患者,8例患者为10年内复发,10例患者为10年后复发,显示复发时间与患者预后相关。本研究中7例(35%)患者在根治性肾癌切除术10年后出现胰腺转移,20例患者发生胰腺转移的中位间隔时间为102个月,最长间隔时间为20年。肾癌胰腺转移患者多无明显症状,通常在随访或常规体检中发现。因此,肾癌术后长期规律的随访是必要的。
腹部CT可发现胰腺占位性病变,但要注意区分转移瘤与胰腺原发肿瘤。大多数胰腺转移病灶的强化程度和方式与原发性肾细胞癌相似,动脉期强化明显,静脉期强化减弱,延迟期强化明显减弱,呈现“快进快出”模式。胰腺癌动脉期可见轻度强化,静脉期延迟强化,延迟期增强,胆总管和主胰管梗阻较为常见,并伴有胰腺上游组织萎缩,同时,邻近组织的局部侵犯、淋巴结转移和肝脏转移较常见[8]。区分肾癌胰腺转移与胰腺神经内分泌肿瘤尚存在一定困难,应结合病史、病理确诊。
近年来,胰腺手术并发症的发病率和死亡率显著下降[9-10],因此,可以考虑手术切除孤立的胰腺转移瘤。有研究报道[11-14]接受手术的肾癌胰腺转移患者的5年生存率为72%,较未经过治疗的患者有较大提高。本研究未发现进行胰腺切除的患者有更高的生存率,这可能与本研究纳入病例较少有关。肾癌胰腺转移是否需要常规的淋巴结清除术尚有争议。Law等[15]推荐标准的胰腺切除术加常规区域淋巴结切除。Lee等[16]指出淋巴结受累对胰腺转移患者的预后无明显影响。本研究未发现淋巴结阳性患者。
肾透明细胞癌胰腺转移相较于其他肿瘤的胰腺转移具有更好的预后,这可能与肾透明细胞癌的生物学惰性、血管生成增强、无间质炎症的特点有关[17]。纪念斯隆-凯特琳癌症中心预后评分(MSKCC)和国际转移性肾细胞癌联合数据库评分(IMDC)常用于评估肾癌转移患者的预后,大量文献报道,MSKCC和IMDC是影响肾癌转移性患者的预后因素。由于本研究缺乏数据,无法验证这种分层,但可以考虑将其作为筛选合适的患者进行不同治疗的标准。
利益冲突所有作者均声明不存在利益冲突
——中国居民收入分配中的逆向调节机制

