体外沉默异戊二烯基半胱氨酸羧基甲基转移酶对人舌鳞状细胞癌细胞增殖和凋亡的影响
王少如 孙伟 周男 赵开 李文健 迟增鹏 王莹王奇民 童磊 何宗轩 韩红钰 陈正岗
1.青岛大学附属青岛市市立医院口腔医学中心,青岛266071;2.大连医科大学口腔医学院,大连116044;3.潍坊医学院口腔医学院,潍坊261021;4.青岛大学口腔医学院,青岛266003;5.济南市第四人民医院口腔科,济南250031;6.青岛大学附属医院口腔颌面外科,青岛266005
口腔癌是一种常见的头颈部恶性肿瘤,90%为口腔鳞状细胞癌。其中舌鳞状细胞癌(tongue squamous cell carcinoma,TSCC)约占口腔鳞状细胞癌的30%,是口腔癌中最常见的恶性肿瘤之一[1-2],具有发病率高、发展快、转移早、致死率高等特点,虽然医疗技术在不断改进,但患者5年生存率仍在50%~60%[3]。近年来流行病学调查发现舌癌发病率逐渐增加,且发病年龄呈年轻化趋势[4-5],故寻找新的治疗方案至关重要。
Rho GTPases 属于小G 蛋白的Ras 超家族中的一个独立家族,具有三磷酸鸟苷(guanosine triphosphate,GTP)酶活性,在胞质中与二磷酸鸟苷(guanosine diphosphate,GDP)结合处于非活性状态,与GTP 结合后处于活性状态并与胞膜稳定结合。其作为信号转换器或分子开关可与上游激活物和下游靶点相互作用,通过参与细胞黏附、细胞骨架重建、细胞增殖和凋亡、细胞运动等行为发挥生物学功能[6]。因其羧基末端均含有一个-CAAX 终端盒,缺乏传统膜相关蛋白所具有的跨膜或疏水结构域,需经过一系列翻译后修饰才能发挥蛋白膜靶向性及生物学功能[7]。异戊二烯基半胱氨酸羧基甲基转移酶(isoprenylcysteine carboxyl methyltransferase,Icmt)作为Rho 蛋白翻译后修饰的第三步修饰酶,催化蛋白末端-CAAX 羧甲基化,在增强Rho 蛋白的膜亲和力及其生物学活性中发挥着重要作用[8]。研究发现Rho 家族成员尤其是RhoA在多种肿瘤组织中高表达,如口腔癌[9]、乳腺癌[10]、肺癌[11]、结肠癌[12]、胃癌[13]、肝癌[14]等,并与肿瘤的恶性程度、发生发展、侵袭转移和临床预后有关,在舌癌中也已得到证实[15-17]。近年来通过基因或药物靶向抑制Icmt,阻断RhoA 甲基化可对肿瘤产生一定的影响,但目前有关Icmt对TSCC的研究报道少见。
本研究利用RNA 干扰(RNA interference,RNAi)技术,通过体外设计合成人Icmt 基因的小干扰RNA(small interfering RNA,siRNA)序列,并经脂质体瞬时转染技术转染至TSCC 细胞系CAL-27 和SCC-4,观察siRNA 对Icmt 及RhoA 的作用,探讨其对TSCC细胞增殖和凋亡的影响,为Icmt作为靶点在TSCC治疗中的应用提供依据。
1 材料和方法
1.1 材料和试剂
人TSCC 细胞系CAL-27 购于中南大学高等研究中心,SCC-4由山东大学口腔医学院馈赠。高糖型DMEM 基础培养基、胎牛血清(BI 公司,以色列),青霉素/链霉素、胰蛋白酶(Gibco 公司,美国),Icmt-siRNA 合成、转染试剂(广州锐博生物科技有限公司),RNA 提取试剂盒、反转录试剂盒、TB Green Premix Ex TaTM(TaKaRa 公司,日本),实时荧光定量聚合酶链反应(quantitive realtime polymerase chain reaction,qRT-PCR)引物Icmt、RhoA、磷酸甘油醛脱氢酶(glyceraldehyde phosphate dehydrogenase,GAPDH)合成(上海生工生物工程有限公司),RIPA裂解液、细胞膜蛋白与细胞浆蛋白抽提试剂盒、蛋白酶磷酸酶抑制剂混合物、细胞周期与凋亡检测试剂盒(上海碧云天生物技术有限公司),兔抗人多克隆抗体Icmt、p21、细胞周期蛋白D1(Cyclin D1)(Proteintech公司,美国),RhoA(Abcam 公司,美国),细胞外调节蛋白激酶(extracellular regulated protein kinases,ERK)、磷酸化的细胞外调节蛋白激酶(phospho-extracellular regulated protein kinases,p-ERK)(CST 公司,美国),细胞增殖活性检测试剂盒(cell counting kit-8,CCK-8)(MCE 公司,美国),Annexin V-APC/碘化丙啶(propidium staining,PI)荧光双染细胞凋亡检测试剂盒(武汉伊莱瑞特生物科技股份有限公司)。
1.2 细胞培养
CAL-27 和SCC-4 培养均采用含有10%胎牛血清、100 U·mL-1青 霉 素 和100 μg·mL-1链 霉 素 的DMEM 高糖培养基,置于37 ℃、5%CO2恒温孵育箱中分别培养。隔日换液,待细胞铺满瓶底80%~90%时,以1∶3 的比例接种至新的培养瓶中传代培养及后续实验。
1.3 方法
1.3.1 siRNA 转染效率测定 分别将处于对数生长期的CAL-27 和SCC-4 细胞以密度为每孔2×105个接种于6 孔板内,待细胞密度达30%~50%时进行转染。按照说明书用120 μL riboFECTTMCP Buffer稀释5 μL 20 μmol·L-1荧光基团Cy3 标记的siRNA储存液(转染时siRNA 终浓度为50 nmol·L-1),轻吹打混匀以后加入12 μL riboFECTTMCP Reagent,室温下孵育0~15 min 后,加入到1 863 μL 更新的无双抗完全培养基中。37 ℃、5%CO2恒温孵育箱中孵育24 h,于倒置荧光显微镜下明确siRNA 的转染效率。
1.3.2 Icmt siRNA 转染沉默Icmt 基因 针对人Icmt基因序列设计并合成3条siRNA(表1)和1条阴性对照序列NC-siRNA。转染前1 d 以每孔2×105个分别将CAL-27和SCC-4细胞接种于不同的6孔板内,待贴壁细胞融合达30%~50%时进行转染。实验设计分组包括空白对照组(仅加转染试剂)、阴性对照组(转染NC-siRNA)、实验组(Icmt-siRNA-1组、Icmt-siRNA-2 组、Icmt-siRNA-3 组)。根据分组,按siRNA转染试剂盒说明书,同上所述制备成不同组别的转染复合物(转染时siRNA 终浓度为50 nmol·L-1)。弃6 孔 板 内原 培 养基,PBS 冲 洗3次,每孔加入适量无双抗完全培养基,将制备好的转染复合物加入相应6 孔板内(使终末体积均为2 mL),及时混匀以后继续于孵育箱中培养。在转染一定时间后进行相应的细胞水平或分子水平的检测。
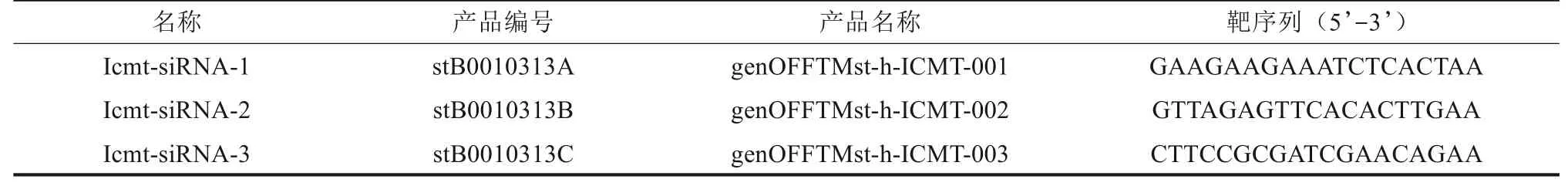
表1 针对Icmt基因序列设计3条Icmt-siRNATab 1 Three Icmt-siRNA sequences designed for Icmt gene
1.3.3 qRT-PCR检测Icmt、RhoA mRNA表达 按上述分组,提取各组转染24 h 后的细胞总RNA 并用紫外分光光度计检测每组所提RNA的浓度和纯度。应用反转录试剂盒,取适量RNA 反转录为cDNA,每组取2 μL cDNA 进行qRT-PCR,均设3 个副孔。Icmt 上游引物序列:5’-CGGCATCCTTCTTACGTCGG-3’,下游引物序列:5’-CCACACTGTCAGGGCATAGC-3’;RhoA 上游引物序列:5’-TGTGGCAGATATCGAGGTGGATGG-3’,下游引物序列:5’-GGCCTCAGGCGATCATAATCTTCC-3’;内参GAPDH 上游引物序列:5’-GCACCGTCAAGGCTGAGAAC-3’,下游引物序列:5’-TGGTGAAGACGCCAGTGGA-3’。聚合酶链反应(polymerase chain reaction,PCR)反应体系的配置及反应参数等均按TB Green Premix Ex TadTMⅡ试剂盒说明书进行。使用ABI PRISM 7000 实时荧光定量PCR 仪对荧光信号实时监测和数据分析后,根据Ct 值 应 用2-△△Ct公 式 量 化 各 组Icmt、RhoA mRNA 的相对表达水平,并根据3 组实验组Icmt mRNA 的相对表达量选取沉默效率最高组作为实验组进行后续研究,实验重复3次。
1.3.4 蛋白质免疫印迹法(Western blot)检测目的蛋白及细胞周期相关蛋白表达 采用RIPA 裂解液提取转染48 h 后各组细胞的蛋白质,细胞膜蛋白与细胞浆蛋白提取试剂盒提取的各组RhoA 膜蛋白,按照二喹啉甲酸(bicinchoninic acid,BCA)试剂盒操作说明测定蛋白浓度并定量蛋白质。加1/4 总 体积的Loadingbuffer,100 ℃变 性10 min,等量上样,在10%聚丙烯酰胺凝胶中电泳分离后,采用湿转法将蛋白转至聚偏二氟乙烯(polyvinylidene fluoride,PVDF)膜中,置5%脱脂奶粉中室温摇床封闭PVDF 膜1 h。加入一抗(Icmt,1∶1 000;RhoA,1∶5 000;p21,1∶800;Cyclin D1,1∶5 000;ERK,1∶1 000;p-ERK,1∶5 000;GAPDH,1∶5 000),4 ℃孵育过夜。三羟甲基氨基甲烷缓冲盐水(triethanolamine buffered saline,TBST) 洗膜3 次(每次10 min),置二抗(1∶50 000)孵育夜中,室温摇床孵育2 h,TBST 洗膜3 次(每次10 min)。加入电化学发光液显色、曝光,采集图像。使用Image J 软件分析灰度值,并以GAPDH 为内参,计算各检测蛋白与内参的比值。
1.3.5 CCK-8 试剂盒检测细胞的增殖能力 取对数生长期的CAL-27 和SCC-4 细胞消化离心后,调整细胞密度为每孔(100 μL)2×103个细胞,接种于96 孔板内,待细胞密度达30%时进行转染(方法同前),每组均设5 个平行副孔。转染后置于孵育箱内培养不同时间(0、24、48、72 h),按试剂盒说明书操作,每孔加入10 μL CCK-8溶液,于培养箱中避光孵育2 h后,酶标仪检测波长450 nm的光密度(optical density,OD)值,应用GraphPad Prism 8.2.1 软件绘制细胞增殖曲线,观察各组细胞增殖情况。实验重复3次。
1.3.6 流式细胞仪检测细胞的周期变化 转染48 h后,弃原培养基,PBS冲洗3次,消化收集细胞悬液1 000 g 离心5 min,1 mL 冰浴预冷PBS 重悬细胞,再离心。加入1 mL 冰浴预冷70%乙醇轻吹打混匀后4 ℃固定过夜,冰浴预冷PBS 洗涤2 次后,每管样品加0.5 mL PI 染色,37 ℃避光温浴30 min后在24 h 之内进行流式细胞仪检测,结果采用ModFit LT软件分析。实验重复3次。
1.3.7 Annexin V-APC/PI 荧光双染法凋亡试剂盒检测细胞的凋亡能力 细胞转染48 h后,分别取各组上清于对应的离心管中待用,加入适量0.25%胰蛋白酶(不含乙二胺四乙酸)消化收集细胞于上述对应离心管中,500 g 离心5 min,弃上清,适量PBS 洗涤1 次后重悬细胞并计数。每组均取5×105个重悬细胞,500 g 离心5 min,PBS 洗涤1 次,加入500 μL 稀释的1×Annexin V BindingBuffer 工作液重悬细胞。依次加入5 μL Annexin V-APC和5 μL PI 染色液,涡旋混匀,室温避光孵育20 min 后立即上机检测,结果采用FlowJo V10 软件分析。实验重复3次。
1.4 统计学分析
应用GraphPad Prism 8.2.1 软件进行作图统计分析,实验数据以均数±标准误表示,2 组间比较采用独立样本t检验,多组间比较用单因素方差分析,以P<0.05为差异具有统计学意义。
2 结果
2.1 siRNA转染效率
荧光组CAL-27 和SCC-4 细胞分别在转染荧光基团Cy3标记的siRNA 24 h后,于倒置荧光显微镜下观察,对比相同视野在普通光镜下和荧光显微镜下均发现90%以上的细胞都显示红色荧光(图1),表明多数细胞已经转染siRNA,转染效率高。
2.2 转染后各组细胞Icmt、RhoA mRNA的表达
qRT-PCR 结果显示,转染siRNA 24 h 后,与空白对照组相比,阴性对照组Icmt mRNA 表达无明显变化(P>0.05),各实验组Icmt mRNA 相对表达量均明显下降(P<0.05),而RhoA mRNA 表达无明显变化(P>0.05)(图2)。对各实验组Icmt mRNA的表达进行比较,Icmt-siRNA-1和Icmt-siRNA-3 组的沉默效率最高,故后续应用这2 组作为实验组进行研究。
2.3 转染后各组细胞目的蛋白的表达
Western blot 检测转染48 h 后各组细胞蛋白表达量,结果表明,与阴性对照组和空白对照组相比,实验组Icmt 蛋白表达下降(P<0.05),RhoA总蛋白表达无明显区别(P>0.05),而RhoA 膜蛋白表达显著降低(P<0.05)(图3)。
2.4 转染后对各组细胞增殖能力的影响
在转染0、24、48、72 h 后,阴性对照组和空白对照组细胞增殖能力无明显差异(P>0.05),而实验组随时间变化细胞增殖能力逐渐下降(P<0.05)(图4)。
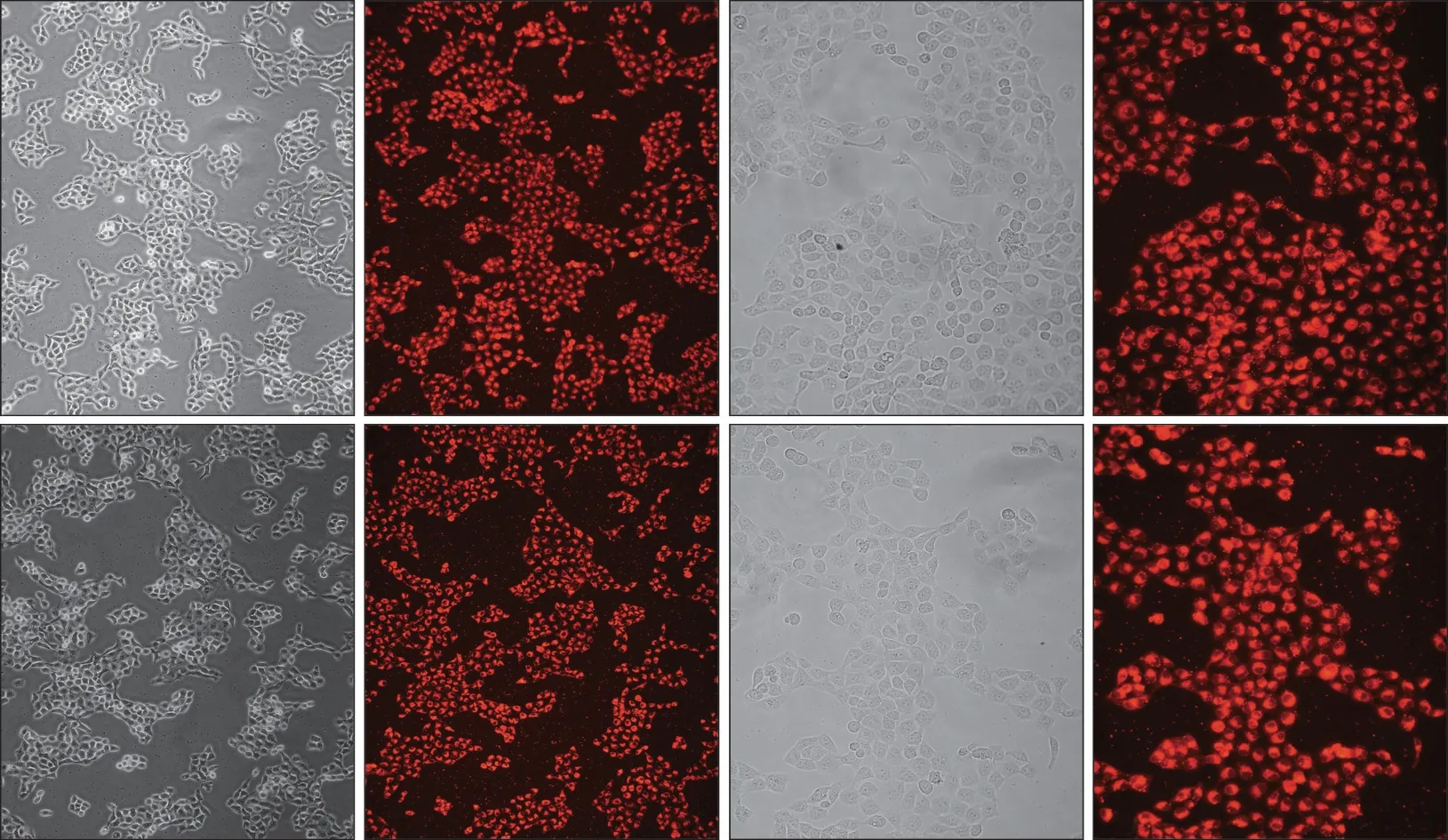
图1 siRNA转染效率Fig 1 siRNA transfection efficiency
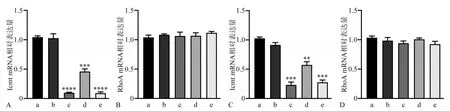
图2 转染Icmt-siRNA后各组细胞Icmt、RhoA mRNA的表达Fig 2 Expression of Icmt and RhoA mRNA after Icmt-siRNA transfection
2.5 转染后各组细胞的周期变化
流式细胞仪检测结果表明,转染48 h 后,实验组较对照组相比,G1 期细胞比例增加,S 期细胞比例减少,G2 期细胞比例无明显变化,细胞周期阻滞在G1/S 期,其差异具有统计学意义(P<0.05)(图5)。采用Western blot检测细胞周期相关蛋白,结果显示Cyclin D1 蛋白表达下降,p21 蛋白表达升高(P<0.05)(图6)。
2.6 转染后各组细胞凋亡能力的变化
在各组细胞转染48 h 后,利用Annexin VAPC/PI 荧光双染法于流式细胞仪检测得出各象限细胞比率,结果显示,空白对照组、阴性对照组、Icmt-siRNA-1 组、Icmt-siRNA-3 组CAL-27 细胞凋亡率分别为(3.80±0.09)%、(6.01±0.20)%、(15.30±0.45)%、(12.53±0.28)%;SCC-4 细胞凋亡率分别为(1.66±0.12)%、(2.30±0.03)%、(8.60±0.05)%、(6.80±0.11)%。结果均发现实验组凋亡细胞增加(P<0.05)(图7)。
2.7 转染后各组细胞ERK 信号通路相关蛋白ERK和p-ERK的表达变化
为研究体外沉默Icmt 对CAL-27 及SCC-4 细胞影响的相关机制,采用Western blot 检验ERK 信号通路的相关蛋白,结果显示,ERK 蛋白表达无变化,p-ERK蛋白表达下调(P<0.05)(图8)。
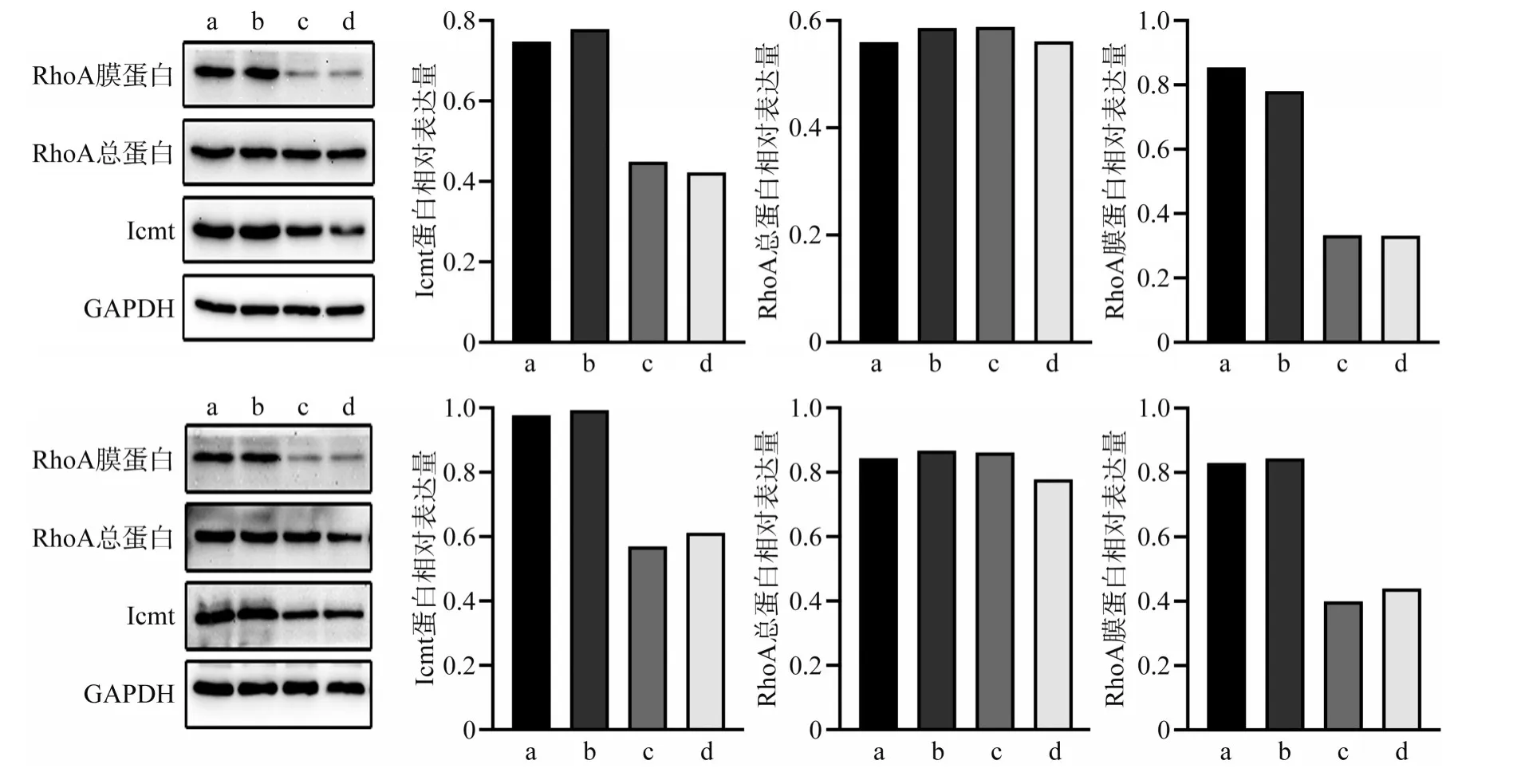
图3 转染Icmt-siRNA后各组细胞Icmt和RhoA蛋白的表达Fig 3 Expression of Icmt and RhoA protein after Icmt-siRNA transfection

图4 转染Icmt-siRNA后对各组细胞增殖能力的影响Fig 4 Effection of Icmt-siRNA transfection oncell proliferation capacity
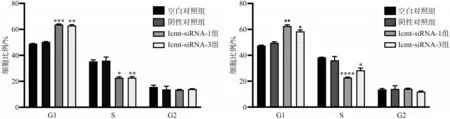
图5 转染Icmt-siRNA后各组细胞周期的变化Fig 5 Cell cycle changes after Icmt-siRNA transfection

图6 转染Icmt-siRNA后细胞周期相关蛋白Cyclin D1和p21的表达Fig 6 Expression of Cyclin D1 and p21 protein after Icmt-siRNA transfection
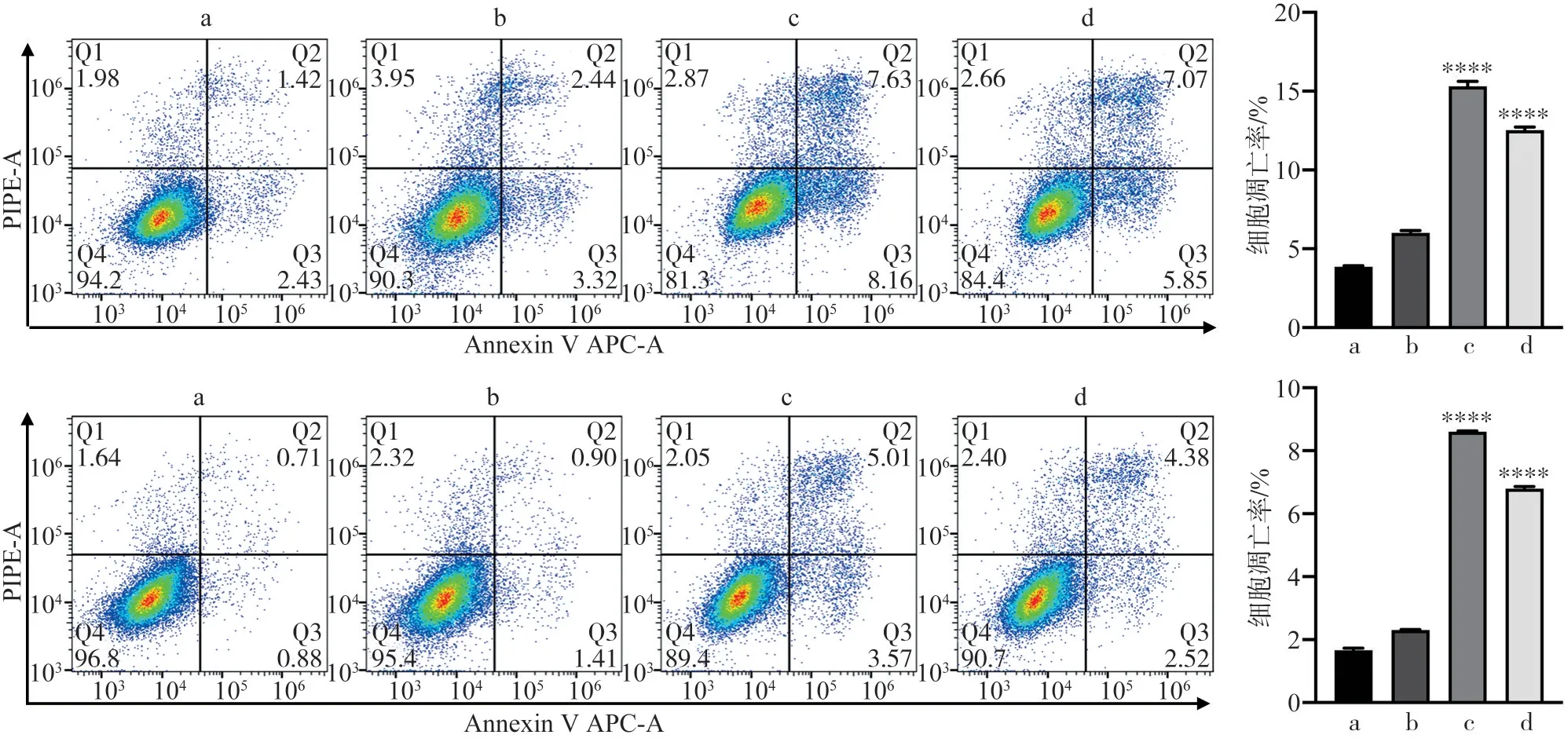
图7 转染Icmt-siRNA后细胞凋亡能力的变化Fig 7 Effection of Icmt-siRNA transfection on cell apoptosis
3 讨论
Icmt 是相对分子质量为32 000 的蛋白,定位于内质网(endoplasmic reticulum,ER)上,催化小G 蛋白家族成员的-CAAX 末端残基的甲基化修饰[8],其对哺乳动物的细胞生长至关重要,同时对许多癌蛋白的稳定和功能的发挥也非常重要[18],如可促进Rho 蛋白的膜亲和力及信号传递功能[19]。研究[20-22]表明,Icmt 在多种恶性肿瘤组织中表达上调,如在卵巢癌的检测样本中发现Icmt 的表达较正常组织可高达93%,但同时发现并不是所有被测试的样本中被观察到上调。在检测的肝癌样本中也发现,Icmt 仅在70%的肝癌样本中表现为高表达状态。这些结果表明,Icmt 的表达情况可能存在组织差异性问题,但其在恶性肿瘤中多表现为上调。并有大量研究[23-26]证明,Icmt 在肿瘤的恶性转化、肿瘤的维持、生长增殖和转移中发挥关键作用。因此,降低Icmt 酶活性可能是一种更有效的抗癌靶点,近年来受到了越来越多的关注,但其对TSCC的影响尚未明确。
本研究采用siRNA干扰技术,以CAL-27和SCC-4 细胞为研究对象,体外沉默Icmt 基因,观察对TSCC的影响。结果显示有效沉默Icmt基因表达后,各组RhoA mRNA 和总蛋白的相对表达量较对照组虽无明显差异,但RhoA 膜蛋白相对表达量显著降低。由此推测,沉默Icmt并不影响RhoA 基因的转录和蛋白的翻译,但可能通过降低RhoA 的甲基化修饰,影响胞质内RhoA 蛋白与细胞膜的稳定结合。只有被修饰后的RhoA 才能正确的定位于细胞膜上,以参与细胞增殖分裂、细胞黏附和迁移、细胞凋亡等[6]。Bergo 等[27]将抑制Icmt 对肿瘤细胞增殖能力的影响归因于抑制Icmt 酶活性影响了RhoA 羧基末端的甲基化修饰,使其与细胞膜稳定结合的水平降低,进而减弱与下游效应分子的相互作用。此外,研究[18]发现,Icmt催化的甲基化修饰对蛋白质-蛋白质相互作用和蛋白质稳定性也很重要。Manu等[28]研究发现,RhoGEF 只与经过翻译后修饰的RhoA 相互作用,促进RhoA 由与GDP 结合的非活性状态转化为与GTP 结合的活性状态。由此推测,抑制Icmt 酶活性可能通过降低RhoA的膜结合水平和活性的发挥影响TSCC 的发展。

图8 转染Icmt-siRNA后ERK和p-ERK的表达Fig 8 Expression of ERK and p-ERK protein after Icmt-siRNA transfection
大量研究[22,27,29]表明,降低Icmt 酶活性可导致细胞周期阻滞,抑制肿瘤细胞生长而诱导肿瘤细胞死亡及影响肿瘤细胞对化疗的敏感性。本研究结果显示实验组细胞转染Icmt-siRNA 后,明显降低了RhoA 与细胞膜的结合水平,细胞周期阻滞在G1/S期,增殖能力降低而凋亡水平增加。RhoA 作为信号转换器或分子开关可与上游激活物和下游靶点相互作用。有研究[30-32]证实,RhoA 可直接刺激Cyclin D1启动子并引起Cyclin D1蛋白的上调及调节细胞周期蛋白依赖性激酶抑制物(cyclin dependent kinase inhibitors,CKIs)的活性,促进G1期的进展和DNA 合成;亦可以通过介导的丝裂原活化蛋白激酶(mitogen-activated protein kinas,MAPK)/ERK 信号途径,调节细胞周期蛋白和CKIs 的水平。RhoA 处于非活性状态时可增加ERK 磷酸化水平,导致p21 表达增加,抑制增殖[31,33]。通过体外沉默RhoA基因的表达,可使Cyclin D1 在G1 期的表达受到明显的抑制,而p21、p27 表达水平显著增高,致舌癌细胞周期停滞,细胞增殖能力降低[17]。在本实验体外沉默Icmt 后,检测到实验组细胞周期相关蛋白Cyclin D1 表达下调,p21 表达上调,同时测得ERK 磷酸化水平下降。由此推测,沉默Icmt 基因的表达亦可负性调控周期相关蛋白Cyclin D1、p-ERK 和上调p21 蛋白的表达,使细胞周期停滞在G1 期而不能进入S期,最终使细胞增殖受到明显的抑制,而细胞凋亡水平相应增高。
综上所述,利用siRNA干扰技术可有效抑制人舌鳞癌细胞Icmt基因的表达,影响RhoA 蛋白羧基末端甲基化修饰,降低稳定的膜靶向定位及其活性的发挥,并通过调控Cyclin D1、p21和p-ERK的表达,使细胞周期阻滞在G1/S 期,进而抑制舌鳞癌CAL-27 和SCC-4 细胞增殖而诱导细胞凋亡。本研究为Icmt作为TSCC的基因治疗的新靶点提供了一定的实验依据,但Icmt 对Rho 家族蛋白的具体作用机制尚需进一步研究。
利益冲突声明:作者声明本文无利益冲突。

