玉米赤霉烯酮诱导山羊子宫内膜基质细胞凋亡的研究
王宗捷,张瑞雪,刘守勤, 靳亚平,林鹏飞
(西北农林科技大学动物医学院,杨凌 712100)
ZEN主要是由镰刀菌属物种经过聚合酮途径产生,常存在于霉变的谷物上。ZEN化学性质稳定,因此在谷物的加工过程中不易被降解,动物常因食用污染了ZEN的霉变饲料而中毒[1]。ZEN和雌激素的化学结构具有相似性,因此,ZEN可以和内源性雌激素竞争性结合雌激素受体,引起体内生殖激素调节紊乱,导致雌性动物不孕、流产、死胎等[2]。研究显示,低剂量的ZEN具有和雌激素相同的作用,两者均能促进卵泡发育,但ZEN可引起PCNA、Bcl-2及Bax基因高表达,致使ZEN诱导的卵泡常常表现异常发育状态[3-5]。ZEN对牛、猪和小鼠卵母细胞的减数分裂进程具有抑制作用,会引起卵母细胞成熟延迟以及染色质异常[6-8]。ZEN能够增加小鼠胚胎的致死率[9]。近期的研究显示,ZEN还能够影响胚胎的植入过程[10]。
近年来,关于ZEN对哺乳动物产生毒性的作用机制研究也越来越多,用ZEN处理小鼠睾丸间质细胞,发现细胞死亡形式主要是细胞凋亡[11]。进一步研究发现,ZEN能够通过多种途径诱导生殖细胞的凋亡,ZEN可以通过激活Fas-FasL信号通路诱导大鼠支持细胞凋亡,还可以通过干扰基因组的稳定性促进颗粒细胞的凋亡[12-13]。当机体发生内质网应激(ERS)且稳态不能平衡时,细胞会激活内在的凋亡途径,导致细胞凋亡[14]。ERS通过以下通路介导细胞的凋亡:1)PERK-ATF4-CHOP-Bcl-2-Bax通路导致细胞凋亡;2)IRE1α-JNK-Bcl-2通路诱导细胞调亡;3)ATF6-CHOP-Bcl-2通路介导细胞凋亡[15]。先前的研究揭示了ZEN通过内质网应激途径调节大鼠睾丸支持细胞、TM4细胞以及牛乳腺上皮细胞的凋亡过程,表明ERS在ZEN引起的细胞凋亡中发挥重要的作用[16-18]。
虽然目前ZEN对动物生殖系统的影响已有很多报道,但是关于ZEN在母体子宫方面的报道仍不完善。子宫内膜细胞在保护母体不受病原体侵害以及胚胎附植方面都发挥了积极的作用。因此,本试验选用山羊ESCs作为试验材料,探究ZEN诱导细胞凋亡的相关信号通路,为研究ZEN在雌性哺乳动物中引起生殖毒性的机制提供依据。
1 材料与方法
1.1 试剂
玉米赤霉烯酮(Z2125)购自Sigma公司。胎牛血清(Z7186FBS-500)购自ZETA公司。RNA Trizol试剂(9109)购自TaKaRa公司。SYBR Green Master Mix定量试剂盒(Q311-02)购自诺唯赞公司。反转录试剂盒(AG11705)购自艾科瑞公司。BCA蛋白含量检测试剂盒(KGP902)和全蛋白提取试剂盒(KGP2100)以及细胞凋亡试剂盒(KGA1017)购自凯基生物公司。CCK-8试剂盒(C0037)购自碧云天公司。β-actin抗体(JC-PA001)购自晶彩生物。CHOP抗体(2895)购自美国CST公司。GRP78抗体(ab21685)和IRE1抗体(ab124945)购自Abcam公司。ECL发光液(32109)购自赛默飞世尔公司。
1.2 细胞培养
永生化的山羊ESCs细胞系由本实验室建立和保存[19]。将ESCs 细胞在37 ℃、5%CO2环境下培养于 DMEM/F-12 培养基中(添加10%的胎牛血清),当细胞贴壁生长融合度为80%~90%时进行传代。将ESCs以3×105个·孔-1的密度接种于六孔板中,培养24 h后,加入0、10、20、30、40 μg·mL-1ZEN,处理24 h后,在倒置荧光显微镜下,观察细胞形态。
1.3 CCK-8
将传代细胞消化后,用移液器重悬混匀,之后对细胞进行计数。ESCs以5×103个·孔-1的细胞密度接种在96孔板中,注意每个孔重复6次;培养24 h 后,用0、5、10、20、30、40、60 μg·mL-1的ZEN处理24 h,之后将CCK8以10 μL·孔-1的量加入到细胞中;37 ℃孵育1 h后,通过酶标仪在450 nm处检测吸光度值。2 μmol·L-14-PBA和10 μmol·L-1Irestatin9389 在ZEN处理前1 h加入。
1.4 细胞凋亡率检测
用“1.2”中不同浓度的ZEN处理ESCs 24 h后,弃上清,并且用不含EDTA的0.25%的胰蛋白酶消化ESCs,轻轻吹打收集;ESCs悬液离心5 min,用冷的PBS洗涤两次,将细胞密度调整至1×104个·mL-1;将细胞重悬于50 μL结合缓冲液中,加入5 μL的7-AAD并将混合物在黑暗中静置15 min;加入450 μL结合缓冲液和1 μL的Annexin V-PE并在黑暗中温育15 min;在1 h内进行流式细胞仪检测。
1.5 Real-time PCR
用“1.2”中不同浓度的ZEN处理山羊ESCs 24 h后,弃掉上清,使用Trizol试剂提取细胞总RNA。cDNA合成按照反转录试剂盒说明书进行。在Bio-Rad CFX96 PCR仪中使用SYBR Green Master Mix进行Real-time PCR检测。用 2-△△Ct法进行mRNA定量。β-actin为内参基因。引物序列详见表1。

表1 Real-time PCR 引物序列
1.6 Western blot
用“1.2”中不同浓度的ZEN处理山羊ESCs 24 h 后,收集样品。弃掉上清,用PBS清洗细胞两次后,用细胞刷收集细胞,用1 mL的PBS洗涤、收集细胞;离心弃掉PBS后,加入蛋白裂解液,提取全蛋白,根据BCA试剂盒说明书来测定总蛋白的浓度;按照每个蛋白样本30 μg加到凝胶电泳分离泳道中;然后,将目的蛋白样品转移到PVDF膜上,用10%脱脂牛奶封闭PVDF膜2 h;TBTS清洗膜之后,用β-actin(1∶5 000)、phosphoIRE1(1∶1 000)、GRP78(1∶1 000)、CHOP(1∶1 000)抗体分别4 ℃孵育过夜;TBST洗涤5次,5 min·次-1;在室温下使其与辣根过氧化物酶标记二抗共同孵育1 h,TBST洗涤5次,5 min·次-1;最后,1∶1配制ECL发光液,均匀滴加到膜上,使用凝胶成像系统(Tannon Biotech)检测。
1.7 数据统计与分析
所有的试验至少重复3次。应用GraphPad Prism 8统计软件对数据进行显著性t检验和单因素方差(ANOVA)统计分析,得到的结果用“平均值± 标准差”表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结 果
2.1 ZEN对山羊ESCs增殖和凋亡的影响
如图1所示,随添加ZEN浓度的升高,山羊ESCs的细胞活力逐渐下降。与对照组(0 μg·mL-1ZEN)相比,添加10 μg·mL-1ZEN显著地抑制了山羊ESCs细胞活力(P<0.05),而20 μg·mL-1ZEN极显著地抑制了山羊ESCs细胞活力(P<0.01)。当ZEN浓度大于40 μg·mL-1时,60%以上的ESCs增殖受到抑制。FCM检测结果同样证实,随ZEN浓度的增加,ESCs细胞凋亡率显著上升(表2)。40 μg·mL-1ZEN处理山羊ESCs 24 h后,50%左右ESCs发生了凋亡。
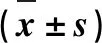
表2 ZEN对山羊ESCs细胞凋亡的FCM检测结果
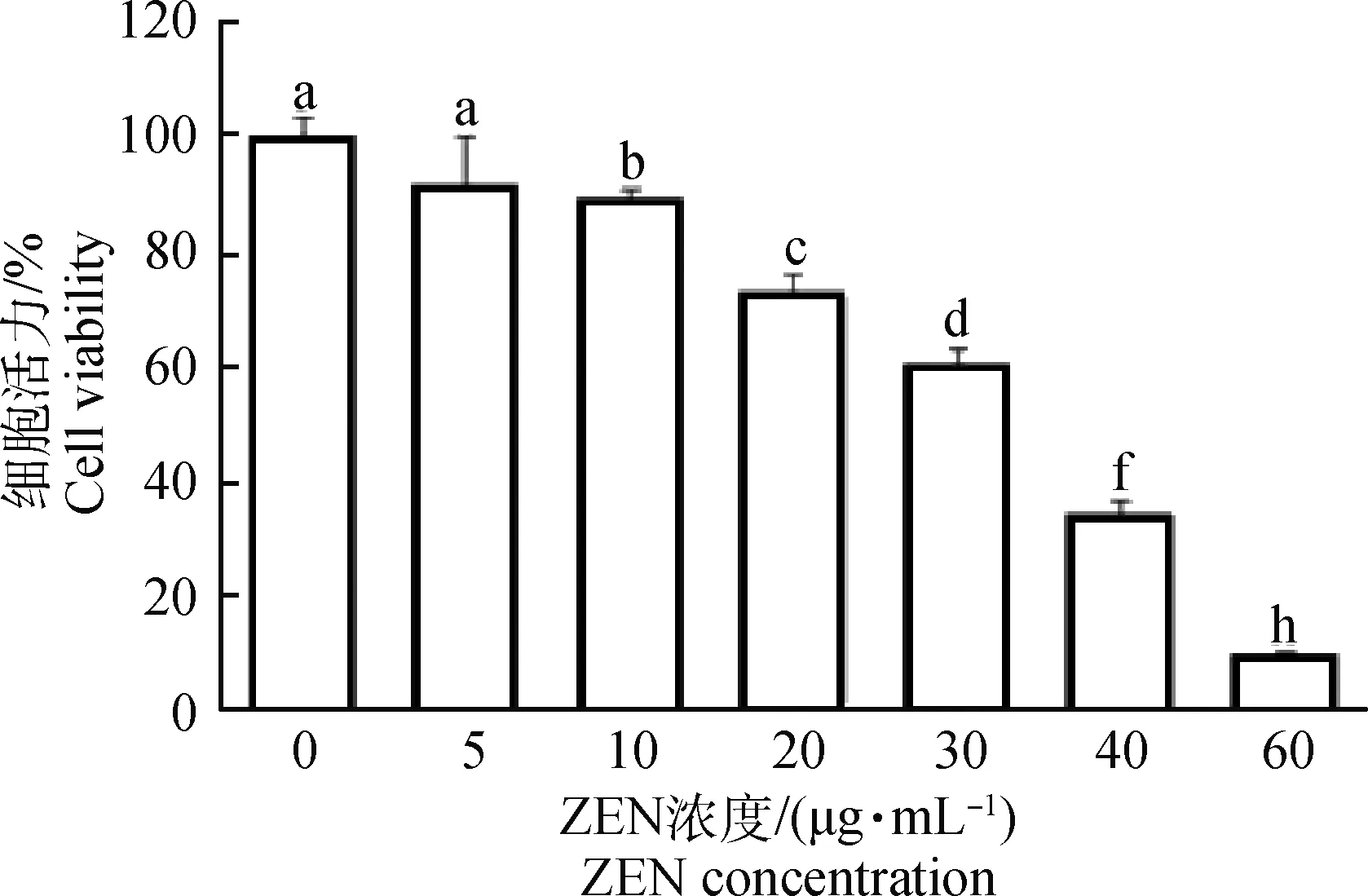
相邻字母表示差异显著,P<0.05;相隔两字母表示差异极显著,P<0.01。下同
2.2 ZEN对山羊ESCs凋亡相关基因的影响
图2显示,随着ZEN浓度的升高,Caspase-9、Caspase-8和Bax/Bcl-2的mRNA水平表达量逐渐增加。30和40 μg·mL-1ZEN组显著上调了Caspase-9 mRNA表达水平(P<0.05)。当添加10 μg·mL-1ZEN时,Bax/Bcl-2 mRNA表达水平即显著增加;而30和40 μg·mL-1ZEN极显著上调了Bax/Bcl-2 mRNA表达水平(P<0.01)。与对照组相比,10~30 μg·mL-1ZEN对Caspase-8 mRNA水平无显著上调作用;当添加30 μg·mL-1ZEN时,Caspase-8 mRNA水平显著增加(P<0.05)。

A.Caspase-9/β-actin; B.Caspase-8/β-actin; C.Bax/Bcl-2/β-actin
2.3 ZEN对ERS通路关键基因表达的影响
如图3所示,添加30和40 μg·mL-1ZEN处理山羊ESCs 24 h后,GRP78 mRNA的表达水平显著增加(P<0.05)。ZEN显著上调了CHOPmRNA表达水平且呈剂量依赖性关系,10 μg·mL-1ZEN即显著诱导了CHOPmRNA表达(P<0.05),而40 μg·mL-1ZEN极显著上调了CHOPmRNA表达水平(P<0.01)。当ZEN浓度大于20 μg·mL-1时,ATF6 mRNA表达水平显著增加(P<0.05)。10~30 μg·mL-1ZEN对PERKmRNA表达水平无显著上调作用;当添加40 μg·mL-1ZEN时,PERKmRNA水平显著增加(P<0.05)。而ZEN且呈剂量依赖性的显著上调了IRE1 mRNA表达水平。Western blot结果进一步证实,添加10 μg·mL-1ZEN显著增加了GRP78、CHOP和phosphoIRE1α蛋白表达水平(图4,P<0.05)。

A.GRP78/β-actin; B.CHOP/β-actin; C.ATF6/β-actin; D.PERK/β-actin; E.IRE/β-actin

A.Western blot; B.GRP78; C.CHOP; D.phosphoIRE1
2.4 ERS对ZEN诱导ESCs凋亡中的调节作用
为了进一步分析ERS在ZEN引起的ESCs凋亡过程中的调控作用,首先采用ERS特异性抑制剂4-PBA和IRE1特异性抑制剂Irestatin9389预处理ESCs 1 h,添加30 μg·mL-1ZEN作用24 h后,CCK-8分析ESCs的增殖情况。图5所示,添加4-PBA和Irestatin9389均显著地挽救了ZEN对ESCs增殖的抑制作用(P<0.05)。

图5 ERS特异性抑制剂对ZEN抑制ESCs增殖的调节作用
3 讨 论
越来越多的研究表明,ZEN对雌性动物生殖系统具有显著的毒性作用,ZEN可诱发断奶小母猪子宫内膜和肌层增厚、腺体数量增多,导致子宫形态发生改变[20]。ZEN还增加了大鼠患多囊卵巢综合征的风险[21]。还有研究证实,ZEN对小鼠的胎盘发育会产生不利的影响,还可导致胚胎早期附植失败[22-23]。近期研究表明,ZEN可诱导不同时期小鼠子宫细胞发生凋亡,显著上调凋亡关键基因Caspase-3、Caspase-8、Caspase-9以及Bcl-2的表达[24]。ZEN可以通过激活JNK/Drp1途径刺激线粒体裂变从而降低人ESCs的存活和迁移活性[25]。目前,有关ZEN对反刍动物生殖毒性的报道较少,本试验通过分析ZEN对山羊ESCs增殖和凋亡的影响,以期为揭示ZEN对山羊胚胎附植和妊娠的生殖毒性作用奠定基础。
现已证实,ZEN可通过引起细胞凋亡进而引发生殖障碍。ZEN可通过激活JAK2/STAT3信号通路和抑制抗凋亡相关lncRNAs表达诱导猪颗粒细胞发生凋亡[26-27]。ZEN能够通过激活线粒体途径诱导大鼠睾丸支持细胞发生凋亡[28]。本试验发现,ZEN对山羊ESCs的毒性作用呈现剂量依赖性的关系并能显著诱发山羊ESCs凋亡;同时,凋亡基因Caspase-8、Caspase-9和Bax/Bcl-2 mRNA水平均被显著上调。
先前的研究发现,ZEN可以通过内源性凋亡通路和线粒体凋亡通路诱导细胞凋亡[26,29]。本实验室前期研究表明,ZEN可以通过ERS通路诱导小鼠卵巢颗粒细胞和巨噬细胞凋亡[30-31]。采用ERS抑制剂预处理细胞可显著减轻ZEN诱导的人肝细胞凋亡和自噬[32]。当发生ERS时,机体会启动一些反应来维持细胞稳态,当ERS超过内质网修复能力时就会启动细胞凋亡机制。本研究发现,ZEN可以显著上调ERS标志基因GRP78和CHOPmRNA和蛋白表达水平,并呈剂量依赖性。同时,ERS三条通路关键基因ATF6、PERK和IRE1的表达水平均显著增加,尤其是IRE1通路上调最为显著。添加ERS特异性抑制剂4-PBA以及IRE1特异性抑制剂Irestatin9389的结果进一步表明,ZEN可以通过ERS通路诱导ESCs发生凋亡。另外,ZEN具有类雌激素的毒性,它可以和内源性雌激素竞争性结合雌激素受体[33]。先前的研究表明,ZEN可以通过雌激素受体激活Wnt-1/β-catenin通路促进卵巢的发育[4]。ZEN可以通过调节雌激素受体信号和核受体Nur77的表达来抑制小鼠睾丸间质细胞中睾酮的生物合成[34]。山羊ESCs细胞中存在雌激素受体,ZEN是否通过雌激素受体对山羊ESCs产生毒性作用需要进一步的研究。
4 结 论
ZEN对山羊ESCs有显著毒性作用,可剂量依赖性地抑制ESCs增殖和诱导ESCs凋亡;ZEN可以通过激活ERS通路诱导ESCs凋亡,且以IRE1通路最为显著。

