不同成熟度杨梅酚酸的超声-微波协同优化提取及其抗氧化性对比
柳 萌,郜海燕,房祥军,吴伟杰,陈杭君,刘瑞玲
(1.中国海洋大学食品科学与工程学院,山东 青岛 266003;2.浙江省农业科学院食品科学研究所,农业农村部果品产后处理重点实验室,中国轻工业果蔬保鲜与加工重点实验室,浙江省果蔬保鲜与加工技术研究重点实验室,浙江 杭州 310021)
杨梅(Morella rubraSieb.et Zucc)原产于中国亚热带地区,主要分布在海南岛以北以及长江以南流域,其中以浙江、江苏一带居多[1]。杨梅果实口味酸甜、风味细腻且具有很高的营养价值,除了新鲜食用外,还可加工成果汁或酱汁,具有生津解渴、消食消暑、利尿止泻等疗效。杨梅果实中含有丰富的酚酸类化合物,包括阿魏酸、香豆酸、对羟基苯甲酸等,其中最主要的是没食子酸和原儿茶酸[2]。酚酸是一类含有酚羟基与苯烯结构的有机酸,具有广泛的生理活性。研究发现蒲公英花的酚酸提取液对清除羟自由基和抑制油脂自氧化有较好的效果[3];蓝莓的酚酸及衍生物具有抗氧化特性和抗炎作用[4]。但是酚酸的含量和组成在植物不同成熟期有很大差异[5],关于种类酚酸成分的研究多集中于丹参、金银花等中药材[6-7],通过比较研究不同成熟度杨梅果实中酚酸含量的变化规律,可以为杨梅的开发利用提供参考依据。
当前酚酸主要通过有机溶剂进行提取,同时伴有微波辅助、超声辅助、酶辅助提取等手段。马亚琴等[8]采用超声辅助显著提高了蜜柚皮的酚酸产率,葛飞等[9]采用微波辅助萃取显著提高了蜂胶中酚酸的提取效率,田路飞[10]比较了不同提取方式对银杏中酚酸提取的影响,发现微波提取因其时间短、操作简单优于超声辅助提取和超临界CO2萃取工艺,更适合工业应用。然而单一的提取方法存在缺点,如超声波产热不足、萃取时间长、微波传热传质不均匀等。近年来研究发现微波(迅速提高反应温度)和超声波(加速化学反应)两种技术相互配合的提取工艺可以缓解高温氧化破坏酚酸结构,且具有节约溶剂、传热均匀、高效节能的优点。
本实验采用响应面法对超声-微波协同提取杨梅游离酚酸工艺进行优化,旨在提供一种高效的杨梅酚酸提取工艺。采用高效液相色谱(high-performance liquid chromatography,HPLC)技术分析不同成熟度杨梅游离酚酸的组成,并对其抗氧化能力进行研究,为杨梅中酚酸类物质生理活性的研究提供数据支持,并为其生产和综合开发利用提供依据。
1 材料与方法
1.1 材料与试剂
杨梅品种为‘东魁’(Myrica rubracv.Dongkui),成熟度包括五分熟(黄绿)、七分熟(微红)、成熟(鲜红)、过熟(紫红)(图1),于2018年6月16日采自浙江仙居杨梅基地,均为同一批次,经液氮冷冻粉碎至粉末,-30 ℃保存备用。

图1 ‘东魁’杨梅不同成熟度的果实Fig.1 Bayberries of different maturities
咖啡酸、原儿茶酸、对羟基苯甲酸、没食子酸、香草酸、香豆酸、阿魏酸和绿原酸(标准品) 上海阿拉丁生化科技股份有限公司;羟自由基测定试剂盒 南京建成生物工程研究所;水溶性VE(Trolox) 上海源叶生物科技有限公司;无水乙醇、乙醚、乙酸乙酯等均为国产分析纯。
1.2 仪器与设备
Cintra404紫外-可见光分光光度计 澳大利亚GBC科技仪器公司;RE-52AA旋转蒸发器 上海亚荣生化仪器厂;G70F20CN3L-C2(C0)微波炉 广东格兰仕微波生活电器制造有限公司;KQ-3000TDE型高频数控超声波清洗器 昆山市超声仪器有限公司;2695 HPLC仪、2996二极管阵列检测器 美国Waters公司。
1.3 方法
1.3.1 微波单一辅助提取酚酸
在成熟杨梅粉末中按料液比1∶25(m/V,下同)添加体积分数80%乙醇溶液,置于微波炉中,微波功率固定为700 W,微波辅助提取时间分别为2、4、6、8、10、20、30、40、50 s,取出后冷却,然后5 000 r/min离心10 min取上清液,40 ℃真空浓缩至较少体积,加入乙醚/乙酸乙酯混合溶剂(1∶1,V/V)振荡提取、静置分液(3~5 次),取上层有机相于40 ℃真空浓缩至干后溶于10 mL无水乙醇。
1.3.2 超声单一辅助提取酚酸
在杨梅成熟粉末中按料液比1∶25添加体积分数80%乙醇溶液,置于超声波清洗器中,超声辅助提取时间分别为10、15、20、25、30、35、40、45 min,其他步骤同1.3.1节。
1.3.3 超声-微波协同提取酚酸
采用超声-微波协同提取的方式,以乙醇为有机溶剂进行提取,首先进行微波辅助提取,之后进行超声辅助提取,具体工艺流程如下:成熟杨梅粉末→按料液比1∶25加入体积分数80%乙醇溶液→微波提取→超声提取→5 000 r/min、10 min离心取上清液→真空浓缩(40 ℃)→乙醚/乙酸乙酯混合溶剂(1∶1,V/V)振荡提取、静置分液(3~5 次)→取上层有机相真空浓缩至干(40 ℃)→溶于无水乙醇(10 mL)。
1.3.3.1 单因素试验
分别研究乙醇体积分数(40%、50%、60%、70%、80%、90%)、料液比(1∶15、1∶20、1∶25、1∶30、1∶35)、协同提取方式(先微波30 s,再超声5、10、15、20、25 min)对超声-微波联合协同提取酚酸的影响。前期通过预实验得出协同提取顺序为先微波辅助再超声辅助提取,工艺优化以缩短提取时间、提高产量为目的,所以固定微波时间为30 s。在研究其中一单因素变量的影响时,其他各因素固定的条件为:乙醇体积分数80%、料液比1∶25、微波30 s+超声25 min。
1.3.3.2 Box-Behnken试验设计
以单因素试验为基础,确定超声-微波协同方式为先微波后超声,微波时间固定为30 s。选取料液比、乙醇体积分数和超声时间作Box-Behnken设计,并且以杨梅酚酸得率作为响应值,试验设计见表1。

表1 Box-Behnken设计试验因素水平及编码Table 1 Code and level of independent variables used for Box-Behnken design
1.3.4 酚酸得率测定
杨梅果实总酚酸含量的测定参照陈燕霞等[11]的方法,并稍作修改。精密吸取样品溶液1.0 mL置于25 mL具塞试管中,加无水乙醇至5 mL,加2 mL、0.3 g/100 mL十二烷基硫酸钠及1 mL、0.6 g/100mL三氯化铁-0.9 g/100 mL铁氰化钾混合溶液(1∶0.9,V/V),混匀,在暗处放置5 min,加0.1 mol/L盐酸溶液至刻度,在暗处放置20 min,以不添加样品溶液为空白,在736 nm波长处测定吸光度,以没食子酸为标准品,得到标准曲线y=0.368 3x+0.001 3(R2=0.998),其中x为总酚酸质量浓度/(μg/mL),y为吸光度。根据标准曲线计算杨梅酚酸质量浓度,并按下式计算酚酸得率。

1.3.5 杨梅酚酸提取物抗氧化能力的测定
1.3.5.1 DPPH自由基清除能力测定
取1 mL不同成熟度杨梅的酚酸提取液(采用优化后的提取方法,下同)分别与3 mL 0.04 mg/mL的1,1-二苯基-2-三硝基苯肼(1,1-diphenyl-2-picrylhydrazyl,DPPH)溶液混合,室温反应30 min,于517 nm波长处测定吸光度,空白组以1 mL无水乙醇代替样品液[12]。采用不同浓度的Trolox溶液制作Trolox DPPH自由基清除能力标准曲线。不同成熟度杨梅酚酸的DPPH自由基清除能力以Trolox当量抗氧化能力表示,它代表1 L酚酸提取液与Trolox抗氧化能力相同时的Trolox质量,单位为mg/L。
1.3.5.2 还原能力测定
参照李欣等[13]的方法,采用高铁盐-铁氰化钾比色法测定样品的还原能力。取l mL样品溶液与2.5 mL 0.2 mol/L磷酸缓冲溶液(pH 6.6)和2.5 mL质量分数1% K3Fe(CN)6溶液混匀,50 ℃下保温20 min,随后加入2.5 mL、质量分数10%三氯乙酸溶液,混合后4 ℃ 3 000 r/min离心10 min。取上清液2.5 mL,加入2.5 mL去离子水和0.5 mL、质量分数0.1% FeCl3溶液,充分混合后,室温静置10 min,于700 nm波长处测定吸光度,并以该吸光度表征还原能力,以1 mg/L VC为阳性对照。
1.3.5.3 羟自由基清除能力测定
羟自由基清除能力采用相应试剂盒按说明书进行测定。
1.3.6 酚酸组分测定
参考张宇环[14]和汤春甫[15]的方法,用HPLC仪结合二极管阵列紫外-可见光检测器测定杨梅游离酚酸组分。将从不同成熟度杨梅中提取的酚酸过0.22 μm滤膜后进样,进样量为10 μL。所用色谱柱为C18反相色谱柱(4.6 mm×250 mm,5 μm)。柱温35 ℃,流动相A为体积分数4%乙酸,流动相B为色谱级无水甲醇,等度洗脱(V(A)∶V(B)=80∶20),流速1 mL/min,样品洗脱时间25 min。以标样的保留时间与紫外-可见光光谱图确定样品酚酸组成。绿原酸、咖啡酸、香豆酸和阿魏酸在320 nm波长处测定峰面积,原儿茶酸、对羟基苯甲酸、没食子酸和香草酸在260 nm波长处测定峰面积,外标法定量。实验结果表明,在0.1~0.6 μg/mL范围内标样质量浓度与峰面积线性关系良好(R2均大于0.998),测定可重复性、回收率、标准偏差结果良好。
1.4 数据处理与分析
采用SPSS 23软件对实验数据进行分析,所有实验进行3 次平行,测定结果以平均值±标准差表示,组间差异采用单因素方差分析进行Duncan’s差异分析,以P<0.05表示差异显著。
2 结果与分析
2.1 微波辅助提取杨梅酚酸的得率

图2 不同微波时间对杨梅酚酸得率的影响Fig.2 Effect of microwave treatment time on the yield of phenolic acid from bayberries by microwave assisted extraction
微波辅助提取是最常用的提取方法之一,微波加热可以提高目标组分的扩散能力,从而缩短提取时间[16]。如图2所示,酚酸得率随着微波处理时间的延长呈现先上升后下降的趋势。当微波时间为30 s时,酚酸得率达到最高,为23.41 μg/g。当微波时间超过30 s时,酚酸得率下降,可能是由于微波时间过长,温度太高,造成杨梅组分变性,影响了有机溶剂萃取的正常进行。
2.2 超声辅助提取杨梅酚酸的得率

图3 不同超声时间对杨梅酚酸得率的影响Fig.3 Effect of ultrasound treatment time on the yield of phenolic acid from bayberries by ultrasound assisted extraction
超声辅助提取是近几年较为常用的辅助提取植物天然成分的技术。超声波可以提取不耐热和不稳定的植物天然成分,通过在溶剂中的空化、机械和热效应强化提取效果[17]。如图3所示,随着超声时间的延长,酚酸得率逐渐上升,处理时间为25 min时达到最高(25.63 μg/g),继续延长超声时间,得率开始降低。虽然延长超声辅助提取时间有利于植物与提取溶剂充分接触,但对不稳定的活性物质,特别是在高温条件下,长时间处理可能会造成提取率的下降。
2.3 超声-微波协同提取酚酸的单因素试验结果
如图4A所示,乙醇体积分数在40%~60%范围内增加时,酚酸得率逐渐增加,当乙醇体积分数为60%时,酚酸得率达到最大,为26.46 μg/g。乙醇与水的混合液可以破坏酚类物质与蛋白质、多糖等物质的结合键,有利于酚酸的提取[18]。乙醇在60%~90%体积分数范围内增加时,酚酸得率逐渐降低,推测是随着溶剂的疏水性增加,杨梅内其他脂溶性物质溶出,竞争与酚酸-水分子结合;也可能是乙醇浓度过高,杨梅细胞失水,造成纤维紧缩,影响酚酸的渗出。
如图4B所示,随着溶剂比例增加,酚酸得率先上升后下降,料液比为1∶30时酚酸得率最高(33.02 μg/g)。物料与溶剂间的浓度差是植物提取过程中的推动力,但当酚酸溶出达到平衡时增加溶剂量也不能提高得率,反而可能会溶出更多杂质;同时,溶剂体积的增大可能降低了超声的工作效率,进而降低了酚酸得率。
如图4C所示,微波时间不变,随着超声时间的延长,酚酸得率呈现先上升后下降的趋势。微波30 s+超声15 min时的酚酸得率最高,为33.92 μg/g。微波和超声单一辅助提取的结果显示,微波辅助提取时间短但是得率低,超声辅助提取得率高但是时间长,超声-微波协同提取得到的最高酚酸提取率明显高于微波提取和超声提取的最高值,且缩短了提取时间,效果较好。
2.4 超声-微波协同提取酚酸的响应面优化试验结果

表2 Box-Behnken试验设计及结果Table 2 Box-Behnken design with experimental results

表3 回归方差分析结果Table 3 Analysis of variance for the fitted regression model
根据Box-Behnken的中心组合试验设计原理,结合单因素试验结果,采用响应面法对杨梅游离酚酸的提取工艺进行优化,以乙醇体积分数(A)、料液比(B)、超声时间(C)为自变量,杨梅酚酸得率(Y)为响应值,得出杨梅游离酚酸得率的三因素三水平的结果如表2所示。利用Design Expert软件对上述结果进行分析,得到酚酸得率(Y)对乙醇体积分数(A)、料液比(B)、超声时间(C)的二次多项回归方程为:Y=36.25-0.047A-0.52B+0.12C+0.046AB-0.055AC-0.06BC-1.03A2-0.73B2-1.11C2。
试验所选用模型P值为0.022 3,显著(P<0.05),决定系数R2=0.8 6 6 1 >0.8,失拟误差不显著(P=0.085 3>0.05),说明响应值的变化有86.61%来源于所选变量,该方程的拟合情况较好。各项系数的P值小于0.05时,它所对应的条件对酚酸得率的影响是显著的,由表3可知,一次项B(P=0.039 7<0.05)显著、A(P=0.826 1>0.05)不显著、C(P=0.582 8>0.05)不显著。但是A2(P=0.008 7<0.01)、C2(P=0.006 1<0.01)极显著,说明各因素对响应值的影响不是简单的线性关系。


图5 两因素交互作用对酚酸提取量的响应面图和等高线图Fig.5 Response surface and contour plots showing the interactive effects of ethanol concentration, solid-to-solvent ratio, and ultrasonic-microwave treatment time on the extraction yield of phenolic acids from bayberries
根据回归方程作出的响应面和等高线图能直观反映各实验因素的交互作用[19],等高线图可以反映交互作用的强弱,图形越趋向椭圆表明交互作用越强,越趋向圆形表明交互作用越弱[20]。如图5所示,乙醇体积分数和超声时间、料液比和超声时间之间的等高线图趋于椭圆,响应面图的曲面较陡,交互作用明显。乙醇体积分数和料液比的等高线图趋于圆形,响应面图曲面较平,交互作用较小。比较3 组图可知,料液比对酚酸得率的影响最为显著,表现为曲面较陡。如图5C所示,在超声时间不变时,酚酸得率随着料液比的下降先上升后逐渐减小,最高值在1∶23附近;而超声时间和乙醇体积分数次之,如图5B所示,在料液比固定不变时,酚酸得率随着乙醇体积分数的增加呈现先上升后下降的趋势,最高值在乙醇体积分数60%左右;如图5A所示,在乙醇体积分数固定不变时,酚酸得率随着超声时间的延长呈现先上升后下降的趋势,最高值在超声15 min附近。
2.5 验证性实验结果
为检验模型预测的准确性,采用响应面优化的工艺条件(乙醇体积分数59.68%、料液比1∶23.2、超声时间15.32 min)提取杨梅酚酸,考虑到实际性操作,将最优工艺条件调整为乙醇体积分数60%、料液比1∶23、超声-微波协同处理时间为微波30 s再超声15 min,进行验证性实验,重复3 次实验,得到实际酚酸得率为(36.21±0.12)μg/g,与实际预测酚酸得率36.34 μg/g无显著性差异,重复性好,证明该方程的准确性和实用性[21],具有一定的实际指导意义。魏欣等[22]通过超声微波交替辅助提取棕榈藤叶片的酚酸发现,首先采用微波辅助提取可以使酚酸分子发生碰撞和摩擦,产生的大量热量使细胞壁纤维变形细胞破裂,之后通过超声辅助提取形成空化泡、微射流、冲击波等进一步增加细胞膜通透性,同时降低微波辐射产生的浓差极化现象,减少有效成分扩散的阻力,提高酚酸得率。
2.6 不同成熟度杨梅游离酚酸的组成

表4 不同成熟度杨梅中游离酚酸的组成Table 4 Composition of free phenolic acids in bayberries of different maturities
采用HPLC法检测了4 种不同成熟度杨梅果实中8 种常见酚酸的含量,结果如表4所示。五分熟和过熟杨梅果实中游离酚酸含量最高,各种酚酸在不同成熟度杨梅的分布不同,羟苯甲酸型酚酸(没食子酸、原儿茶酸、对羟基苯甲酸)在4 种成熟度杨梅中均被检出且含量较高,说明是杨梅果实的主要酚酸种类。咖啡酸、香豆酸和绿原酸检出较少或没有检出,张宇环[14]检测东魁杨梅汁的酚酸组分时,除咖啡酸和香草酸外其他6 种均有检出,黄海智[1]检测东魁杨梅果实的酚酸组分,8 种酚酸均有检出,结果的差异可能是原料产地或提取方式造成的。五分熟杨梅中没食子酸(13.46 μg/g)、对羟基苯甲酸(7.56 μg/g)和香草酸(8.14 μg/g)含量显著高于其他成熟期的杨梅(P<0.05)。过熟杨梅中原儿茶酸(10.01 μg/g)、香豆酸(2.5 5 μ g/g)和阿魏酸(1.6 9 μ g/g)含量显著高于其他成熟期的杨梅果实(P<0.05)。此外,在香蕉,蜜桔中已检测到丁香酸、芥子酸、鞣花酸等组分[23],可能杨梅果实中也存在着除上述8 种酚酸以外的其他组分。
2.7 不同成熟度杨梅酚酸提取物的抗氧化能力
如图6A所示,五分熟、七分熟、成熟、过熟的杨梅总游离酚酸含量分别为45.50、36.37、34.76 μg/g和44.50 μg/g,五分熟的杨梅总酚酸含量最高,但与过熟杨梅无显著性差异(P>0.05),七分熟和成熟杨梅的总酚酸含量显著低于五分熟和过熟杨梅(P<0.05),但两者间无显著性差异(P>0.05)。酚酸是植物的次生代谢物,影响其积累的主要因素是遗传,五分熟杨梅的酚酸含量最高可能是因为在该时期酚酸生物合成反应多于分解代谢反应。此外,外界环境如营养、光照、微生物侵入等也会对酚酸的积累有影响。杨梅果实酚酸化学方法测定结果略高于HPLC法检测结果,可能是由于提取液中其他组分存在影响了化学法的精准性。
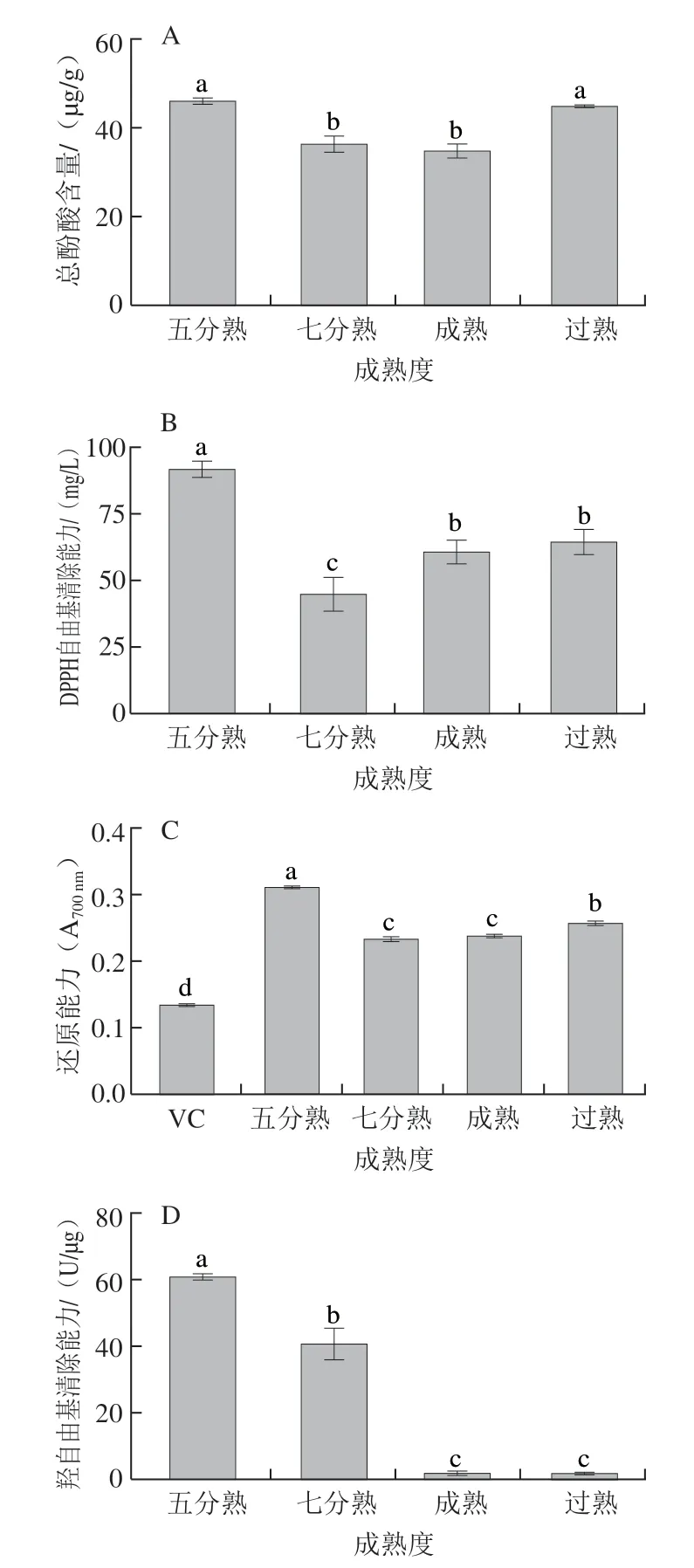
图6 不同成熟度杨梅酚酸提取物的抗氧化能力Fig.6 Antioxidant capacity of phenolic acids from bayberries of different maturities
DPPH自由基清除能力、还原能力、羟自由基清除能力都反映了杨梅酚酸提取物抗氧化能力的大小。如图6B所示,五分熟杨梅酚酸提取物的DPPH自由基清除能力最高,为91.47 mg/L,其次为成熟(60.6 mg/L)和过熟杨梅(64.5 mg/L),七分熟的杨梅最低,为44.75 mg/L。抗氧化能力与还原能力有关,还原能力越大抗氧化能力越强。如图6C所示,不同成熟度的杨梅酚酸提取物还原能力有所差异,五分熟杨梅的酚酸提取物还原能力最强,其次是过熟杨梅,最弱的是七分熟和成熟杨梅,但都均大于VC的还原能力。结合图6A~C可以看出,不同成熟度杨梅的抗氧化能力与游离酚酸含量相关,总游离酚酸含量越高的样品抗氧化能力越强。然而,羟自由基清除能力的结果略有不同,五分熟杨梅酚酸提取物最强,为60.64 U/μg,显著高于七分熟杨梅(40.77 U/μg)。成熟和过熟杨梅酚酸提取物的羟自由基清除能力分别为1.439 U/μg和1.401 U/μg,两者间无显著性差异(P>0.05)。不成熟的杨梅酚酸提取物羟自由基清除能力显著高于成熟杨梅酚酸提取物,这可能是不同成熟度杨梅中酚酸种类存在差异引起的。
2.8 杨梅游离酚酸含量与抗氧化能力相关性分析结果

表5 杨梅游离酚酸含量与抗氧化能力相关性Table 5 Correlation coefficients between free phenolic acid content and antioxidant capacity
为了进一步了解杨梅游离酚酸含量与其抗氧化能力的关系,分别对杨梅各个酚酸及总游离酚酸含量与DPPH自由基清除能力、还原能力、羟自由基清除能力进行Pearson相关性分析,结果如表5所示。比较杨梅的总酚酸含量与各抗氧化指标的相关性,其与还原能力极显著相关,相关系数最高,为0.855(P<0.01);与DPPH自由基清除能力的相关系数次之,为0.707(P<0.01);与羟自由基清除能力的相关性最低,为0.484(P>0.05)。对羟基苯甲酸、香草酸含量与DPPH自由基清除能力、还原能力和羟自由基清除能力均显著正相关;没食子酸含量与还原能力、羟自由基清除能力也呈极显著正相关。沈清等发现梅干菜的抗氧化能力不仅与总酚含量显著相关,与总黄酮含量也显著相关[24]。关于3 种抗氧化能力评价方法,DPPH自由基清除能力与还原能力的相关性最高,相关系数为0.857(P<0.01);而羟自由基清除能力与DPPH自由基清除能力、还原能力的相关性较低,分别为0.368(P>0.05)和0.635(P<0.05),这可能与三者检测的原理不同有关。
3 讨 论
本研究发现提取方法对杨梅的游离酸酸得率具有一定的影响,以超声-微波协同提取法所得酚酸提取率最高,在本实验优化条件下提取率可达36.21 μg/g;超声辅助提取次之,最高为25.63 μg/g;微波辅助提取最低,最高为23.41 μg/g。可见相对于单一的微波或超声提取法,超声-微波协同提取在缩短提取时间的同时提高了酚酸得率。蒋志国等[25]通过比较微波辅助法、超声辅助法以及超声-微波协同提取法对菠萝蜜果皮中多酚的提取效果,得出了相似的结果。酚类物质的常规提取方法具有局限性,如溶剂消耗多、提取时间长以及目标化合物易降解[26],超声-微波协同提取使样品介质内各点受到的作用一致,从而降低了酚酸与样品基体的结合力,加之微波的热效应,能在短时间内破坏杨梅细胞结构,加速酚酸从固相进入溶剂的过程[27],进而大幅提高酚酸得率。
酚酸在植物不同组织、不同成熟期其含量、组成有较大的变化。张宇环[14]检测了14 种不同品种杨梅的酚酸含量及组成,发现游离酚酸含量高于酯合酚酸。本研究对‘东魁’杨梅的游离酚酸进行提取并检测其不同成熟度的游离酚酸含量及组成,发现酚酸含量随着成熟度的增加呈现先下降后上升的趋势,五分熟和过熟杨梅的含量最高,羟苯甲酸型酚酸(没食子酸、原儿茶酸、对羟基苯甲酸)是杨梅游离酚酸的主要种类。同样,Fang Zhongxiang等[28]也发现杨梅的主要酚酸为没食子酸,刘翼翔等[29]发现绿原酸、阿魏酸、对香豆酸和咖啡酸为蓝莓的主要酚酸类型,Mattila等[30]发现黑莓中的鞣花酸是主要的酚酸,可见不同浆果果实中酚酸的种类和含量存在差异。没食子酸已被证实具有抗炎、抗菌、抗癌等功效,被广泛应用于保健食品中[31],近期研究表明原儿茶酸具有降血糖、保护肝脏及抗氧化等功效[32],但关于对羟基苯甲酸功能活性的研究较少。明确杨梅果实中酚酸的组成,有助于杨梅活性成分的挖掘及评价,为后期开发具有明确营养功能的保健产品奠定基础。
体外抗氧化结果表明,4 种不同成熟度杨梅果实的游离酚酸均具有一定的抗氧化活性。不同成熟度杨梅由于所含的抗氧化成分和抗氧化活性物质的结构不同,所以抗氧化能力存在显著差异。五分熟杨梅游离酚酸提取物的DPPH自由基清除能力、羟自由基清除能力及还原能力均较强,这可能与其酚酸含量相对最高有关。对杨梅游离酚酸含量与抗氧化活性之间的相关性进行研究发现,总酚酸含量与DPPH自由基清除能力、还原能力呈极显著相关(P<0.01),与羟自由基清除能力无显著相关性。范智义等[33]发现桑椹提取物的总花色苷含量与抗氧化能力回归关系显著,Bahorun等[34]发现芥菜的总黄酮含量与抗氧化能力显著相关,可见除酚酸外,杨梅中还含有其他的抗氧化成分在羟自由基清除能力方面起主要作用,具体还有待进一步研究。此外,本研究还发现对羟基苯甲酸、香草酸含量与DPPH清除能力、还原能力和羟自由基清除能力均呈显著正相关;没食子酸含量与还原能力、羟自由基清除能力也成极显著正相关。Zhang Jing等[35]发现对羟基苯甲酸可以抑制黄瓜幼苗在热胁迫条件下产生超氧阴离子自由基、过氧化氢和丙二醛。香草酸也被证实具有抗氧化和抗菌等生理活性,其前体还具有抗肿瘤和抗诱变的特性[36]。本研究明确了杨梅酚酸中起主要抗氧化作用的组分,为杨梅活性成分的进一步研究及产品的开发利用提供理论依据。

