血橙花色苷大孔树脂纯化工艺及抗氧化研究
胥萍 林小靖 付红伟
摘 要 研究了D101、HPD-300、NKA-9和AB-8四种大孔树脂富集纯化血橙花色苷的性能和分離特性,发现D101是纯化血橙花色苷较适合的树脂类型。为了优化工艺,在D101大孔树脂上进行了静态和动态的吸附和解吸实验,结果表明:血橙汁在D101大孔树脂的上样体积为10 BV,吸附平衡时间2 h;选择pH值为2的60%乙醇进行洗脱,洗脱体积为8 BV。经纯化后得到的血橙花色苷为深红色粉末,色价为48.4。血橙花色苷具有较好的抗氧化性能,在一定的浓度范围内,对DPPH和ABTS自由基有一定的清除作用,其作用随浓度的增加而增强。
关键词 血橙;花色苷;大孔树脂;纯化;抗氧化
中图分类号:TS255.1文献标志码:ADOI:10.19415/j.cnki.1673-890x.2021.01.002
血橙[Citrus sinensis L.(Osbeck)]属于芸香科柑橘属甜橙类[1],果实含有丰富的活性物质,如花色苷、类黄酮、羟基肉桂酸、抗坏血酸等[2-3]。花色苷的含量被认为是血橙果实的重要品质指标,其抗氧化活性对人体健康也具有重要意义[4]。血橙中含有的花色苷对人体健康有益,可以抗癌、预防糖尿病和心脏病(动脉硬化)、抗氧化及抗衰老等[5-6]。大孔树脂是一类具有大孔结构的有机聚合物吸附剂,广泛应用于生物化学上的分离纯化。大孔树脂相比于其他的纯化方式,具有大孔网状结构和大比表面积、吸附速度快、选择性好、可循环使用且再生处理经济环保、方便制剂成型等优势[7-8]。本实验比较了四种大孔树脂对血橙花色苷的吸附分离效果,对其吸附解吸性能进行研究,旨在从中筛选出较为合适的血橙花色苷分离纯化树脂类型。
1 材料与方法
1.1 材料与仪器
血橙果实采摘自四川省资中县血橙基地。大孔树脂D101、HPD-300、NKA-9:沧州宝恩化工公司;大孔树脂AB-8:天津允开公司。柠檬酸、氯化钾和盐酸:广州试剂厂。
紫外可见分光光度计:岛津 UV-1800;摇床:江苏太仓TH2-C-1;pH计:赛多利斯PB-10。
1.2 实验方法
1.2.1 血橙花色苷粗品制备
将新鲜血橙果实去皮后打成匀浆,将其置于离心机4 000 r·min-1离心15 min,取上清液备用,即得血橙花色苷粗品[9]。
1.2.2 pH差示法测定血橙花色苷含量
参考文献[9],采用pH差示法测定血橙花色苷含量。
1.2.3 花色苷大孔树脂筛选实验
准确称取1.00 g的各类型大孔吸附树脂,置于具塞锥形瓶中,加入血橙花色苷粗品20 mL,在25 ℃恒温条件下以120 r·min-1的转速搅拌3 h。测定花色苷的含量,实验设3个平行试验。吸附平衡后,先用去离子水洗涤2次后,再加入10 mL的50%乙醇到含有1.00 g吸附饱和树脂的具塞锥形瓶中。在25 ℃恒温条件下以120 r·min-1的速度震荡1 h。测定解吸后的花色苷含量,计算不同型号树脂的吸附率和解吸率。吸附率和解吸率计算公式如下:
吸附率=(C1-C2)/C1×100%
解吸率=C3/(C1-C2)×100%
上式中,C1为溶液在吸附前的花色苷含量,C2为吸附完全后的花色苷含量,C3为经过吸附后解吸液的花色苷含量。
1.2.4 确定血橙花色苷大孔树脂的最佳吸附时间
称取上述试验筛选出的大孔吸附树脂1.00 g,置于具塞锥形瓶中,加入血橙花色苷粗品20 mL,放于摇床中,震荡转速为120 r·min-1,在不同时间测定吸附液中血橙花色苷的含量,直至达到平衡。实验设3个平行试验。
1.2.5 不同浓度乙醇对大孔吸附树脂静态解吸血橙花色苷影响
称量1.00 g吸附饱和花色苷的大孔树脂,分别加入20%、30%、40%、50%、60%、70%、80%、100%乙醇洗脱液10 mL,测定溶液中花色苷的含量。实验设3个平行试验。
1.2.6 洗脱液pH对大孔吸附树脂静态解吸血橙花色苷的影响
称取吸附饱和花色苷的大孔树脂1.00 g于10 mL pH值分别为1.0、2.0、3.0、4.0和5.0的60%乙醇解吸液中,测定解吸后的花色苷含量。实验设3个平行试验。
1.2.7 树脂吸附血橙花色苷泄露曲线的绘制
取10 mL预处理后的大孔树脂,湿填料于柱中,然后流速为2 mL·min-1上样。流出液每10 mL收集1次流份,并测定每个流份的吸光值,当流出液的花色苷含量达到上样液花色苷含量的1/10时,认为已经有花色苷泄露,据此绘制泄露曲线[10]。
1.2.8 大孔树脂动态解吸体积测定
量取10 mL预处理后的树脂进行湿法装柱,血橙花色苷粗品上样于树脂柱达到吸附饱和后先用去离子水洗涤,再用60%乙醇洗脱,洗脱流速为2 mL·min-1,每10 mL收集1次流份,并测定每个流份的吸光值,据此绘制洗脱曲线。
1.2.9 血橙花色苷色价测定
参照《中国人民共和国国家标准GB6718-86》方法测定血橙花色苷色价。
1.2.10 血橙花色苷清除DPPH自由基能力测定
配制 0.06 mmol·L-1 DPPH溶液,取5 mL DPPH溶液加入1 mL的待测溶液,摇匀,避光反应30 min。每个样品做三个平行。以去离子水为参比,在518 nm处测各待测液的吸光值,然后计算清除率。
1.2.11 血橙花色苷清除ABTS自由基能力测定
配制7 mmol·L-1 ABTS溶液,加入0.88 mL(14 mmol·L-1)过硫酸钾溶液,室温避光静置过夜,用无水乙醇稀释此液至734 nm处测得的吸光度为 0.70±0.02,即得ABTS工作液。取7.8 mL ABTS工作液加入200 μL的待测液,摇匀,避光反应10 min。每个样品做三个平行。以去离子水为参比,在734 nm处测各待测液的吸光值,然后计算清除率。
2 结果与分析
2.1 四种大孔树脂对血橙花色苷的静态吸附与解吸作用
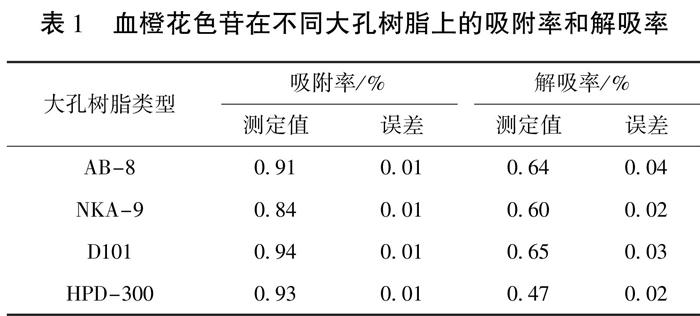
由表1可以看出,四种大孔树脂对血橙花色苷均有一定的吸附作用,树脂的吸附和解吸性能与树脂的性质和溶质的化学性质有关。其中树脂D101、HPD-300略高于其余2种树脂,表明在静态吸附阶段,D101、HPD-300可以更好地吸附和保护花色苷,避免花色苷的损失。D101、AB-8大孔树脂的解吸率较高,分别为65%、64%,说明在该解吸条件下D-101和AB-8相比于另外2种大孔树脂能释放更多的花色苷。通过以上分析可见,D101大孔树脂对血橙花色苷的吸附和分离效果较好,于是对D101大孔树脂进行了后续实验。
2.2 大孔树脂吸附花色苷的时间
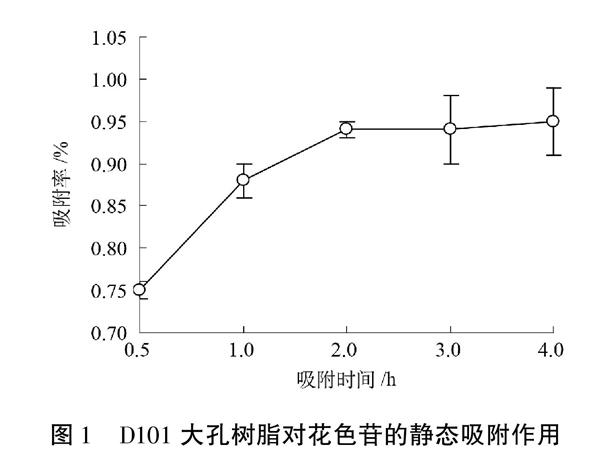
由图1可见,D101对血橙花色苷的吸附率在前0.5 h快速增加,1 h后缓慢增加,在2 h左右达到平衡,说明血橙花色苷在D101大孔树脂上吸附2 h已经达到了平衡。
2.3 不同解吸液乙醇浓度对血橙花色苷静态解吸的影响
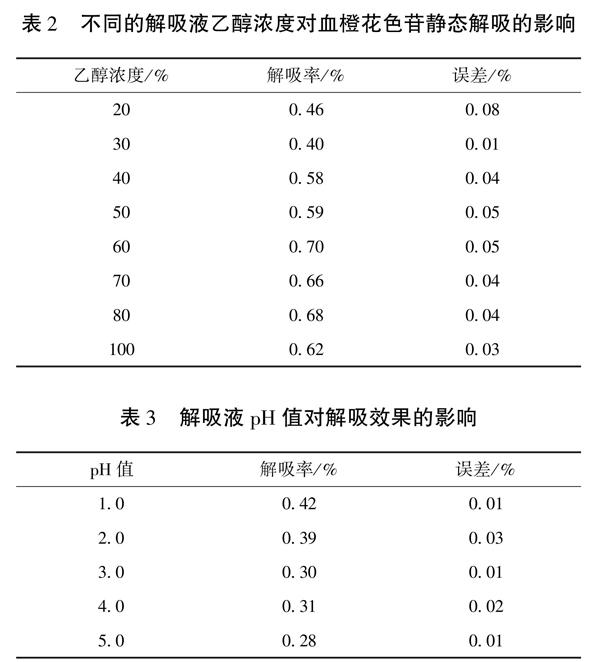
为了选择合适的解吸溶液,采用不同浓度的乙醇水溶液进行了解吸试验。由表2结果可知,解吸率随乙醇浓度的增加而增大,在60%浓度时达到峰值,然后随乙醇浓度的增加而减小。因此,选择60%乙醇水溶液作为花色苷的合适解吸溶液,用于花色苷的动态解吸实验。
2.4 不同解吸液pH对血橙花色苷静态解吸的影响
不同解吸液pH对血橙花色苷解吸的影响表现为随着pH值的升高,D101大孔树脂对血橙花色苷的吸附率逐渐降低(见表3),这与较高pH值条件下花色苷的稳定性较差有关。但pH值为1.0、2.0时的花色苷吸附率相差不多,由于较低的pH值容易使花色苷的糖基发生水解现象,影响花色苷分子的稳定性,吸附率下降,因此选择pH值2.0最适合。
2.5 上样体积对大孔吸附树脂动态吸附血橙花色苷的影响
D101大孔树脂对血橙花色苷的吸附泄漏曲线(见图2)显示,D101对血橙花色苷吸附量随着上样溶液体积的增大而增大,流出液体积由1 BV到10 BV的过程中,其吸光值的增加幅度较缓,而当流出液体积由10 BV上升到11 BV时吸光值的增加幅度明显加大,出现了明显差异。当流出液体积为11 BV时其吸光值已达到上样溶液含量的1/10,即出现泄漏。
2.6 大孔树脂动态解吸体积测定
由图3可以看出,酸化60%乙醇可洗脱D101大孔树脂吸附的大部分花色苷,在前1 BV时即有检测到花色苷流出,当洗脱体积达到8 BV时已洗脱出上样花色苷总量的96%。
2.7 纯化后花色苷产品色价测定
本实验表明,经D101大孔树脂纯化后,血橙花色苷色价为48.4,呈现为红色膏状物;而未纯化的血橙花色苷色价为0.8,呈现深红色。
2.8 血橙花色苷清除DPPH自由基的能力
DPPH自由基是稳定的紫色自由基,可以用来衡量抗脂质氧化能力[11]。由图4可见,血橙花色苷在浓度为(0.15~1.50 mg·mL-1)的范围内,随添加浓度的增大,对DPPH自由基的清除率随之增大,清除率最高可达92.7%,IC50为0.437 mg·mL-1。
2.9 血橙花色苷清除ABTS自由基的能力
ABTS为一稳定的有机自由基,对其清除的能力直接反映出样品抗氧化能力的大小[11]。由图5可见,血橙花色苷在浓度为(0.22~1.63 mg·mL-1)的范围内,随添加浓度的增大,对ABTS自由基的清除率随之增大,清除率最高可达89.2%,IC50为0.680 mg·mL-1。
3 结论
D101大孔树脂对血橙中花色苷具有良好的吸附和解吸能力。吸附和解吸的最佳条件:上样体积为10 BV,在2 h静附后,大孔吸附树脂的静态吸附达到饱和,洗脱溶剂用pH值为2的60%乙醇,洗脱体积为8 BV。纯化后的血橙花色苷为深红色粉末。血橙花色苷具有较好的抗氧化性能,在一定的浓度范围内,对DPPH自由基和ABTS自由基有一定的清除作用,其作用随浓度的增加而增强。
参考文献:
[1] 曹少谦,潘思轶.血橙花色苷研究进展[J].食品科学,2006(09):278-281.
[2] Carmona L,Alquezar B,Tarraga S,et al.Protein analysis of Moro blood orange pulp during storage at low temperatures[J].Food chemistry,2019,277:75-83.
[3] Habibi, F,Ramezanian,A.Vacuum infiltration of putrescine enhances bioactive compounds and maintains quality of blood orange during cold storage[J].Food Chemistry,2017,227:1-8.
[4] Habibi F,Ramezanian A,Guillén F,et al.Blood oranges maintain bioactive compounds and nutritional quality by postharvest treatments with γ-aminobutyric acid,methyl jasmonate or methyl salicylate during cold storage[J].Food chemistry,2020,306:125634.
[5] Titta L,Trinei M,Stendardo M,et al.Blood orange juice inhibits fat accumulation in mice[J].International Journal of Obesity,2010,34(03):578-588.
[6] Molinu M G,Dore A,Palma A,et al.Effect of superatmospheric oxygen storage on the content of phytonutrients in ‘Sanguinello Comuneblood orange[J].Postharvest Biology and Technology,2016,112:24-30.
[7] 杨敏,张天锡,史磊,等.大孔吸附树脂分离纯化中药成分影响因素探讨[J].中草药,2020,51(15):4050-4058.
[8] 周萍,吳仲君,黄才欢,等.花色苷提取及纯化研究进展[J].精细化工,2020,37(08):1513-1523.
[9] 曹少谦,潘思轶,姚晓琳,等.柱层析法分离纯化血橙花色苷[J].中国农业科学,2009,42(05):1728-1736.
[10]勾智丽.笃斯越桔花色苷纯化工艺的研究[J].林业科技,2019,44(06):31-35.
[11]杨少辉,宋英今,王洁华,等.雪莲果体外抗氧化和自由基清除能力[J].食品科学,2010,31(17):166-169.
(责任编辑:丁志祥)
收稿日期:2020-09-09
基金项目:四川省科技计划项目“抗衰血橙花色苷微胶囊化的关键技术及产业化研究”(No.2019YFSY0023)。
作者简介:胥萍(1989—),女,四川汶川人,硕士,主要从事化妆品研究。E-mail:1932962141@qq.com。
*为通信作者,E-mail:fhw@zstu.edu.cn。

