清热功效指引下的新疆软紫草活性分子筛选与解热镇静作用评价
孙钦荣,张波,陈韩英
(石河子大学药学院/新疆植物药资源利用教育部重点实验室,新疆 石河子 832000)
发热[1]使神经系统兴奋性升高,甚至有些高热病人神经系统由于过度兴奋处于抑制状态,表现出神情淡漠、嗜睡等,如中暑后的热休克[2]。引起发热的疾病很多且较为复杂,是临床对疑难疾病诊治中的难点,其中绝大多为由感染引起的急性短期发热,常见于肿瘤,血管-结缔组织病,及细菌,烧烫伤等[3]引起的全身性感染或者使用一些化学致热剂如减肥药2,4-二硝基苯酚引起的体温过高等[4]。发热是人体的一种防御性反应,但体温过高或时间过长可使机体各种调节功能失调,甚至危及生命。目前临床治疗发热主要针对病因,根据感染源不同选择药物进行治疗,脱水的患者要积极进行补液及降温处理[5],严重者给予镇静、解痉、退热和吸氧等措施[6],一般常用降温和镇静的药物有如阿司匹林,糖皮质激素,地西泮等,这些虽能快速降低体温缓解焦虑,见效快,但疗效单一,长期使用有一定副作用,而中医理论中“清热解毒”、“辛凉解表”等治疗观点与现代解热作用相似,中药无成瘾性及副作用少的优点使其大力发展得到广泛而深入的研究,因此寻找更多具有解热镇静作用的中药或活性分子可作为研究的重点。
依据中医“治热以寒”的经验紫草的使用频次很高,新疆软紫草为主要药用来源,极具地方特色,研究和发展也最为成熟[7]。相对于其他中草药,虽然它的药理作用趋于成熟且显示出优异的药效,但对于中枢的作用尚不清晰,因此本文以SK作为新疆软紫草的代表分子,基于SK治疗血热证(Blood heat syndrome,BHS)[8]及对中枢保护的研究,从系统药理学角度探讨并验证SK对中枢可能的解热镇静作用,为新疆软紫草对于中枢的作用奠定现代药理学依据。
1 材料与方法
1.1 材料
1.1.1 动物分组与给药
实验动物为昆明小鼠(SPF级,许可证号SYXK(新)2018-0003),购自新疆医科大学实验动物研究中心。鼠龄(6~8周),体重(18~26 g),所有实验均按照实验规定进行,操作和管理均遵守《实验动物管理条例》和《石河子大学动物管理条例》。
36只雄性昆明小鼠随机分为6组,分别为生理盐水对照组,2,4-二硝基苯酚模型组,阳性对照组,SK给药组(5 mg·kg-1,10 mg·kg-1,20 mg·kg-1)。其中阳性对照有2个:阿司匹林200 mg·kg-1造模前2 h单次灌胃给药作为解热作用对照,阿普唑仑2 mg·kg-1造模前4 h单次腹腔注射给药作为镇静作用对照;此外SK组造模前4 h单次腹腔注射不同剂量的SK。
1.1.2 试剂与药品
紫草素(Shikonin,纯度≥98%,南京道斯夫生物科技有限公司),生理盐水(四川科伦药业股份有限公司),2,4-二硝基苯酚(DNP,北京试剂),阿司匹林肠溶片(拜耳医药保健有限公司),阿普唑仑(北京益民药业有限公司),戊巴比妥钠(新华化工厂)
1.1.3 仪器
电子天平AR-2140型(梅特勒-托利多仪器有限公司),旷场/MORRIES水迷宫动物行为视频分析系统(中国医学院科学院药物研究所),小鼠电子肛温计(北京东西仪科技有限公司),AU680自动生化分析仪(贝克曼库尔特商贸(中国)有限公司)。
1.2 方法
1.2.1 软紫草网络药理学研究
1.2.1.1 软紫草化学成分和靶点的网络建立及分析
基于大量文献和数据库如TCMSP[9],中国天然产物化学成分数据库,中药化学数据库-TCMID[10]等收集紫草的化学成分,利用admet SAR方法[11](http://lmmd.ecust.edu.cn/admetsar1/)预测所有化学分子吸收和代谢相关参数,筛选口服生物利用度较高的成药分子,利用基于网络推理法平衡的子结构药物靶点方法(balanced substructure-drug-target network-based inference model,bSDTNBI)预测靶点,将所有化学成分和靶点导入到Cytoscape 3.6.1(http://www.cytoscape.org/)中构建化合物-靶点网络图,关键靶点导入基因功能分析网站进行KEGG通路富集来获得参与的相关生物学过程及通路。
1.2.2 分子对接
根据网络分析结果,本文通过对关键靶点和药物分子之间的相互作用预测其结合模式和亲和力来验证紫草活性成分与相关靶标之间的作用。使用AutoDock Vina程序将新得到的受体与配体结构进行反复对接以达到稳定构象。此外使用计算机集群分别对蛋白环境和小分子环境之间相互作用能进行系综平均,从而计算出受体-配体结合自由能。
1.2.3 BHS小鼠模型的建立
血热证指脏腑火热炽盛,热迫血分,以出血、疮疖与实热症状为主要表现的证候。《中医诊断学》[13]将“血热”描述为 “发热,口渴,面赤或颧红,烦躁不宁,小便黄短,大便燥结等表现,因此本文单次颈部皮下注射25 mg·kg-1的DNP建立BHS小鼠模型,并检测小鼠的体温,饮水量,尿液量,粪便含水量等作为成功建立BHS小鼠模型的标准[8,14]。
1.2.4 对BHS小鼠凝血系统的影响
DNP注射120 min后,各组小鼠以10%水合氯醛麻醉,摘眼球取血,2 mL全血使用肝素抗凝,测定内外源性凝血功能指标。
1.2.5 对BHS小鼠自主活动次数的影响
各组小鼠分别提前放入活动箱适应5 min,给药后记录小鼠的自主活动次数(移动次数,梳理次数,抬上肢次数)。
1.2.6 BHS小鼠体温测定
实验前每早晚各测一次小鼠直肠温度(TR),同一时间段肛温变化低于±0.5 ℃的小鼠被挑出用于后续实验。建立小鼠模型2 h或4 h前给药并测量0至480 min内小鼠的TR。
1.2.7评估在正常和BHS小鼠体内对戊巴比妥钠诱导睡眠作用的影响
给药后各组小鼠分别腹腔注射戊巴比妥钠(70 mg·kg-1),观察并记录入睡潜伏期和睡眠持续时间,评价药物对戊巴比妥钠诱导小鼠睡眠作用的影响。
1.2.8旷场实验分析对BHS小鼠的自主行为的影响
借助MORRIES水迷宫动物行为视频分析系统记录运动总距离,平均速度及运动轨迹为其镇静作用增加证据,为避免不同小鼠之间气味的影响,每只小鼠在此空间检测完后用75%酒精擦拭以消除影响。
1.2.9 统计学分析

2 结果与分析
2.1 软紫草网络药理学研究
2.1.1软紫草活性化学成分与靶点的网络构建及分析
汇总TCMSP等多个数据库和文献的检索结果共收集105个化学成分,经过口服生物利用度(OB≥30%),类药性(DL>0.18),Caco-2细胞渗透率以及CYP450代谢酶(包括1A2,2C9,2D6,2C19,3A4)筛选打分[15],排在首位的是SK和阿卡宁(表1),两者为旋光性不同的光学异构体,SK含量比阿卡宁高,因此本文将选择SK作为活性分子验证软紫草的药效。
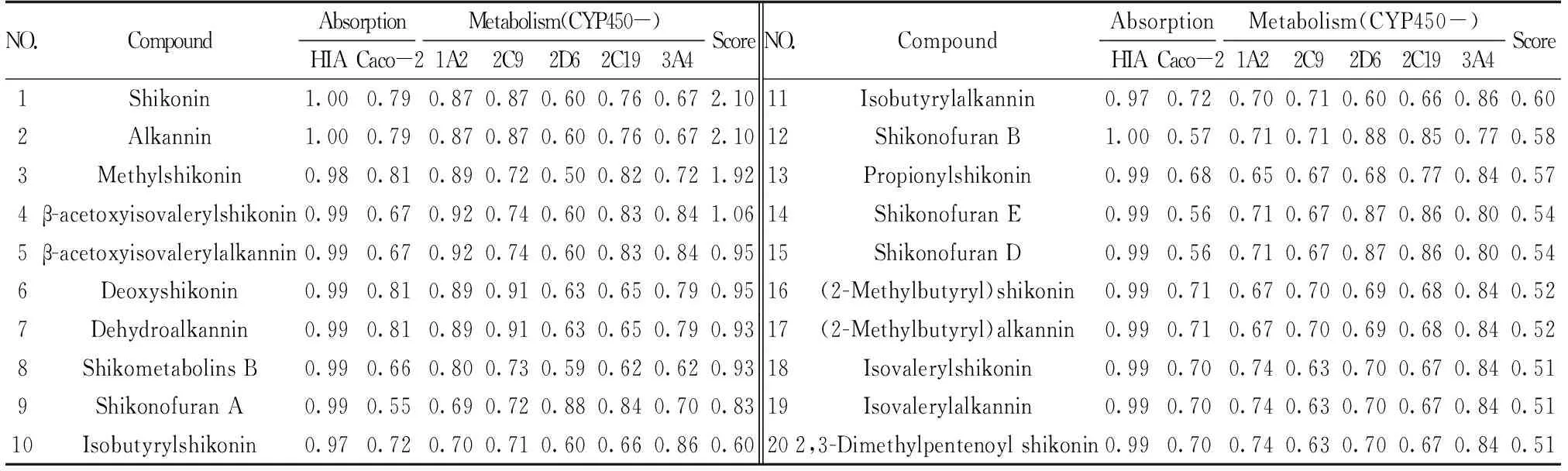
表1 ADME性质预测TOP20的紫草化学成分
基于bSDTNBI方法预测及文献报道,共计218个靶点。对排名前20的紫草活性成分和作用靶点关联,如图1a所示,MCODE网络拓扑学分析(图1b)显示主要与免疫炎症,中枢神经递质传递,氧化应激,血液循环和物质代谢有关,其中与中枢神经模块打分最高。
由图1b中红色和橙色节点所见,该网络中OPRM1,OPRK1,HTR2A,ACHE,ADRB2,GABRG2等72个靶点度值和节点关联度较高,为紫草与中枢神经系统的相关靶点,关键靶点的KEGG通路分析(图1c)显示主要在神经-受体配体关系通路中发挥作用,而KCNH2,CDK2,MAPK10,BCL2L1等靶点主要分布在癌症通路,与紫草抗肿瘤作用有关,其他相关性较大的有药物代谢和氮代谢通路。其中与中枢神经相关的OPRM1,OPRD1,OPRK1及GABRG2等靶点的贡献程度很大,并且研究显示γ-氨基丁酸/谷氨酸受体,阿片受体与镇静镇痛直接有关,可参与多种行为和生理控制的过程[16],提示了紫草的镇静作用可能与阿片样物质系统和抑制或兴奋性递质的代谢有关,因此本文后续将结合药靶互作的方法对此进行验证。

图1 新疆软紫草化学成分靶点及MCODE和关键KEGG通路分析
2.1.2 药靶互作
本文选择结构具有高解析度 X 射线蛋白晶体结构为模板,参照方法2.1.2进行对接。如图2a和图2b所示,SK与阿片受体(OPRK1和OPRD1)的结合能为-8.80 kcal·mol-1和-8.00 kcal·mol-1,有较强的亲和力,与特异性阿片受体拮抗剂纳洛酮的亲和力相似(图2c、2d,分别为-9.50 kcal·mol-1和-8.40 kcal·mol-1)。其次将戊巴比妥钠作为阳性参照,发现SK和γ-氨基丁酸受体(GABA)及谷氨酸受体(Glu)结合作用强于戊巴比妥钠,其中GABA受体结合能力强于Glu受体(图2e~2h)。此外,验证了SK与中枢最终致热介质PGE2两个关键合成酶COX-2和PTGES的作用关系,其结合能力分别为-9.00 kcal·mol-1和-7.70 kcal·mol-1,强于阿司匹林-6.70 kcal·mol-1和-5.80 kcal·mol-1(图2i~2l)。

图2 分子对接打分
2.1.3SK对BHS小鼠的生存保护及解热作用
如图3a,单次颈部皮下注射DNP 30 min后观察到小鼠TR在60 min达到(39.36±0.09)℃,热程持续90 min。造模前2 h阿司匹林灌胃,SK给药组(5 mg·kg-1,10 mg·kg-1,20 mg·kg-1)造模前4 h单次腹腔注射小鼠后发现SK各组小鼠体温最高分别达到(38.75±0.41)℃,(38.30±0.10)℃,(37.96±0.47)℃,表明SK能降低BHS小鼠体温,并呈现量效关系。
同时为观察SK对DNP诱导高热小鼠的生存率,小鼠注射DNP 2.50 mg·mL-1,结果显示空白组小鼠无死亡,BHS小鼠生存时间最长达到60 min,而SK各组和阿司匹林显著提高了BHS小鼠的存活率(P<0.05)(图3)。

Ctrl:正常对照组,Asp:阿司匹林组;图3 SK对BHS小鼠的保护及解热作用
2.1.4 SK对BHS小鼠一般诊断标准的作用
造模过程中,BHS组小鼠全程烦躁不安,小鼠口唇色鲜红,颈部被毛明显出现“发汗”现象,饮水量增加,尿液量,粪便含水量均减少(P<0.05或P<0.01)。根据解热效果选择SK 10 mg·kg-1初步评估对BHS小鼠的药效,表2显示SK组小鼠活动量较BHS模型组减少,口唇色淡,“发汗”现象出现减少,饮水量量显著减少,尿量增加,粪便含水量显著增加(P<0.05或P<0.01),说明SK对BHS小鼠的血热证有改善作用。

表2 血热证诊断标准打分标准记录表
2.1.5 SK对BHS小鼠凝血指标的影响
相对于空白对照组,BHS组APTT时间显著延长,FIB含量显著升高(P<0.01),PT显著延长,TT时间显著缩短(P<0.05),总凝血时间显著延长(P<0.01);与BHS组比较,SK显著缩短APTT和PT(P<0.05),降低FIB含量(P<0.01),SK组TT有延长趋势,无显著性,但其凝血时间显著缩短(P<0.01);阿司匹林与SK作用都对TT时间没有显著影响(表3)。

表3 SK对BHS小鼠凝血功能的影响
2.1.6SK降低BHS小鼠体温,减少自主活动次数
由于DNP引起小鼠核心体温快速上升,使其中枢神经系统交感神经高度兴奋产生一系列行为表现,本实验以SK对BHS小鼠的核心体温和自主活动次数的影响评估其解热带来的镇静作用。根据实验3.3的结果,考虑到LD50效应,因此后续实验将降低SK给药浓度,调整为4 mg·kg-1,8 mg·kg-1,16 mg·kg-1。如图4 b结果显示与BHS小鼠自主活动次数相比,SK组(4 mg·kg-1,8 mg·kg-1,16 mg·kg-1)显著减少小鼠的自主活动次数(P<0.01),而阿普唑仑组虽显著减少了BHS小鼠的活动次数,但对其体温并没有降低的效果。
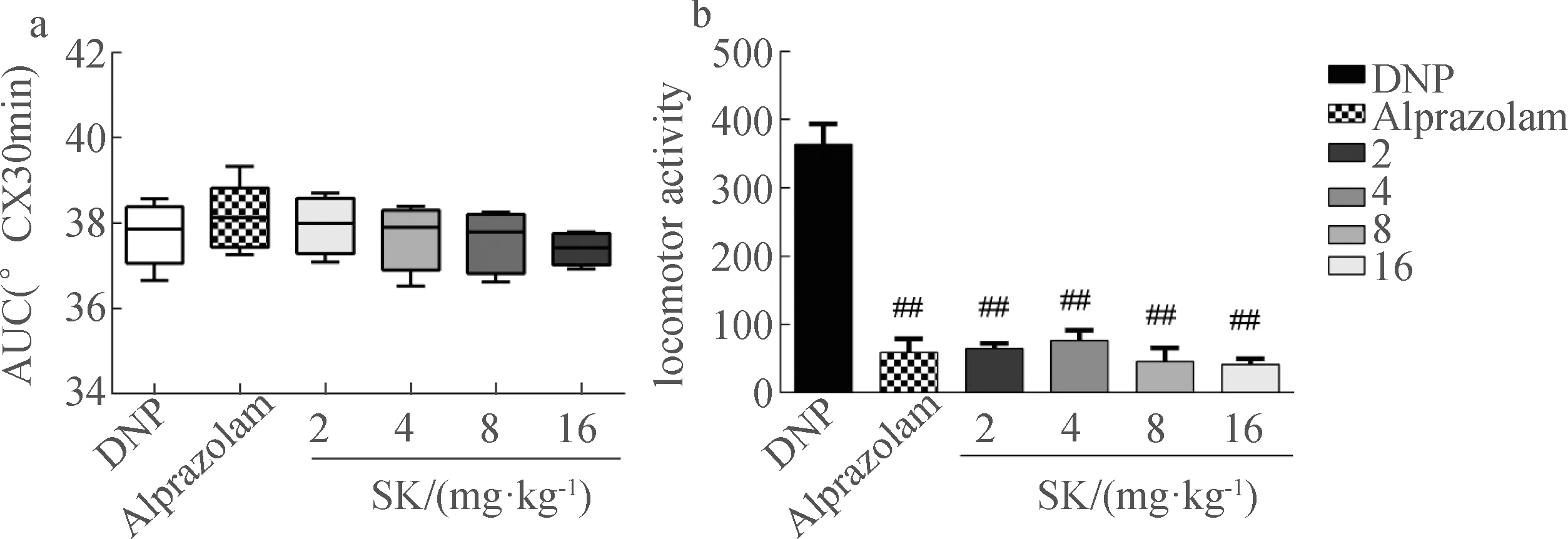
DNP:BHS模型组,Alprazolam:阿普唑仑组;#P<0.05,##P<0.01,SK组vs BHS组,图4 SK对BHS小鼠体温和自主活动次数的影响
2.2 SK对戊巴比妥钠诱导的睡眠时间有协同作用
如图5b所示,与空白组对比,SK能明显延长戊巴比妥钠诱导的小鼠睡眠时间,但并没有缩短睡眠潜伏期(图5a),且SK(16 mg·kg-1)在对延长戊巴比妥钠小鼠睡眠时间的作用上强于阿普唑仑(P<0.01)。对于BHS小鼠,与空白组对比,SK(4、8、16 mg·kg-1)显著延长戊巴比妥钠诱导的小鼠睡眠时间(P<0.01)。
此外,图5c及图5d显示了SK对正常小鼠的镇静效果强于BHS小鼠,其中第一列为正常小鼠,第二列为BHS模型小鼠。


#P<0.05,##P<0.01,SK组vs BHS组图5 SK对戊巴比妥钠诱导的睡眠作用的影响
2.3 旷场实验显示SK减少BHS模型小鼠的运动总距离及运动速度
为增加SK镇静作用的客观证据,分析记录了SK对BHS小鼠旷场实验中的自主活动情况。图6a及图6b显示相同时间内SK(4、8、16 mg·kg-1)明显减少了BHS小鼠的运动总距离,SK(8、16 mg·kg-1)有效减少了BHS小鼠的运动平均速度,运动轨迹显示其药效弱于阿普唑仑(图6c)。

a:运动总距离b:运动平均速度 c:运动轨迹,#P<0.05,##P<0.01,SK组vs BHS 组图6 SK对BHS小鼠的运动总距离及运动速度的影响
3 讨论
中医以“热者寒之”的原则使用清热药治疗热证,根据清热方剂用药规律及新疆软紫草清热凉血的用药基础[7],本文基于网络药理学集合TCMSP等多个数据库[9-10]和文献挖掘获得105个新疆软紫草化学成分,通过ADME性质[11]综合Caco-2以及CYP450代谢酶打分筛选出排名前20的化合物,其中萘醌类SK(R型)与阿卡宁(S型)为主要成药分子,目前研究发现SK类化合物比阿卡宁含量高,是紫草的主要药效成分。紫草入心、肝经,肝藏血,故清热凉血,心主神,可清热醒神,现代研究表明SK为脂溶性分子,半衰期为8.79 h,分布容积为8.91 L·kg-1,能透过血脑屏障对脑损伤[17]和中枢神经有保护作用[18-19]。
研究表明SK可治疗多种血液系统疾病如白血病、败血症等[20],并具有促进血管内凝血、减少出血量的作用[8],能抑制神经元凋亡和其他物质对神经元的毒性[21],减少外周或脂多糖刺激神经胶质细胞PGE2的产生[22]。从紫草活性成分-靶点网络及KEGG富集分析来看,TNF,IL-6,NOS,PTGER3,PTGFR等靶点与合成前列腺素PGE2有关,多数靶点如OPRM1,OPRK1,ADRA2A,DRD1,GBRAG2等均富集在神经配体-受体关系通路,EGFR,MAOA,NOS2和NQO1分布在血液循环系统,分别对应紫草抗炎,神经保护及止血等作用,说明紫草凉血安神作用的可能机制,其他为癌症、药物代谢,免疫性疾病等相关通路,也从另一方面表明紫草可能对多种疾病引起的发热过程均有治疗作用,启示了紫草可作用于多靶点、多环节生物学过程的清热作用。
“血热证”以血液妄行,发热,甚者神昏为主要临床表现,神昏为发热引起的中枢神经兴奋。本文在Yuka Sato等人研究DNP诱导核心温度升高影响肾脏损伤以及本课题组成功建立血热证模型小鼠的基础上[8,23],发现DNP可在短时间发热,现象明显,操作简单方便,符合中医血热证中“热邪入血,血热妄行,发热神昏”的特点及现代临床中热休克等临床表现,因此本文基于BHS小鼠模型探究了SK的中枢解热镇静作用。实验结果指出SK改善了血热证的“发汗”,饮水量增加,尿液量,粪便含水量减少等现象及凝血系统等指标,显著缩短了凝血时间,降低了BHS小鼠的体温及活动量,并对戊巴比妥钠诱导的睡眠作用有协同作用,同时旷场显示SK对BHS小鼠焦虑行为有抑制作用,表明SK有效抑制了“热邪入血,迫血妄行搅乱神明,即血热引起脑血流量增加,使交感神经兴奋”的过程,因此紫草“清热凉血”不仅体现在对血液系统选择[24],还体现在对中枢神经系统的抑制作用。
综上所述,本文从中医“热扰心神”的角度出发,基于紫草“清热凉血”功效使用血热证小鼠模型评价了SK对于由具体热带来的抽象热的抑制作用,实验结果表明SK有效解热剂量远小于阿司匹林,较高剂量的SK镇静作用强度强于阿普唑仑。通过MCODE分析和药靶互作首次发现SK的中枢抑制作用与GABA突触后抑制及阿片受体激活有关,同时发现SK对发热以及中枢兴奋的抑制作用可能与脑内神经递质的传递与代谢相关,PTGES也可作为解热药物研究的新靶点,体现了新疆软紫草活性分子SK相对于西药疗效单一多靶点作用机制的优势。但针对本文中与中枢抑制相关的靶点和具体机制仍需进一步的研究,并且实验中发现高剂量的SK存在一定的毒性作用,提示临床应用SK及紫草相关制剂时需注意浓度。

