高氮磷比与酸化共同作用对微小亚历山大藻生长和产毒的影响
郝 爽 , 刘丽君 陈军辉, 何秀平, 连子如
(1. 山东大学 海洋学院, 山东 威海 264209; 2. 自然资源部第一海洋研究所, 自然资源部海洋生态环境科学与技术重点实验室, 山东 青岛 266061)
近年来, 人类活动导致大气中CO2含量迅速上升,从工业革命开始时的280 ppm 增至当今的411 ppm[1]。大气中CO2含量上升不仅会造成气候变暖, 还会导致海洋中溶解CO2含量增加和海水pH 值降低。目前,表层海水的平均pH 值约为8.10[2], 预计到2100 年将下降至7.8 或7.7, 到2300 年将下降至7.4~7.6, 将对海洋生态系统造成严重影响[3]。富营养化是一种由于水体中氮和磷含量、相对比例或化学形态发生变化而导致水体中生产力, 尤其是有机质不断增加的过程[4], 是水质退化的主要原因之一, 对世界上许多水生态系统造成重大破坏[5], 还会对人类健康和社会经济发展构成威胁[6]。藻类作为最重要的初级生产者之一, 是海洋食物网的基础, 海水酸化和富营养化引起的海水环境变化势必也会影响到海洋藻类的生理机能。
随着全球气候问题的加剧, 海洋产毒藻在全球海域的分布范围越来越大[7-8], 尤其是麻痹性贝毒(PST)毒素产毒藻[9-10]。海洋环境中能够产生PST 的微藻主要有微小亚历山大藻、链状亚历山大藻[11-12]、链状裸甲藻[13]和巴哈马梨甲藻[14]等, 这些产毒甲藻在全球近岸海域广泛分布, 严重威胁近海养殖环境安全。其中, 文献报道我国多起PST 中毒事件是由亚历山大藻属和裸甲藻属的部分有毒藻种造成的[15-16]。
氮、磷作为产毒藻进行生理活动必需的营养元素[3], 在富营养化的产生和赤潮的暴发中起着重要的驱动作用。有研究表明, 亚历山大藻细胞的毒性可能同时受到N 和P 浓度的影响, 并且随着N/P 的变化而变化[17]。从PST 的化学结构式可以看出, N 元素含量约占PST 分子的30%, N 元素与亚历山大藻产毒有着十分密切的联系。关于酸化研究, 在室内培养实验中, 最初用化学方法调控培养液的pH 值, 使用强酸模拟酸化环境, 探究pH 变化对水生生物的影响。如用盐酸调节pH 对云纹石斑鱼胚胎发育和仔鱼活力以及文蛤的呼吸与排泄进行研究[18-19], 王越等[20]通过用盐酸探究了pH 对米氏凯伦藻生理代谢的影响。然而, 有毒甲藻在强酸调节的酸化海水中产毒响应的相关研究目前鲜有报道。目前在产毒藻对环境因子的响应方面的研究多是针对温度、盐度、海水酸化或营养条件等单因素, 而两个及两个以上因素的联合作用对有毒甲藻的影响研究较少, 关于所释放的胞外毒素的浓度、组成等也没有明确报道。那么, 在多种环境因子的联合作用下有毒甲藻产毒的规律是怎样, 胞内外毒素组成、含量是否有明显差异, 这些问题值得深入研究探讨。
基于以上论述, 本工作选取我国近海典型产毒甲藻微小亚历山大藻(A. minutum)作为研究对象, 通过强酸酸化方法, 联合一定条件下的富营养化模式,构建基于氮浓度变化的不同氮磷比条件下的酸化海水环境, 分析测定了胞内外毒素的含量组分以及藻密度、叶绿素含量等相关数据, 初步探讨了在较高氮磷比条件下的酸化海水对A. minutum产毒的影响。
1 材料与方法
1.1 主要仪器与材料
G1969A 型飞行时间质谱仪和1200 型高效液相色谱仪(美国Agilent 公司); ZIC-HILIC 色谱柱(德国MERCK 公司); GTX1、GTX2、GTX3、GTX4 标准品(NRC-IMB), 用0.1 mol/L 乙酸溶液稀释后浓度分别为497 µg/L、903 µg/L、343 µg/L、162 µg/L; 产毒微小亚历山大藻分离自台湾海峡, 株号AM-1。
1.2 藻的培养与收集
取天然海水, 经0.22 μm 滤膜过滤后高温高压灭菌, 冷却至室温。以NaNO3作为氮源, NaH2PO4作为磷源, 微量元素和维生素的初始浓度按照f/2 培养基配方添加, NaH2PO4初始浓度为9.7±0.3 μmol/L, 通过改变NaNO3浓度改变培养液的氮磷比。向500 mL的锥形瓶中添加300 mL 培养液,A. minutum初始密度为1×103个/mL, 设置明暗比(L︰D)为12 h︰12 h、培养温度20℃、光照强度3 000 lx, 培养过程中定时摇动锥形瓶。每天用1 mol/L 的盐酸和1 mol/L 的NaOH 溶液调控培养液的pH 值。实验设置两个pH值(8.0, 7.5)和两个氮磷比(80︰1, 40︰1)共4 个组合,如表1 所示。
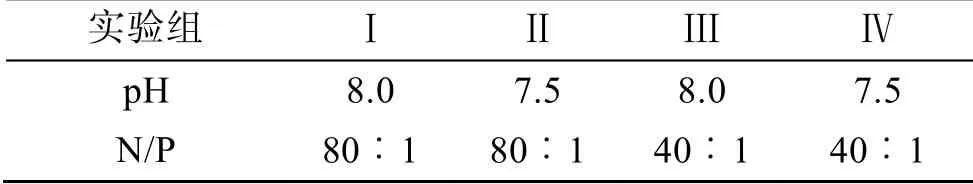
表1 实验组的设置Tab. 1 Setting of the experimental group
培养周期为34 天, 每隔3 天收集3 瓶藻液。从每个锥形瓶的300 mL 藻液中各取1 mL 混匀的培养液, 置于2 mL 离心管中, 加入1 滴Lugol’s 碘液, 用于藻细胞的计数; 各取2 mL 混匀藻液抽滤至直径25 mm 的GF/F 膜上, 用于叶绿素a的测定; 将剩余藻液中藻细胞收集至GF/A 膜上, 实现藻细胞与培养液的分离; 用孔径为0.22 μm 的混合纤维滤膜对培养液进一步过滤。
1.3 测定方法
藻密度、叶绿素a及营养盐(NO3-N、NO2-N、NH4-N 和PO4-P)的测定以及A. minutum胞内胞外PST的提取、富集和仪器检测方法参照文献[21-22]。溶解无机氮(DIN)为NO3-N、NO2-N、NH4-N 浓度之和。
1.4 数据分析
数据采用 SPSS 26.0 的One-way ANOVA 和LSD (Least Significant Difference, 最小显著性差异法)多重比较分析,P<0.05 为差异显著,P<0.01 为差异极显著; 使用 Origin 2018 软件绘图。
2 结果
2.1 对生长的影响
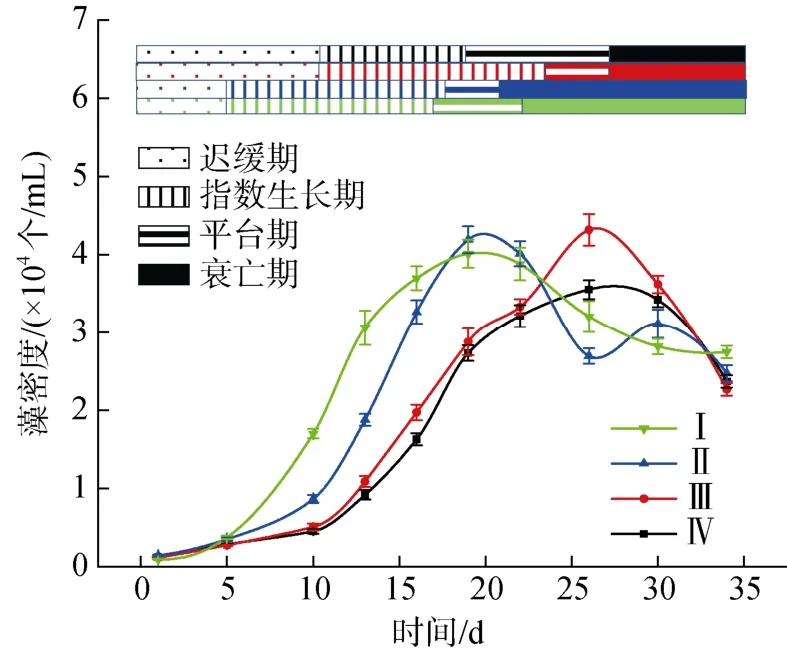
图1 不同氮磷比条件下酸化环境对微小亚历山大藻密度的影响Fig. 1 Effect of acidification on the density of A. minutum under different N/P ratios
不同氮磷比条件下培养液酸化对A. minutum生长状况的影响如图1 所示。各实验组A. minutum生长可分为四个阶段: 迟缓期、指数生长期、平台期和衰亡期。N/P=80︰1 时,A. minutum进入指数生长期和平台期的时间比N/P=40︰1 条件下提前5 天左右, 适当降低培养液的pH 值可以提高A. minutum的最大细胞数。N/P=40︰1 时, pH=8.0 条件下A. minutum的最大细胞数反而显著高于pH=7.5 条件。
2.2 对叶绿素a 的影响
如图2a 所示,A. minutum叶绿素a含量在培养周期中先增加后减少, 与图1 中微小亚历山大藻密度变化趋势基本一致。每个细胞内叶绿素a含量(pg/细胞)的变化情况与单位体积含量(μg/L)在不同实验条件下的相对关系基本一致, 除实验组Ⅳ中每个细胞内叶绿素a含量随生长周期不断减少之外, 其余三组的细胞叶绿素a含量在整个生长周期中变化不大(见图2b)。从表2 可以看出微小亚历山大藻密度与叶绿素a含量成正相关关系, 氮磷比的改变和酸化环境没有改变这种关系。在A. minutum的培养周期中, 叶绿素a含量随培养液pH 值的变化而发生改变:生长初期, 叶绿素a含量随培养液pH 值的降低而降低; 进入指数生长期后, 培养液pH 降低时A. minutum叶绿素a含量增加极为显著 (P<0.01)。
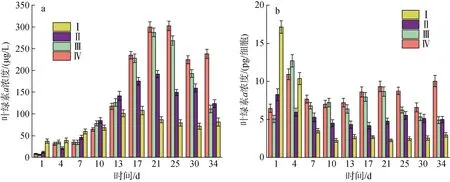
图2 不同氮磷比条件下的酸化环境对微小亚历山大藻叶绿素a 含量的影响Fig. 2 Effect of acidification on the chlorophyll a content of A. minutum under different N/P ratios
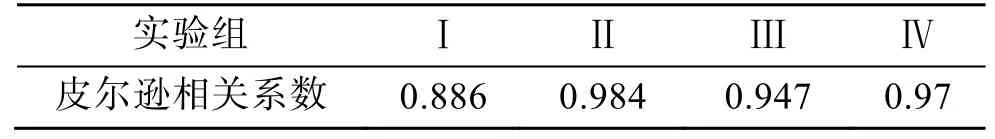
表2 叶绿素a 与藻密度的相关性Tab. 2 Correlation between chlorophyll a and algal density
2.3 对营养盐(DIN 和PO4-P)的测定
培养液中DIN 和PO4-P 浓度变化趋势不同(图3)。不同实验条件下的微小亚历山大藻在前五天快速吸收PO4-P, 四组实验分别吸收培养液中PO4-P 的64.03%(Ⅰ)、52.19%(Ⅱ) 、73.65%(Ⅲ)和62.58%(Ⅳ)。之后培养液中PO4-P 的含量没有明显变化。N/P=80︰1实验组培养周期内DIN 的浓度大致呈现先减少后增加的趋势, 而N/P=40︰1 的两组培养液中DIN 的浓度则随培养时间而减少。其中NO3-N 作为培养基中添加的唯一氮源, 与DIN 的变化趋势基本一致; NH4-N浓度则随着A. minutum的生长呈现波动上升的趋势;NO2-N 占DIN 的比例不足1%, 且对A. minutum的生长影响不大, 在此不予讨论。
2.4 对毒素的影响
为了更直观地比较不同氮磷比条件下的酸化培养液对A. minutum生长和产毒的影响, 根据4 组实验的藻密度曲线选取五个点进行分析: 迟缓期(样品1),指数前期(样品2), 指数后期(样品3), 最大生物量所在的样品(样品4), 衰亡期(样品5)。
2.4.1 对A. minutum 胞内毒素的影响
不同氮磷比条件下酸化培养液对A. minutum单位细胞毒素总量的影响见图4。N/P=40︰1 时, pH 的改变对指数期至衰亡期A. minutum单位细胞总毒素含量的影响并不明显(P>0.05); 而当氮磷比较高(N/P=80︰1)时, 与A. minutum藻细胞生长趋势不同,pH 的降低反而显著降低了A. minutum单位细胞总毒素含量(P<0.01)。相同培养液pH 条件下, N/P=80︰1条件下的A. minutum细胞在衰亡期积累的毒素迅速增加, 含量比N/P=40︰1 条件下高出57.8%(pH=8.0)和42.5%(pH=7.5)。
在不同生长时期A. minutum胞内4 种PST 总量及毒素组成如图5 所示, 可以看出胞内PST 总量随培养时间基本呈现增加的趋势, 尤其在N/P=80︰1 时,毒素含量增加显著。胞内GTX1 和GTX4 随培养时间基本呈现增高的趋势, GTX2 和GTX3 含量变化不大甚至减少。N/P=80︰1 时, 4 种PST 在迟缓期的含量随pH 降低而增加, 而在指数期至衰亡期, 各毒素反而随pH 的降低而降低。N/P=40: 1 条件下, 在pH 降低时各毒素含量除迟缓期外增加了5.04% ~ 62.38%。
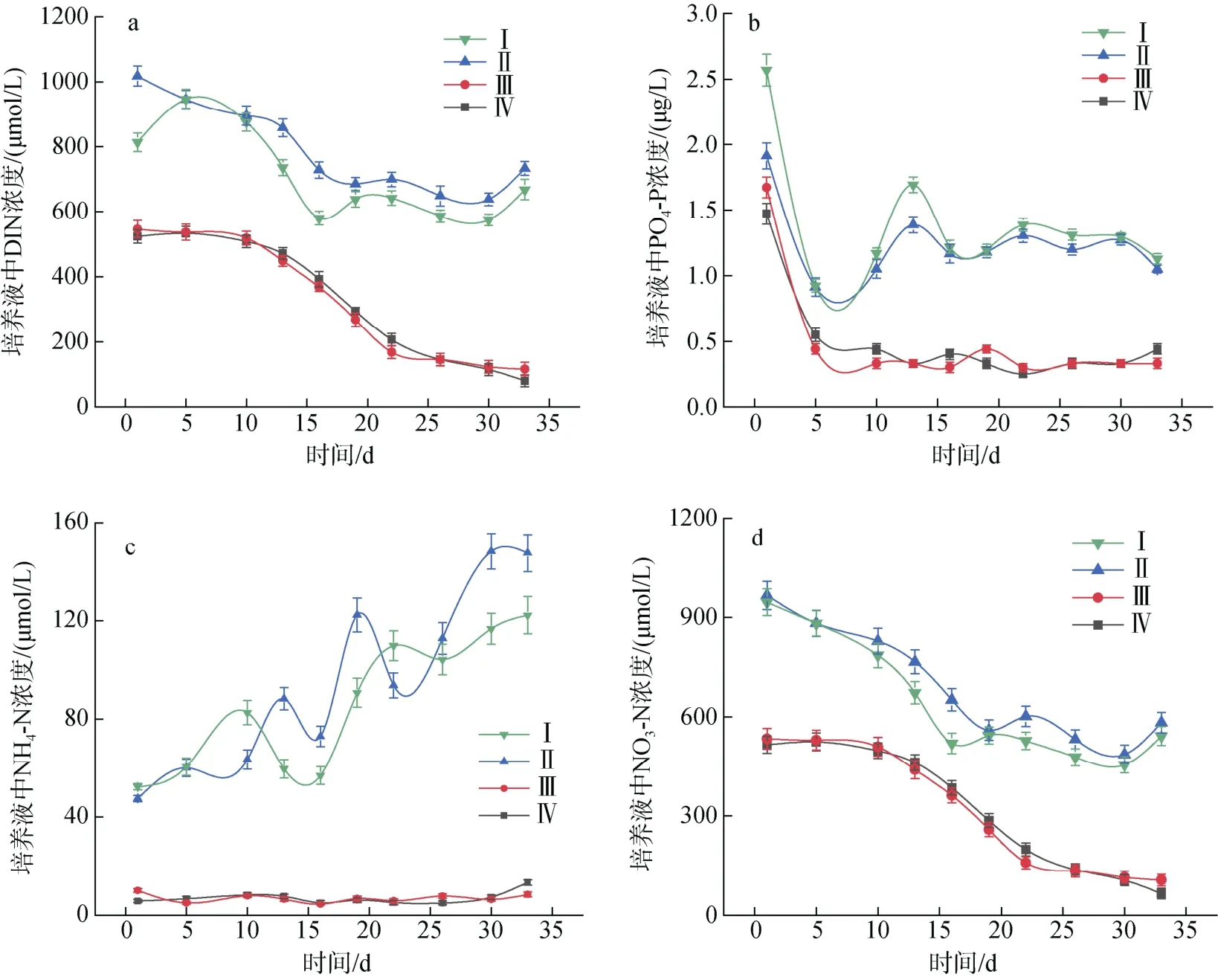
图3 不同氮磷比条件下酸化环境对微小亚历山大藻培养液中营养盐含量的影响Fig. 3 Effects of acidification on nutrient content in A. minutum culture medium under different N/P ratios
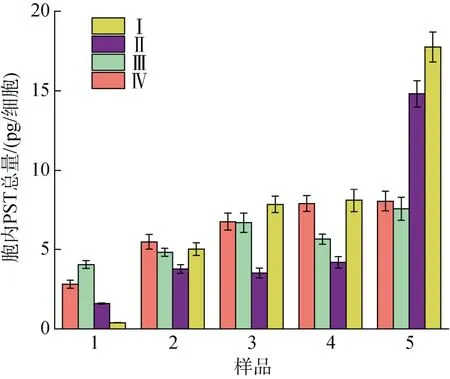
图4 不同氮磷比条件下酸化环境对微小亚历山大藻单位细胞毒素总量的影响Fig. 4 Effect of acidification on the total amount of PST of an A. minutum cell under different N/P ratios
2.4.2 对A. minutum 胞外毒素的影响
不同氮磷比条件下酸化培养液对A. minutum胞外培养液中PST 总量的影响如图6 所示。相同pH条件下, N/P=80︰1 时衰亡期之前胞外培养液的PST含量明显高于 N/P=40︰1 条件, 而到衰亡期时,N/P=40︰1 条件下培养液中PST 迅速增加, 40/7.5 实验组中毒素含量超过80/7.5 实验组。不同氮磷比条件下pH 对衰亡期之前的A. minutum胞外培养液中PST 总量无明显影响, N/P=80︰1 条件下的A. minu-tum到达衰亡期时, pH=8.0 条件下的胞外PST 含量迅速增加, 超过了较低pH 条件下毒素含量71.05%。
在不同生长时期A. minutum胞外培养液中PST含量以及毒素组成如图7 所示(图中数据为三组平行实验结果的平均值), 胞外培养液中PST 总量随培养时间均呈现增加的趋势。氮磷比较高(N/P=80︰1)时,pH 降低并未显著促进PST 总量的增加(P>0.05), 但在衰亡期之前胞外培养液中GTX2 和GTX3 占比随pH 降低而提高, GTX1 和GTX4 与之相反, 在pH=7.5时其浓度较低; N/P=40︰1 时, pH 变化对胞外培养液中PST 的含量及组成无明显影响(P>0.05)。
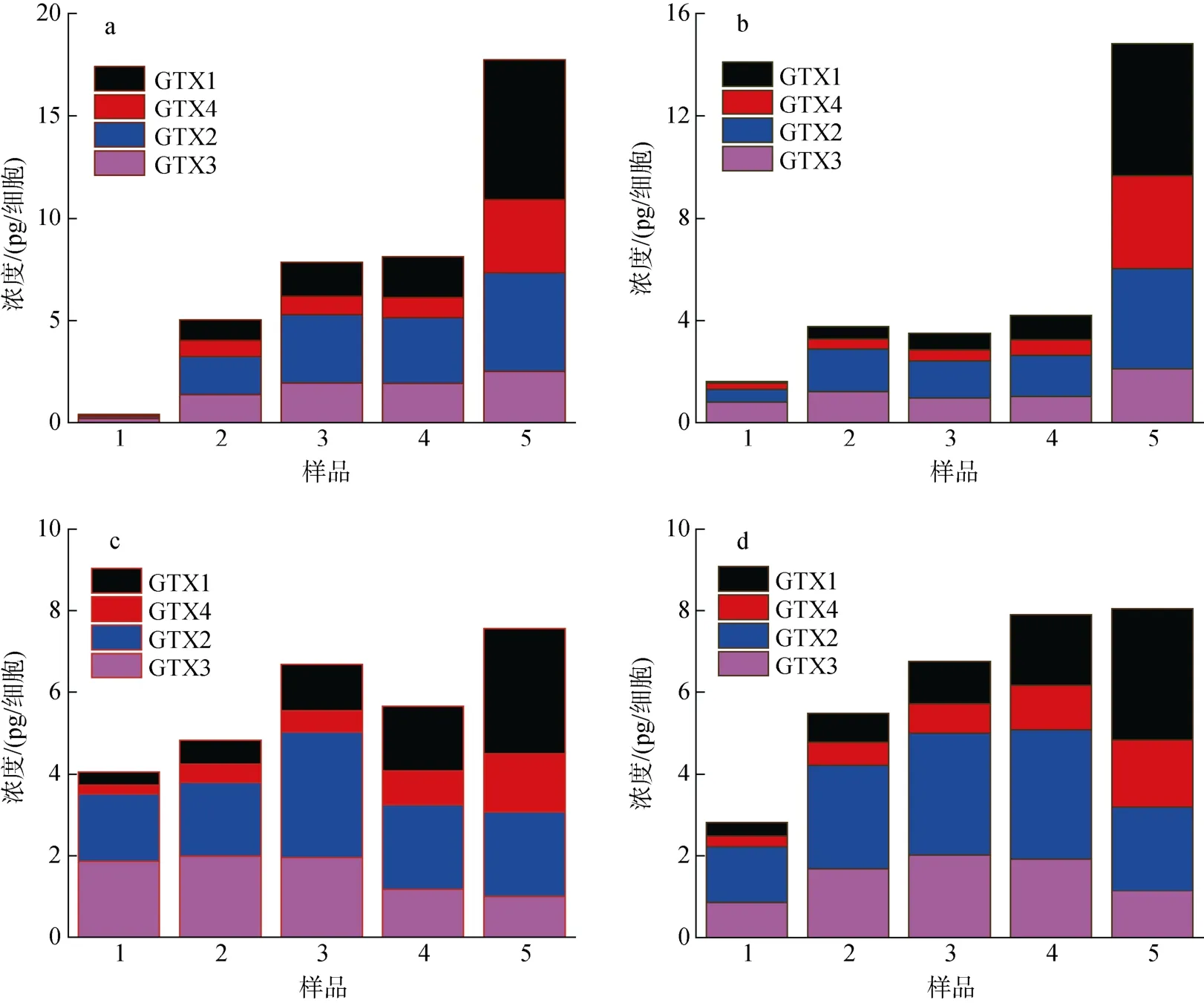
图5 4 组实验微小亚历山大藻胞内PST 总量的变化Fig. 5 Changes in the total amount of intracellular PST in A. minutum in four experimental groups
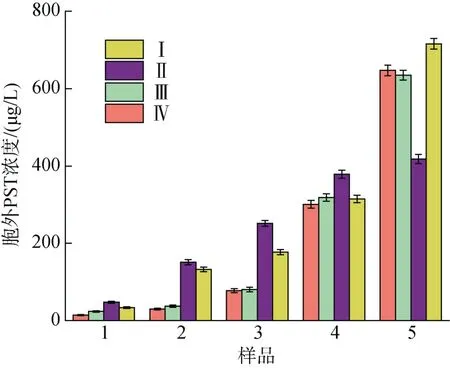
图6 不同氮磷比条件下酸化环境对微小亚历山大藻胞外培养液中总毒素的影响Fig. 6 Effects of acidification on the total amount of extracellular PST in A. minutum under different N/P ratios
2.4.3 对A. minutum胞外毒素与胞内毒素比值的影响
本实验将A. minutum胞外培养液中4 种PST 与胞内进行比较, 得到单位体积中胞外培养液和胞内4 种PST 物质的量(nmol)以及毒素总量(nmol)的平均值的比值(图8、图9)。PST 总量的比值以及GTX1、GTX4、GTX2、GTX3 各自比值的变化规律相似: 衰亡期之前,N/P=80︰1 条件下二者比值高于N/P=40︰1 条件下的比值, 在迟缓期尤为明显(P<0.01), 且迟缓期时随着pH 的降低二者比值减小59.2%。指数生长期胞外与胞内毒素的比值随着pH 的降低而增加。衰亡期时,N/P=40︰1 时的胞外/胞内毒素比值高出N/P=80︰1条件下比值的52.4%。所以, 较高氮磷比条件下, 特别是在迟缓期和指数期, 酸化环境对A. minutum胞外培养液中4 种PST 的含量与胞内的比值会产生影响(P<0.05)。
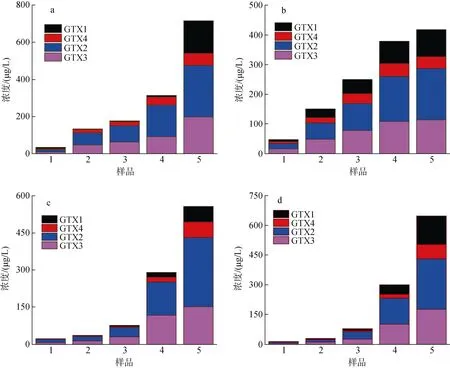
图7 4 组实验微小亚历山大藻胞外培养液中PST 总量的变化Fig. 7 Changes in the total amount of extracellular PST of A. minutum in four experimental groups
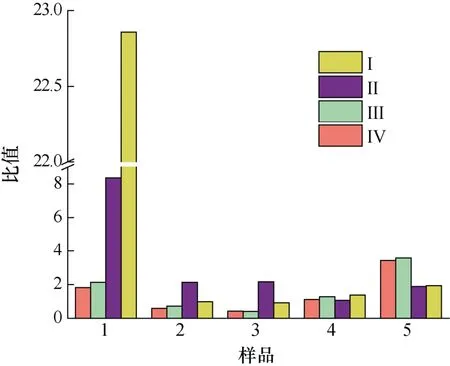
图8 不同氮磷比条件下酸化环境对微小亚历山大藻胞外毒素与胞内毒素总量比值的影响Fig.8 Effects of acidification on the ratio of total extracellular PST to total intracellular PST in A. minutum under different N/P ratios
3 讨论
现有的大多数关于酸化环境对亚历山大藻生长及产毒影响的研究是通过CO2加富进行酸化实验。有研究显示, 由于碳浓缩机制的存在, CO2浓度的在一定范围内升高并不会对亚历山大藻的生长产生明显影响, 但会使与次级代谢产物生物合成、运输和分解代谢以及氨基酸运输相关的下调基因数量增加,从而降低塔玛亚历山大藻株毒素含量[23]。与通过CO2加富模拟酸化环境不同, 本实验采用盐酸来调节培养液的pH, 探究高氮磷比条件下酸化环境对A.minutum生长和产毒的影响。
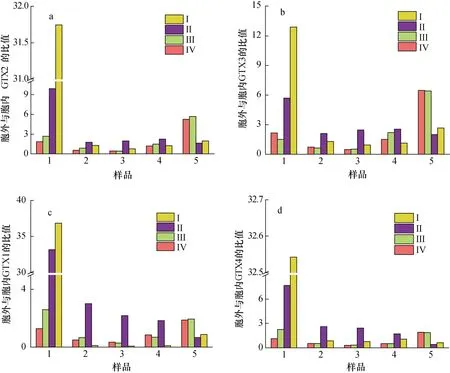
图9 不同氮磷比条件下酸化环境对微小亚历山大藻胞外与胞内不同毒素的比值的影响Fig. 9 Effects of acidification on the ratios of different extracellular to intracellular toxins in A. minutum under different N/P ratios
3.1 对A. minutum 生长的影响
虽然氮是蛋白质和核酸等生命物质的重要组成元素, 但是在本实验中, 氮磷比较高(N/P=80︰1)时并没有对产毒微小亚历山大藻的生长产生促进作用,可能是过量氮在藻体内蓄积转变成有害物质, 从而对藻的生长造成不利影响。但pH 值降低会促进有毒甲藻的生长, 增长速度快且最大生物量高, 进而引发危害程度更高的有毒赤潮。
A. minutum产生的PST 是一种富含氮的生物碱[17],而磷元素是A. minutum遗传物质核酸的重要组成成分之一[24],A. minutum细胞内PST 含量与培养液营养状况密切相关。本研究显示A. minutum在培养的前五天快速吸收培养液中的PO4-P, 对P 采取储存策略;在培养周期的中后段,A. minutum几乎不再从培养液中吸收P; 而A. minutum在整个生长过程中持续消耗氮, 对氮营养盐没有明显的储存策略。当细胞死亡破裂时, 胞内未吸收利用的NO3-N 可能会重新释放到培养液中, 导致培养后期培养液中DIN 升高。N 在生物体内会发生转化, 部分NO3-N 可能在A. minutum中转化成NH4-N, 并随着的藻细胞生长周期被利用或释放。酸化环境下, 氮磷比的升高可能会降低A.minutum的磷储存能力而对藻的氮吸收能力没有明显的影响。
3.2 对A. minutum 产毒的影响
氮磷比增加有利于A. minutum胞内GTX1 和GTX4 的占比的增加, 使A. minutum产生的PST 向毒性更高的化合物转变, 其中衰亡期毒素含量更高。Mohamed 的观点可以解释这一现象: 亚历山大藻进入衰亡期后, 细胞分裂间期延长, 细胞分裂的速度减缓甚至停滞, 而PST 合成酶的编码基因仍持续表达, PST 可持续合成[25], 使得衰亡期的A. minutum胞内PST 高于其他生长时期。衰亡期的A. minutum胞外培养液中PST 总量也比其他生长时期要高, 可能原因有二: (1) 衰亡期微小亚历山大藻胞内PST 含量高于其他生长时期, 所以释放到胞外培养液中的PST 也会更多; (2) 藻细胞进入到衰亡期, 死亡、裂解速度加快,A. minutum胞内的毒素直接进入到培养基质, 导致胞外PST 含量升高。本实验的结果与Lim 的研究结果基本一致, 认为亚历山大藻细胞的毒性随着N/P 的变化而变化, 在不同的N/P 处理下A. minutum的毒素组成相对稳定, 在较高的N/P 条件下培养的藻细胞的毒素含量也比较多[17]。此外Han 还发现, 在高氮条件下的PST 种类更加丰富[26], 这点在本实验中并未体现,可能存在实验藻株之间的差异。
较高氮磷比条件下的酸化环境使胞外培养液中PST 含量比胞内增加的程度高。在指数前期之前,A. minutum胞外培养液中PST 的总量较胞内可高出20 倍以上, 这可能是处于酸化环境中的微小亚历山大藻为了提高在恶劣环境下的生存能力而向环境中释放更多的毒素来提高自身竞争力; 也可能是酸化环境会提高藻细胞内相关酶的含量或活性[27], 进而促进藻细胞的生理代谢以及PST 的合成与释放。综上所述, 在富营养化条件下, 日益严重的酸化情况可能会导致海水中PST 含量与藻胞内的比值显著增加, 严重威胁到海水环境。
4 结论
微小亚历山大藻对氮磷比和pH 的变化较为敏感, 在本实验中, 酸化环境对A. minutum的生长、毒素含量和毒性有一定促进作用, 可以推测日益酸化的海水环境或许在一定程度上会加剧A. minutum引起的有毒赤潮。但也有其他研究表明酸化对亚历山大藻生长和产毒有一定的抑制作用, 可见酸化对亚历山大藻的影响十分复杂。酸化环境如何影响亚历山大藻的生长和产毒?不同酸化模式对亚历山大藻的作用机制是否一致?尚未有明确统一的定论。酸化环境下氮磷比增加并没有促进A. minutum的生长,且降低了其叶绿素a含量和对P 的储存能力, 但几乎没有影响到对硝氮的吸收能力。氮磷比的增加还促进了A. minutum胞内和胞外毒素含量和毒性的增加,这更加增大了A. minutum赤潮产生的环境危害。本研究通过探究无CO2参与的酸化环境和氮加富的共同作用对微小亚历山大藻生长产毒的影响, 以期为酸化和富营养化条件下的微藻产毒提供更多研究基础。

