拟康宁木霉T51菌株发酵液对灰葡萄孢的抑菌活性
尤佳琪 李国庆

摘要 :拟康宁木霉菌株T51是从土壤中分离得到的一株优秀生防菌株,在前期的研究与应用中表现出对番茄灰霉病的良好防效。本文研究了T51菌株的PDB发酵液对灰葡萄孢的抑菌活性,结果表明T51发酵液在0.5%的低浓度下的抑菌率达到52.1%,与高浓度(10%)发酵液的抑菌率(59.7%)没有显著差异。当发酵液浓度下降为0.05%时失去抑菌活性。T51摇培至第5天时的发酵液的抑菌活性稳定。T51发酵液中的抑菌物质对高温不敏感,沸水浴处理10 min后抑菌活性没有明显降低。T51发酵液pH为3.3,呈酸性,当调节pH至7时,发酵液抑菌活性从57.89%下降到46.61%。T51发酵液能够显著抑制灰葡萄孢侵染番茄叶片后产生的病斑大小,接种后叶片病斑直径比对照减小53.9%。
关键词 :拟康宁木霉T51; 灰葡萄孢; 生物防治; 抗真菌活性
中图分类号:
Q 939.92文献标识码: A
DOI: 10.16688/j.zwbh.2019560
Antifungal activity of Trichoderma koningiopsis T51
cultural filtrate against Botrytis cinerea
YOU Jiaqi1, LI Guoqing2*
(1. Horticultural Research Institute, Shanghai Academy of Agricultural Sciences, Shanghai 201106, China;
2. State Key Laboratory of Agricultural Microbiology, Huazhong Agricultural University, Wuhan 430070, China)
Abstract :Trichoderma koningiopsis T51, a promising biological control agent against gray mold caused by Botrytis cinerea, was isolated from soil. The antifungal activity of the cultural filtrates (CF) of isolate T51 in potato dextrose broth (PDB) was determined. The results showed that 0.5% of T51 CF showed high antifungal activity against B.cinerea, with an inhibition percentage of 52.1%, not significantly (P>0.05) different from that in the treatment with 10% CF (59.7%). The T51 CF lost the antifungal activity at the concentration of 0.05%. The antifungal activity of the T51 CF did not continue increase when incubated for more than 5 days. The antifungal metabolites of T51 appeared thermostable, as the CF in the treatment at 100℃ for 10 min still showed antifungal activity. Ambient pH value greatly affected the antifungal activity of the T51 CF: when the pH value of the CF was adjusted from 3.3 to 7.0 with NaOH, the inhibition percentage was decreased from 57.89% to 46.6%. The CF of T51 showed strong inhibition against infection by B.cinerea on tomato leaves, the size of the average leaf lesion was decreased by 53.9% by the T51 CF compared to that in the control.
Key words :Trichoderma koningiopsis T51; Botrytis cinerea; biological control; antifungal activity
灰葡萄孢Botrytis cinerea是一种寄主范围广,传播能力强,侵染快,危害重的植物病原真菌,能够引起1 400多种植物的灰霉病[1]。由于常见栽培作物都缺少对灰霉病的抗性品种,灰霉病的防治主要依赖于大量重复施用农药。但是过度使用化学农药会造成环境污染及农药残留等危害[2],因此,随着人们环保意识提高,迫切地需要新型绿色环保的防治措施,例如生物菌剂以及生物源农药等。除了生物活菌剂外,多种生防菌产生的次级代谢物质对灰葡萄孢有抑制作用,例如芽胞杆菌[3]、链霉菌[4]、黄柄曲霉[5]、木霉[68]、粉红黏帚霉[9]等,一些植物提取物也对灰葡萄孢有显著抑菌效果[10]。
木霉Trichoderma spp.是一类世界分布的土壤习居丝状真菌,因为对多种植物病害有良好的生防潜力而被广泛研究。木霉的生防機制主要包括对病原菌的重寄生和抗生作用、竞争以及对植物的促生和诱导抗性作用。其中抗生作用不仅在木霉活菌的生物防治过程中十分重要,也是生物源杀菌剂的重要来源。木霉能够产生种类繁多的抗生性次级代谢产物,目前从木霉中分离到的抗生性代谢产物已超过180种[11],例如胶霉毒素、木霉毒素等,许多抗生性次级代谢物对植物病原物具有拮抗作用。其中对灰葡萄孢有抗菌活性的木霉次级代谢物种类包括吡喃酮、丁烯酸内酯、蒽醌、单端孢菌素、萜类化合物等[12]。木霉产生的次级代谢物种类和产生量在菌株间差异明显[1314],目前研究较为广泛的产抗生物质的木霉菌株多数是绿色木霉T.viride、绿木霉T.virens、哈茨木霉T.harzianum、康宁木霉T.koningii、里氏木霉T.reesei等[13]。
拟康宁木霉Trichoderma koningiopsis T51是本实验室前期从土壤中分离得到的72个野生木霉菌株之一,通过多指标筛选策略筛选发现,该菌株对番茄灰霉病有高效防治潜力[1416]。前期试验中,该菌株表现出对灰葡萄孢的强重寄生能力以及抑制灰葡萄孢产孢的能力,具有良好的应用推广前景。本文将研究其产生的抗生次级代谢物对灰葡萄孢的抑菌活性。
1 材料与方法
1.1 材料
1.1.1 供试菌株
本研究中拟康宁木霉Trichoderma koningiopsis T51菌株分离自湖北省武汉市油菜田土壤[14],菌株保藏于中国典型培养物保藏中心(CCTCC),编号为M2015729。灰葡萄孢Botrytis cinerea菌株RoseBC3分离自月季灰霉病病株。所有供试真菌均在20%甘油中保存于-80℃下。试验前先将菌株接种在PDA平板上活化至少2代,使其恢复旺盛生长。
1.1.2 培养基
PDA:200 g去皮马铃薯切片加适量水煮熟,用4层纱布过滤后,滤液中加入20 g 葡萄糖,15 g琼脂粉,定容至1 L,灭菌。PDB:200 g去皮马铃薯煮熟过滤,滤液中加入20 g 葡萄糖,定容至1 L后灭菌。
1.2 方法
1.2.1 木霉与灰葡萄孢低温对峙培养试验
在本研究中,使用低温对峙的方法定性检测拟康宁木霉菌株T51对灰葡萄孢菌丝生长的抑制效果。从拟康宁木霉T51和灰葡萄孢RoseBC3的菌落边缘打取直径为5 mm的菌丝块,分别接种在直径9 cm 的PDA平板的两侧,两菌丝块相距7 cm,以不接种T51的培养皿作为对照。将培养皿封口后放在4℃下冷藏培养30 d,观察灰葡萄孢的生长情况。
1.2.2 拟康宁木霉T51发酵液的制备
从培养了48 h的T51菌落边缘打取5 mm菌丝块3个,接种于装有100 mL PDB培养液的三角瓶中。接种后的三角瓶置于25℃,150 r/min,24 h光照下摇培。发酵液过滤方法为:将直径为11 cm的中性滤纸在50℃下烘干后称重,取双层滤纸置于连接抽滤装置的布氏漏斗中,将T51培养液抽滤,收集滤液,检测滤液pH值,然后用0.22 μm的无菌微孔滤膜过滤,收集滤液至无菌的样品瓶中,得到T51的无细胞发酵滤液。滤纸上的菌丝同滤纸一起在50℃下烘干2 d,至完全干燥,称重,计算菌丝干重,用于评估单位菌丝生物量的抑菌活性。
1.2.3 拟康宁木霉T51发酵液对灰葡萄孢菌丝生长的抑制活性测定
将摇培4 d的T51发酵滤液分别按10%、5%、1%、0.5%、0.1%和0.05%的体积比加入到PDA培养基中,制成平板,以添加等量PDB的PDA平板为对照。将灰葡萄孢RoseBC3的新鲜菌丝块(直径5 mm)接种至不同处理平板上,每个平板接种1个菌丝块。将接种后的平板置于20℃光照条件下培养,每24 h测量灰葡萄孢菌落直径,至对照平板长满灰葡萄孢菌落,计算不同处理灰葡萄孢菌丝每日生长速度。根据下面公式计算木霉发酵液对灰葡萄孢菌丝生长速度的抑制率:抑菌率=(RCK-RT51)/RCK×100%(RCK为对照平板上灰葡萄孢菌丝生长速度,RT51为添加了T51发酵液的平板上灰葡萄孢菌丝生长速度)。
1.2.4 发酵液抑菌活性物质热稳定性测定
为了检测抗菌物质热稳定性,取T51摇培4 d的发酵滤液于玻璃试管中,在沸水浴中处理10 min,自然冷却,然后按1%和5%的比例添加到PDA平板中,接种RoseBC3,测定抑菌率。
1.2.5 发酵液抑菌活性对pH敏感度测定
用1 mol/L NaOH溶液将摇培4 d的发酵液的pH调节至中性,再按5%的比例添加到PDA平板中,在平板上接种灰葡萄孢菌丝块,在20℃下培养,测定抑菌率。上述所有试验处理均设3次重复,整个试验共进行3次。
1.2.6 离体叶片上T51发酵液对灰葡萄孢侵染的抑制作用
将100 mL T51发酵液低温冻干至恒重,然后加入10 mL无菌水重新溶解,用滤纸过滤。摘取健康且大小一致的新鲜番茄叶片(品种为‘番茄大王合作903,约60 d苗龄),洗净晾干。用无菌棉签蘸取上述T51发酵液在叶片上均匀涂布,以涂无菌水的叶片作为对照,处理和对照各涂6个叶片,将叶片放在超净工作台中吹干表面水分。从新鲜的灰葡萄孢RoseBC3菌落边缘打取直径5 mm的菌丝块,接种于叶片中央,菌丝面接触叶片。将接种后的番茄叶片在20℃下保湿培养3 d,测量灰霉病病斑直径。
2 结果与分析
2.1 拟康宁木霉T51对灰葡萄孢菌丝生长的抑制效果
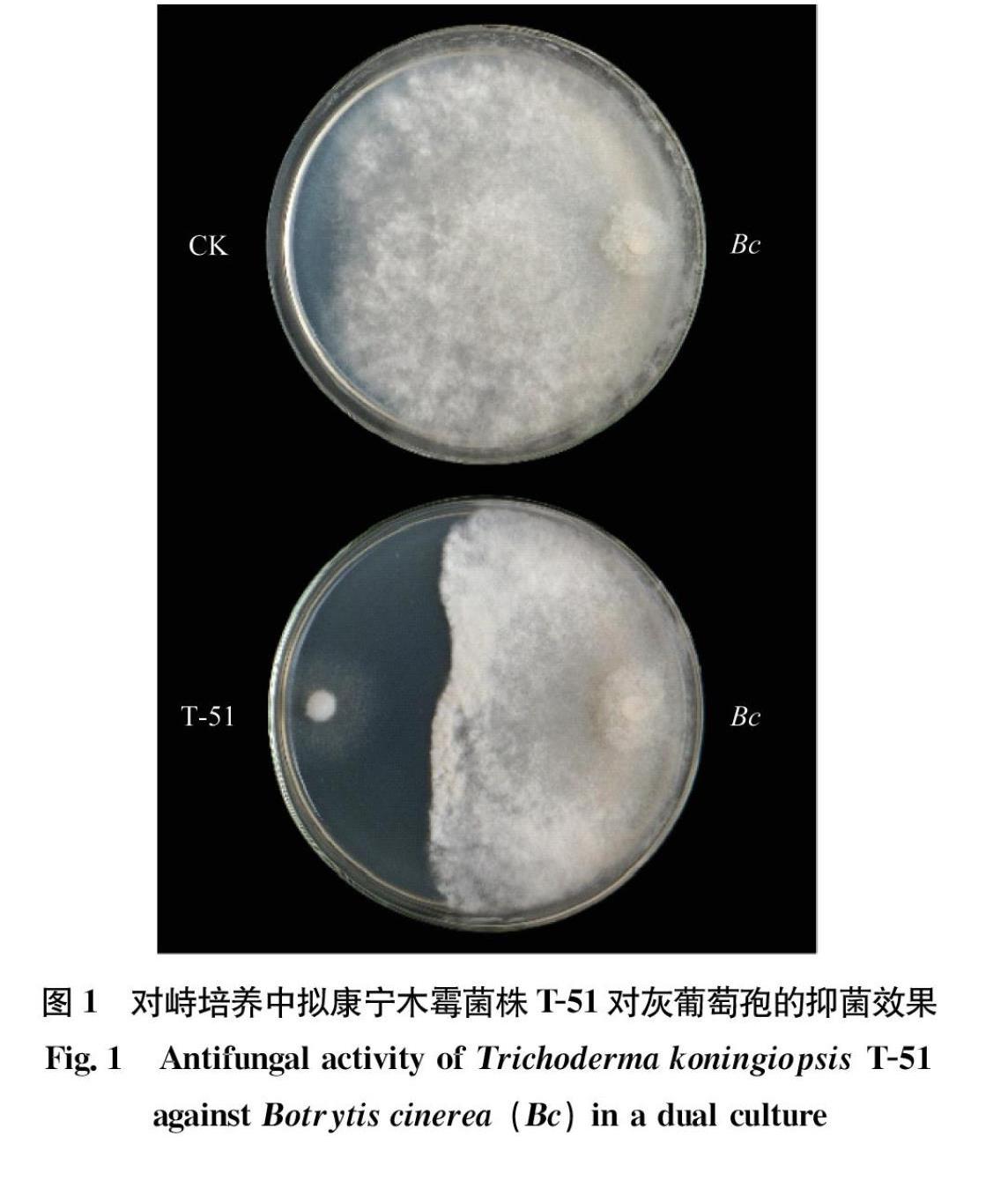
低温(4℃)对峙培养中,T51菌丝生长极慢,培养30 d时,菌落半径仅为1.1 cm。灰葡萄孢菌株RoseBC3在低温下生长也较慢,30 d时,对照灰葡萄孢菌落半径为8.3 cm(图1)。然而在T51与RoseBC3对峙培养中,RoseBC3菌丝生长受到明显抑制,菌落半径仅为4.7 cm,且在两菌落中间出现明显透明区域,宽度为1.2 cm(图1)。
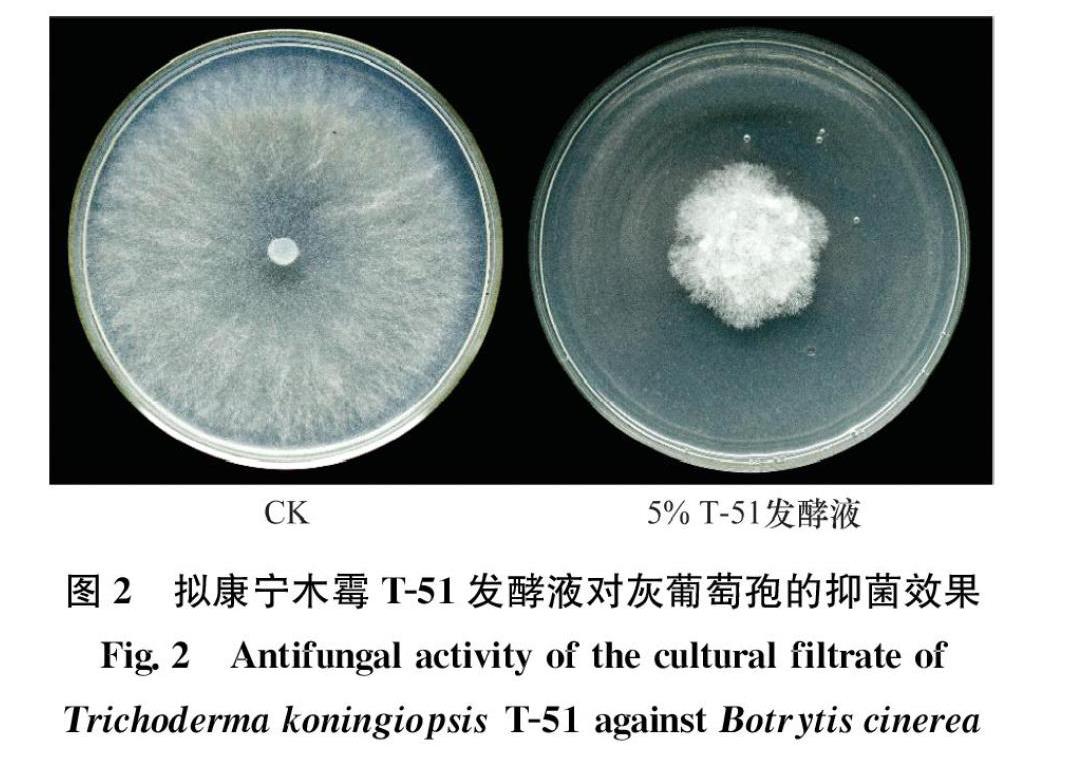
T51的PDB发酵液对灰葡萄孢菌丝生长也有明显的抑制效果(图2),在对照PDA中培养3 d,灰葡萄孢菌落直径为(8.8±0.2)cm,将T51摇培4 d后,取摇培滤液按5%的比例(V/V)添加到PDA中,灰葡萄孢菌丝生长受到明顯抑制,菌落直径仅为(3.5±0.1)cm(图2)。
2.2 不同浓度拟康宁木霉T51发酵液的抑菌活性
研究结果表明,10%、5%、1%以及0.5%的T51发酵液对灰葡萄孢菌丝生长的抑制率分别为 59.7%、57.9%、51.0%、52.1%,根据多重比较分析,发酵液浓度从10% 下降到0.5%时,抑菌活性没有显著差异(P>0.05),这表明T51产生的抗真菌物质活性较高,并且抑菌效果稳定。当发酵液浓度降低到0.1%时,抑菌效果显著下降至41.3%,并且处理间误差较大,表明该浓度下,抑菌效果不稳定。当发酵液浓度降至0.05%时,抑菌活性完全消失,对灰葡萄孢生长反而出现了9.1%的促进作用(图3)。
2.3 拟康宁木霉T51发酵液抑菌活性的时间动态
随着培养时间延长,T51菌丝生物量逐渐上升,尤其是第5天到第9天,每瓶菌丝干重从450 mg增加到757 mg(图4)。发酵液的pH在第3天到第5天略有下降,在第5天到第9天一直维持在3.2~3.4之间,发酵液保持稳定酸性。
从第3天到第5天T51发酵液的抑菌活性明显上升(图4),从第5天到第9天,发酵液的抑菌活性基本稳定。其中,在摇培第5天、第7天和第9天,1%发酵液的抑菌率分别为58.7%、57.5%、60.25%,5%发酵液的抑菌率分别为65.7%、64.5%、68.4%(图4)。这表明尽管在培养5 d以后,菌丝生物量还在继续增加,抑菌物质的活性已经到达稳定值。
2.4 拟康宁木霉T51发酵液中抗真菌物质的热稳定性
T51发酵液的抗真菌活性有一定的耐高温性,热处理(沸水浴)10 min后,发酵液对灰葡萄孢菌丝生长的抑制率与未处理发酵液没有显著差异(P>0.05)(图5),其中1%和5%的发酵原液抑菌活性为50.94%和57.96%,热处理后的1%和5%发酵液抑菌活性分别为48.46%和58.21%。
2.5 pH对拟康宁木霉T51发酵液抗真菌活性的影响
PDB培养基自然pH为6~7,经过T51发酵后,发酵液pH下降至3.3,呈酸性。发酵液用NaOH调节pH至7.0 后,5%的中性发酵液与同等浓度的酸性发酵液相比抑菌率从57.9%下降到46.6%,显著降低(P <0.05),但并没有完全丧失活性(图6)。这表明酸性环境有助于木霉T51发挥抗真菌活性。
2.6 离体叶片上T51发酵液抑制灰霉病的效果
将番茄叶片上先涂布T51发酵液后,再接种灰葡萄孢菌丝块,叶片上的病斑显著小于清水对照,清水对照的病斑直径为2.78 cm,而用T51发酵液处理后,病斑直径仅为1.28 cm,比对照减少了53.9%,这表明T51发酵液有潜力降低番茄叶片上灰霉病的严重度。
3 结论与讨论
产生各类抗生次级代谢物质是木霉的一种重要的生防机制,抗生物质能够分泌到胞外,对病原菌生长产生抑制,不仅是木霉对病原菌重寄生过程中的重要辅助机制,还能在生防菌和病原菌未发生物理接触时使木霉依然能够达到生防的效果。一些次级代谢物还充当生防菌在诱导植物抗性过程中的信号分子[17]。从木霉中分离提取的抗真菌物质也可以直接作为生物农药施用。拟康宁木霉T51是本实验室前期筛选获得的一株高效生防菌株,在20℃常温下对峙培养时对灰葡萄孢有非常强的重寄生能力,而本研究发现,在4℃低温下对峙培养时T51生长缓慢,难以发挥重寄生灰葡萄孢的效果,但是在两菌的菌落之间形成了宽达1.2 cm的抑菌带,这表明T51可以产生胞外分泌的抗真菌物质,抑制灰葡萄孢的生长。番茄叶片接种试验也验证了这一结果, T51无菌发酵液能够有效抑制灰葡萄孢在番茄叶片上扩展,这表明T51的发酵液具有良好的灰霉病防治应用潜力。
木霉能够产生种类丰富的次级代谢产物,主要包括聚酮类(polyketides)、氨基酸及其衍生物(amino acid and derivatives)、类固醇类(steroids)、萜烯类(terpenes)等,其中许多挥发性和非挥发性物质有抗真菌活性[18]。本研究发现,拟康宁木霉T51发酵液在低浓度下依然保持对灰葡萄孢很强的抑制效果,0.5%发酵液对灰葡萄孢生长可以达到50%以上的抑制率,与高浓度(10%)抑制率无显著差异。拟康宁木霉T51发酵液在浓度为0.1%时尽管依然有抗真菌活性,但结果显示数据误差较大,表明在此浓度下,抗真菌物质对灰葡萄孢菌丝的抑制活性稳定性下降,因此生产应用的临界浓度阈值应该在发酵液浓度0.1%~0.5%之间。浓度0.05%的发酵液失去了抗真菌活性,反而对灰葡萄孢菌丝生长表现出一定促进作用。
本文检测了摇培时间对发酵液抑菌率的影响,发现T51摇培到第5~9天时,菌丝干重依然在增加,但发酵液的抑菌活性不再增强,这表明在未来的发酵生产应用中,发酵5 d是最佳时间,能够节省时间和成本,提高生产效率。
研究结果表明,T51产生的对灰葡萄孢有抑菌效果的物质对热不敏感,这表明该物质成分可能不是蛋白质或者活性不稳定的化学物质。在本试验中,长期冷藏保存(超過2个月)的T51发酵液的抑菌活性没有下降,这表明该物质状态稳定,不易分解,具有良好的商品开发价值。T51的发酵液从酸性调节到中性后,对灰葡萄孢的抑菌效果略有下降,但并没有完全丧失,这表明酸性条件能够帮助其发挥抑菌作用,也意味着其发酵液中可能存在多种抗生活性物质。拟康宁木霉T51不仅活菌剂在田间有良好的生物防治效果,其无细胞发酵液也对灰葡萄孢有较强的抑制效果,是一株高效的生物防治木霉菌,应进一步对T51发酵液的抑菌成分进行提取分析,优化T51发酵方式,并对其抑菌机制进行深入研究,本研究的结果对T51抗真菌物质在发酵生产上应用提供了理论基础。
参考文献
[1] ELAD Y. Plant hosts of Botrytis spp., Botrytis—the fungus, the pathogen and its management in agricultural systems [M].Cham: Springer International Publishing, 2016: 413486.
[2] RABOLLE M, SPLIID N H, KRISTENSEN K, et al. Determination of fungicide residues in fieldgrown strawberries following different fungicide strategies against gray mold (Botrytis cinerea) [J]. Journal of Agricultural and Food Chemistry, 2006, 54(3): 900908.
[3] 潘虹余, 金玮鋆, 张晓蒙, 等. 解淀粉芽孢杆菌B15抑菌物质对葡萄灰霉病灰葡萄孢的抑菌机理[J]. 微生物学报, 2018, 58(7): 12451254.
[4] 吕昂. 链霉菌310抗真菌代谢产物鉴定及防病潜力评估 [D].武汉:华中农业大学, 2017.
[5] ZHANG Qinghua, ZHANG Jing, YANG Long, et al. Diversity and biocontrol potential of endophytic fungi in Brassica napus [J]. Biological Control, 2014, 72: 98108.
[6] 吉海龙, 伊洪伟, 池玉杰. 长枝木霉菌株T05发酵液抑菌力参数筛选[J]. 东北林业大学学报, 2016, 44(1): 120124.
[7] 王勇, 王万立, 刘春艳, 等. 绿色木霉Tr9701对多种病原菌的抑制作用及其抑病机理[J]. 中国农学通报, 2008, 24(1): 371374.
[8] 王国平, 鲁书玲, 郑必强, 等. 紫杉木霉ZJUF0986代谢产物及其对番茄灰霉病的抑制作用[J]. 浙江农业学报, 2008, 20(2): 104108.
[9] 杨蕊, 赵瑞丽, 郎剑锋, 等. 粉红黏帚霉W21对灰葡萄孢的抑菌活性[J]. 河南科技学院学报(自然科学版), 2017, 45(5): 3236.
[10]刘兴龙, 李新民, 刘春来, 等. 8种植物提取物对番茄灰霉病菌抑菌活性的研究[J]. 黑龙江农业科学, 2009(3): 7475.
[11]李纪顺, 陈凯, 杨合同, 等. 木霉抗生性代谢产物研究进展[J]. 农药, 2010(10): 713716.
[12]REINO J L, GUERRERO R F, HERN NDEZGAL N R, et al. Secondary metabolites from species of the biocontrol agent Trichoderma [J]. Phytochemistry Reviews, 2007, 7(1): 89123.
[13]YOU Jiaqi, ZHANG Jing, WU Mingde, et al. Multiple criteriabased screening of Trichoderma isolates for biological control of Botrytis cinerea on tomato [J]. Biological Control, 2016, 101: 3138.
[14]MUKHERJEE P K, HORWITZ B A, HERRERAESTRELLA A, et al. Trichoderma research in the genome era [J]. Annual Review of Phytopathology, 2013, 51: 105129.
[15]王强强,窦恺, 陈捷, 等. 拮抗性木霉菌株抗逆性筛选评价標准与方法[J]. 中国生物防治学报, 2019, 35(1): 99111.
[16]尤佳琪, 李国庆. 拟康宁木霉T51几丁质酶活性及内切几丁质酶基因克隆与分析[J]. 植物保护, 2017, 43(4): 2127.
[17]KOTTB M, GIGOLASHVILI T, GROKINSKY D K, et al. Trichoderma volatiles effecting Arabidopsis: From inhibition to protection against phytopathogenic fungi [J/OL]. Frontiers in Microbiology, 2015, 6: 995.DOI:10.3389/fmicb.2015.00995.
[18]SIVASITHAMPARAM K, GHISALBERTI E. Secondary metabolism in Trichoderma [M]∥KUBICEK C P, HARMAN G E. Trichoderma and Gliocladium. London: Taylor and Francis, 1998: 139191.
(责任编辑:田 喆)

