新型冠状病毒肺炎患者肺泡灌洗液细胞蜡块制作体会
张 亮,马志园,李 慢,周新刚,陈佳敏,王 鹏
新型冠状病毒肺炎(coronavirus disease 2019, COVID-19)是2019年新出现的急性呼吸道传染病,临床表现轻重不一。新型冠状病毒(severe acute respiratory syndrome coronavirus 2, SARS-CoV-2)传染性极强,人群普遍易感[1]。目前,我国已将该病纳入中华人民共和国传染病防治法规定的乙类传染病,因其具有较强的传染性,故采取甲类传染病的预防和控制措施。对于重症的COVID-19患者,支气管镜技术可以清除痰液、改善通气、纠正缺氧,还可以获取肺泡灌洗液(bronchoalveolar lavagr fluid, BALF),进行细胞病理学分析,明确有无特殊感染,为临床治疗提供重要依据[2]。但是BALF的细胞学涂片常因细胞形态结构不典型、细胞蜕变以及不能进行免疫组化检测等导致诊断的局限性。通过制作细胞蜡块、完善特殊染色及免疫组化检测可使病理诊断更精准化。但是COVID-19患者的BALF具有较强的传染性,需要在标本转运及制作过程中采取科学、严谨的防护措施。本实验对原有标本的转运及细胞蜡块制作方法进行优化,避免发生实验室人员感染,保障COVID-19患者细胞蜡块制作的安全完成。
1 材料与方法
1.1 材料
1.1.1标本来源 2020年2~5月首都医科大学附属北京地坛医院重症监护病房收治的14例COVID-19患者BALF标本。
1.1.2主要试剂 10%中性福尔马林、HE染液购自北京益利公司,AB-PAS染液购自广州安必平公司,CK、二抗显色系统购自Leica公司。
1.1.3主要仪器 Thermo Excelsior ES 脱水机,Leica ST5020染色机,Leica Bond全自动免疫组化染色机。
1.2 方法
1.2.1防护方法 一级防护,穿工作服、工作鞋,戴医用帽子、外科口罩、乳胶手套;二级防护,穿工作服、隔离衣、鞋套、戴N95口罩、乳胶手套、医用帽子;三级防护,在二级防护的基础上穿连体防护服,佩戴护目镜或面罩。
1.2.2标本采集 检查人员参照三级防护标准,患者局部麻醉后将纤维支气管镜通过口或鼻经过咽部插入右肺中叶或左肺舌段的支气管,将其顶端契入支气管分支开口,经气管活检孔缓缓加入灭菌生理盐水进行灌洗,并取样放置于无菌保存瓶中。
1.2.3标本转运 用75%乙醇对保存瓶喷雾消毒后放入带有生物安全标识的密封袋中;用75%乙醇对密封袋喷雾消毒,将密封袋放入转运桶内,防止保存瓶倒立、倾斜;用75%乙醇对转运桶喷雾消毒,将转运桶放入生物安全转运箱内;用75%乙醇对生物安全转运箱喷雾消毒。转运人员穿工作服将标本经指定路线送至P2+实验室(加强型二级生物安全实验室)。
1.2.4BALF前处理 操作人员参照三级防护标准,在生物安全柜内检查标本有无泄露并核对患者信息。将采集的BALF放入水浴锅中,56 ℃灭活30 min后转移至50 mL离心管内,3 000 r/min离心5 min,将上清液倒入废液桶内,加入20 mL 10%中性福尔马林,固定2 h以上。参照标本转运方法,将固定后的BALF转运至病理科。
1.2.5病理科接收 接收人员参照二级防护标准,用75%乙醇对生物安全转运箱、转运桶、密封袋、离心管依次喷雾消毒后取出。
1.2.6细胞蜡块制作 操作人员参照二级防护标准将固定后的BALF以3 000 r/min离心5 min,将上清液倒入废液桶内,加入正常人血浆200 μL、95%乙醇5 mL,使用震荡仪器,将液体与沉淀物充分混匀,静置15 min后,3 000 r/min离心5 min,弃掉上清液至废液桶内,轻轻敲击离心管管壁,使凝固成块的细胞团从离心管底脱落,用包埋纸打包放入包埋盒中,置入脱水机中参照小标本处理程序过夜,次日包埋成蜡块。
1.2.7切片及染色 参照一级防护标准,在常规技术室进行4 μm厚连续切片3张,行HE染色(采用Leica ST5020染色机)、AB-PAS染色(严格遵守试剂盒说明书操作流程)、免疫组化CK染色(采用Leica Bond全自动免疫组化染色机)。
1.2.8医疗废物处理 实验过程中产生的废液采用550 mg/L的有效氯浸泡,作用时间60 min以上,其它固体废物和防护用品视为高危医疗废物,放入专用黄色垃圾袋,并注明“新冠高危医疗废物”标识,密封交至后勤工作人员,根据《医疗废物处理条例》和《医疗卫生机构医疗废物管理办法》的有关规定进行处置和管理。
2 结果
2.1 实验室安全本实验于56 ℃下对BALF灭活30 min,再采用10%中性福尔马林处理,在生物安全二级防护措施下进行细胞蜡块制作,未发生实验室人员感染。
2.2 细胞数量镜下观察12例细胞量丰富(图1),2例细胞量较少,仅在边缘有少量细胞存在(图2)。
2.3 形态学染色HE染色,薄厚均匀,细胞无变形,核质对比清晰;AB-PAS染色显示酸性黏液呈蓝色(图3);免疫组化染色CK显示上皮细胞阳性(图4)。
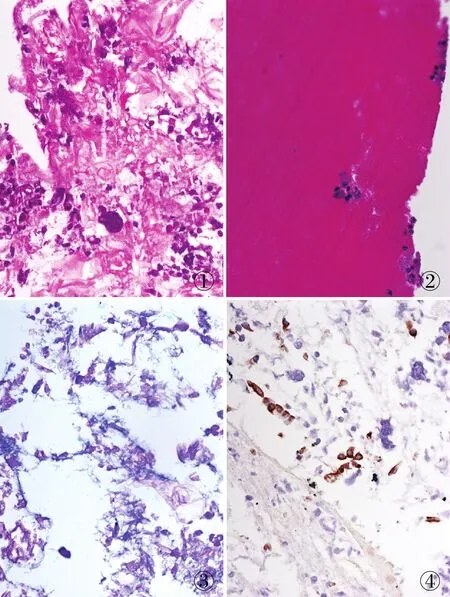
图1 黏液背景下可见少量呼吸上皮细胞及炎细胞 图2 细胞蜡块,仅在边缘有少量细胞存在 图3 酸性黏液呈蓝色,AB-PAS染色 图4 CK染色显示呼吸上皮细胞阳性,EnVision法
3 讨论
SARS-CoV-2属于β属的冠状病毒,基因特征与SARSr-CoV和MERSr-CoV有明显区别,其传播途径主要包括飞沫、接触、空气传播,气溶胶传播是实验室常见的传播方式。病毒对紫外线和热敏感,56 ℃ 30 min、乙醚、75%乙醇、含氯消毒剂、过氧乙酸和氯仿等脂溶剂,均可有效灭活病毒[3]。目前,研究发现重型COVID-19患者白细胞、中性粒细胞和降钙素原水平明显高于普通型患者,提示患者可以合并特殊感染[4]。
细胞蜡块技术已经广泛应用于胸、腹水等制作,已经证实其相对于传统涂片具有更高的病理诊断价值[5-6],但COVID-19患者等具有高传染性体液标本的细胞蜡块制作流程尚未有报道。作者在标本转运及接收时,采用三层包装,并逐层用75%乙醇进行喷雾消毒,降低病毒暴露风险;在P2+实验室内,首先将BALF标本放入水浴锅中56 ℃灭活30 min,然后通过离心获取细胞浓缩液,加入10%中性福尔马林,在保持细胞原有结构的同时可以增强对病毒的灭活作用;为避免纸质接触传染,采用电子病理申请单及电子病理报告,避免纸质在手术室、隔离病区、病理科传播,降低接触传播的几率。经过以上措施进行细胞蜡块制作,未发生实验室人员感染。
在细胞蜡块的制作过程中,因血浆中含有丰富蛋白,与乙醇混合后可发生凝固,使细胞凝聚成团块[7],脱水机处理后包埋成蜡块,对蜡块进行连续切片和染色,镜下观察细胞量丰富,细胞无变形,核质对比清晰,特殊染色及免疫组化定位准确,阳性信号强,且无非特异性着色。其中2例BALF肉眼可见其呈透明样,镜下观察细胞量较少,对于此类标本,可采用50 mL离心管离心后,取浓缩液转移至1.5 mL离心管,加入100 μL正常人血浆及100 μL 95%乙醇,3 000 r/min离心5 min,再继续蜡块制作,可增加细胞数量。
相对于传统涂片,细胞蜡块可以永久保存,重复制片,进行特殊染色、免疫组化、分子检测等有助于提高病理诊断的精准性,同时易于进行回顾性分析。COVID-19患者的BALF因具有较强的传染性,在操作过程中,每个环节均应严格遵循生物安全防控制度,同时科室应对全员进行防护培训,对重点岗位的实验人员重点培训,使其熟练掌握COVID-19的防控知识、方法与技能,避免在细胞蜡块制作过程中发生院内感染。因此,对于类似高传染性体液标本的转运及制片,本实验均具有借鉴意义。

