甲基绿吸收光谱法同时测定饮料中的酒石黄和日落黄
江虹,庞向东
(长江师范学院 化学化工学院,重庆,408100)
食品是人类赖以生存的最基本的物质基础,除应具备安全性和营养性外,还应具备色、香、味。当食品中存在对人体有害因素时,人摄入后将导致某些疾病的发生,严重时可能丧命,因此,近年来,食品的质量安全倍受关注。食品合成色素酒石黄和日落黄常用于各类食品中,尤其是饮料中常加入了合成色素,以提高感官、增进食欲。但着色剂并非越多越好,着色剂添加过量时,会对人体产生某些副作用或甚至导致中毒、致癌、死亡。因此,对夏日大量使用的饮料,我国国家标准 GB 2760—2014《食品安全国家标准 食品添加剂使用标准》严格规定,饮料中酒石黄和日落黄的添加量均不得超过 0.10 g/kg。为保障人类的身体健康和生命安全,对饮料中着色剂含量进行研究有着重要意义。近年,国内外对酒石黄和日落黄的检测方法主要有:高效液相色谱法[1-7]、电化学法[8-15]、荧光法[16-17]及分光光度法[18-21]等。这些方法在酒石黄和日落黄共存时,需采取某些特殊处理方式,如需吸附和分离处理后才能进行各色素的测定。分光光度分析中,当两色素共存时,若吸收峰出现较大重叠(即存在相互干扰)时,也不能进行单一物质的测定,常需采用分离操作或根据吸光度的加和性,采用较繁琐的解联立方程组的办法来求得混合色素的含量[20-21]。本研究中的方法既不采用操作复杂的吸附、分离处理,也不采用复杂的数学处理模式,只需通过控制溶液酸度,便可达到用吸收光谱法同时测定共存的酒石黄和日落黄含量的目的,方法简便、快速,并且迄今未见文献报道。
1 材料与方法
1.1 材料与试剂
酒石黄(tartrazine, TAR)标准物质(纯度 ≥98%,lot:A3J6L1)、日落黄(sunset yellow,SUN)标准物质(纯度 ≥98%,lot:JN1103RA14),北京盛世康普化工技术研究院,北京普析科技有限公司;甲基绿(methyl green, MET)(纯度 99%),上海如吉生物科技发展有限公司;氨丁三醇(Tris,纯度 99%),河南天孚化工有限公司;盐酸(分析纯),重庆川东化工有限公司;超纯水,成都优普超纯水仪制。
饮料样品:佳得乐柠檬味(1#)、美年达香蕉味(2#)、佳得乐橙味(3#)、纤颜苹果味(4#)、芬达橙味(5#),均购自当地超市。
1.2 仪器与设备
U-3010 型紫外-可见分光光度计,日本日立公司;KQ-200VDE 型超声波清洗机,昆山市超声仪器有限公司;pHS-3C型酸度计,上海理达仪器厂。
1.3 标准溶液与试剂溶液的配制
酒石黄标准溶液:准确称取酒石黄标准物质(±0.000 1 g),加水溶解并定容至容量瓶中,配制成534.4 mg/L贮备液,操作液为53.44 mg/L,存于4 ℃冰箱中。日落黄标准溶液:准确称取日落黄标准物质(±0.000 1 g),加水溶解并定容至容量瓶中,配制成452.4 mg/L贮备液,操作液为45.24 mg/L,存于4 ℃冰箱中。甲基绿溶液:653.2 mg/L 水溶液。Tris-HCl 溶液:采用0.20 mol/L Tris 溶液与0.10 mol/L HCl 溶液配制,pH 3.5~9.8。
1.4 样品处理
准确移取各饮料样品30.0 mL,分别置于小烧杯中,在天平上准确称取其质量(±0.000 1 g),45 ℃ 超声处理20 min,加适量水后,再超声10 min,用NH3·H2O 调至中性,再于45 ℃ 超声处理10~15 min,冷至室温后,用水定容至100 mL,即为待测液。
1.5 实验方法
准确移取酒石黄和日落黄标准操作液适量,分别置于10 mL 比色管中,加入pH 9.43 Tris-HCl 溶液1.00 mL,再加653.2 mg/L 甲基绿溶液2.00 mL,用水定容,摇匀,待充分反应15 min 后,在紫外-可见分光光度计上,以各体系的试剂空白作参比,扫描各溶液的吸收光谱,在574 nm 处测定酒石黄-甲基绿体系溶液的吸光度(A),在488 nm 处测定日落黄-甲基绿体系溶液的吸光度(A),最终求得各饮料样品中共存色素——酒石黄和日落黄的含量。
2 结果与分析
2.1 酒石黄体系与日落黄体系的吸收光谱特征
从酒石黄和日落黄的结构式可知,两者均可与甲基绿(三苯甲烷碱性染料)以静电作用生成离子缔合物。
从图1可知,单独的酒石黄溶液和日落黄溶液在可见光区均有较大吸收,最大吸收峰分别位于426 nm(酒石黄)和480 nm(日落黄),曲线1 和曲线4 表明,它们的吸收谱线有一定的重叠,当两色素共存时,因谱线的叠加,互相间有干扰,不能单独进行某一色素的测定。但当加入甲基绿溶液和pH 9.43 Tris-HCl 溶液后,酒石黄与甲基绿反应生成的缔合物在可见光区产生2 个明显的负吸收峰和1 个明显的正吸收峰(曲线3),日落黄与甲基绿反应生成的缔合物在可见光区产生2 个明显的正吸收峰(曲线5)。曲线3 与曲线5 和曲线2比较,均有波移现象,说明酒石黄和日落黄均可与甲基绿反应生成新物质。从曲线3 与曲线5 的比较可知,在Tris-HCl 溶液酸度相同(均为pH 9.43)和甲基绿浓度、用量相同的情况下,酒石黄-甲基绿体系的测定波长为574 nm时,共存物质日落黄不干扰测定,而在652和450 nm处测定,日落黄会有严重干扰;对于日落黄-甲基绿体系,当测定波长为488 nm 时,溶液中共存的酒石黄对其测定无干扰,当测定波长为648 nm 时,酒石黄对其测定存在严重干扰。酒石黄体系和日落黄体系的线性图见图2,吸收光谱特征见表1。可知,当溶液酸度为pH 9.43 时,可在574 nm 测定酒石黄(日落黄不干扰),在488 nm 测定日落黄(酒石黄不干扰)。该方法与已报道的文献[18-21]比较,不需吸附、分离操作,也不用解复杂的方程组,只需控制好溶液酸度,便可在不同波长下分别测定共存色素的含量。
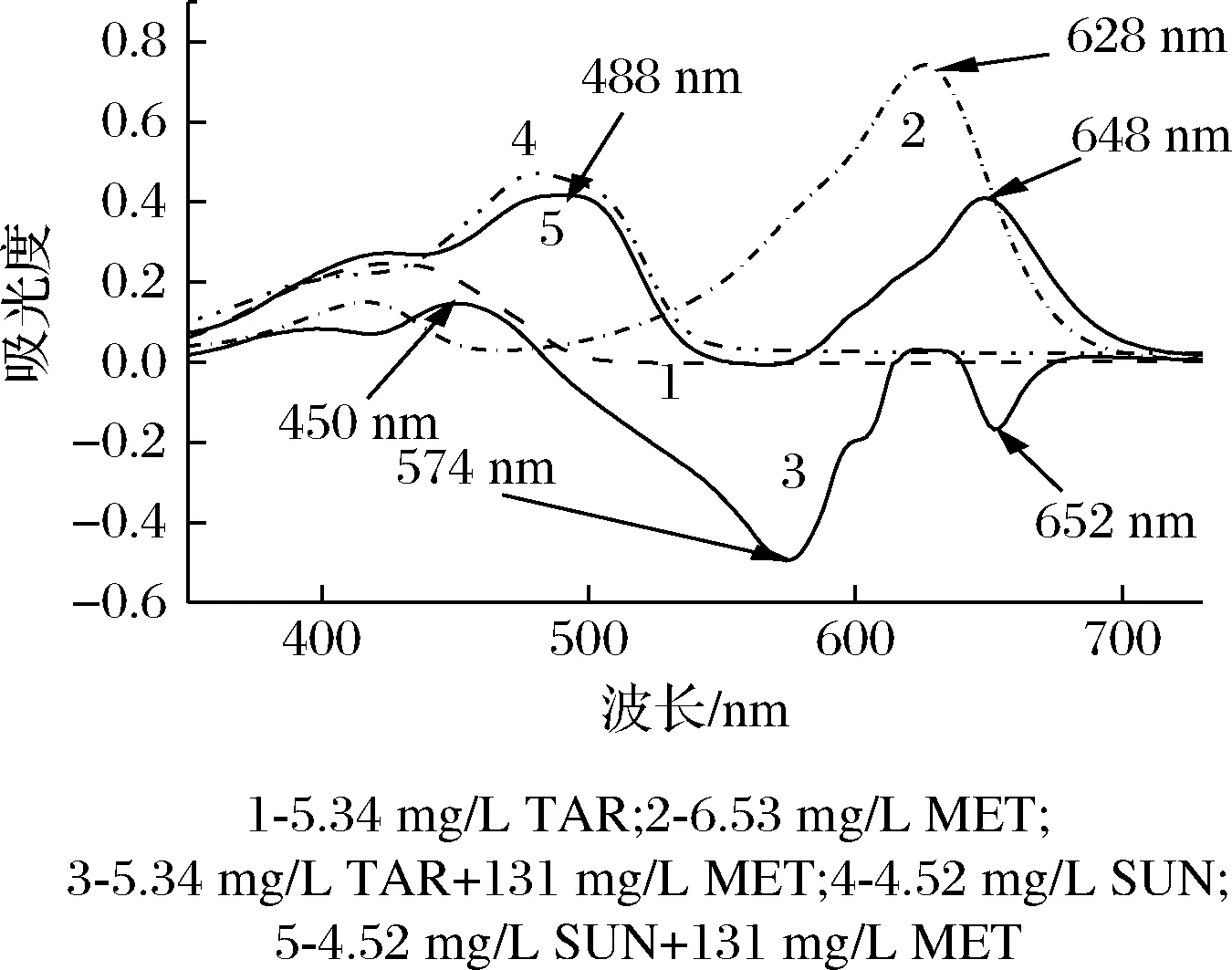
图1 酒石黄和日落黄与甲基绿反应的吸收光谱Fig.1 Absorption spectra of tartrazine and sunset yellow reacted with methyl green

表1 酒石黄-甲基绿体系与日落黄-甲基绿体系的吸收光谱特征Table 1 Characteristics of absorption spectrum of tartrazine-methyl green system and sunset yellow-methyl green system
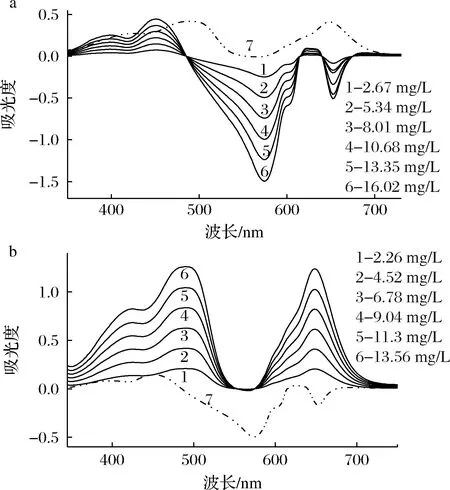
a-酒石黄;b-日落黄图2 酒石黄、日落黄和甲基绿体系的线性吸收光谱Fig.2 Linear absorption spectrum of tartrazine and sunset yellow reacted withd methyl green注:甲基绿131 mg/L;试剂空白参比
2.2 反应条件
2.2.1 溶液pH 及用量的选择
取酒石黄、日落黄标准操作液1.00 mL,甲基绿溶液2.00 mL,考察了酒石黄-甲基绿体系与日落黄-甲基绿体系pH 3.5~9.8 的Tris-HCl 溶液对吸光度的影响,结果见图3。从图3-a可知,当测定波长为574 nm 时,酒石黄-甲基绿体系pH 4.42~9.43时,随着溶液pH 的增大,体系溶液吸光度绝对值(|A|)逐渐增强,当pH 9.43 时,|A| 达最大,之后逐渐减弱;而日落黄-甲基绿体系随着pH 的增大,|A| 逐渐降低,当pH 9.43 时,|A|= 0.001。
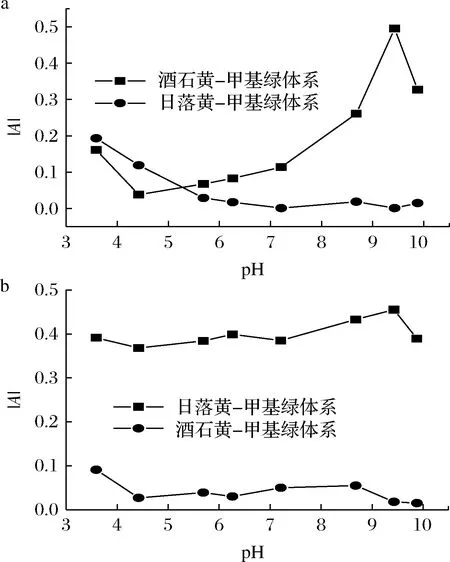
a-574 nm;b-488 nm图3 溶液pH对不同测定波长下|A|的影响Fig.3 Effect of solution pH on |A| under different wave length
从图3-b可知,当测定波长为488 nm 时,日落黄-甲基绿体系pH 3.59~9.43时,对|A|的影响均较大,当pH 9.43 时,|A| 达最大,之后有所降低;而酒石黄-甲基绿体系除pH 3.59 外,其余pH 对|A| 影响均不大,当pH 9.43 时,|A|= 0.018。可见,选用pH 9.43 的Tris-HCl 溶液,不仅灵敏度相对最大,而且在574 nm 波长处测定酒石黄,日落黄不干扰;在488 nm 波长处测定日落黄,酒石黄不干扰。故可用控制溶液酸度的办法来消除共存色素-酒石黄和日落黄间的相互干扰,达到分别测定的目的。
同时考察了pH 9.43 Tris-HCl 用量对|A| 的影响,结果见图4,用量为1.00 mL 时,无论在574 nm 测定酒石黄,还是在488 nm 测定日落黄,均有较大灵敏度。实验选择在最佳条件下进行各项试验。

图4 Tris-HCl溶液用量对|A| 的影响Fig.4 Effect of Tris-HCl buffer on|A|
2.2.2 甲基绿溶液用量的选择
取酒石黄、日落黄标准操作液1.00 mL,pH 9.43 Tris-HCl 溶液1.00 mL,考察了甲基绿溶液(653.2 mg/L)用量对酒石黄体系和日落黄体系|A| 的影响,结果见图5。当测定波长为574 nm 时,甲基绿用量对酒石黄-甲基绿体系的|A| 有较大影响,而对日落黄-甲基绿体系的|A| 基本无影响。当测定波长为488 nm 时,甲基绿用量对日落黄-甲基绿体系的|A| 有较大影响,而对酒石黄-甲基绿体系的|A| 基本无影响。可见,无论在574 nm波长处测定酒石黄还是在488 nm波长处测定日落黄,甲基绿用量为2.00 mL 时,它们均有相对较大的灵敏度,且互不干扰。实验选用甲基绿溶液2.00 mL。
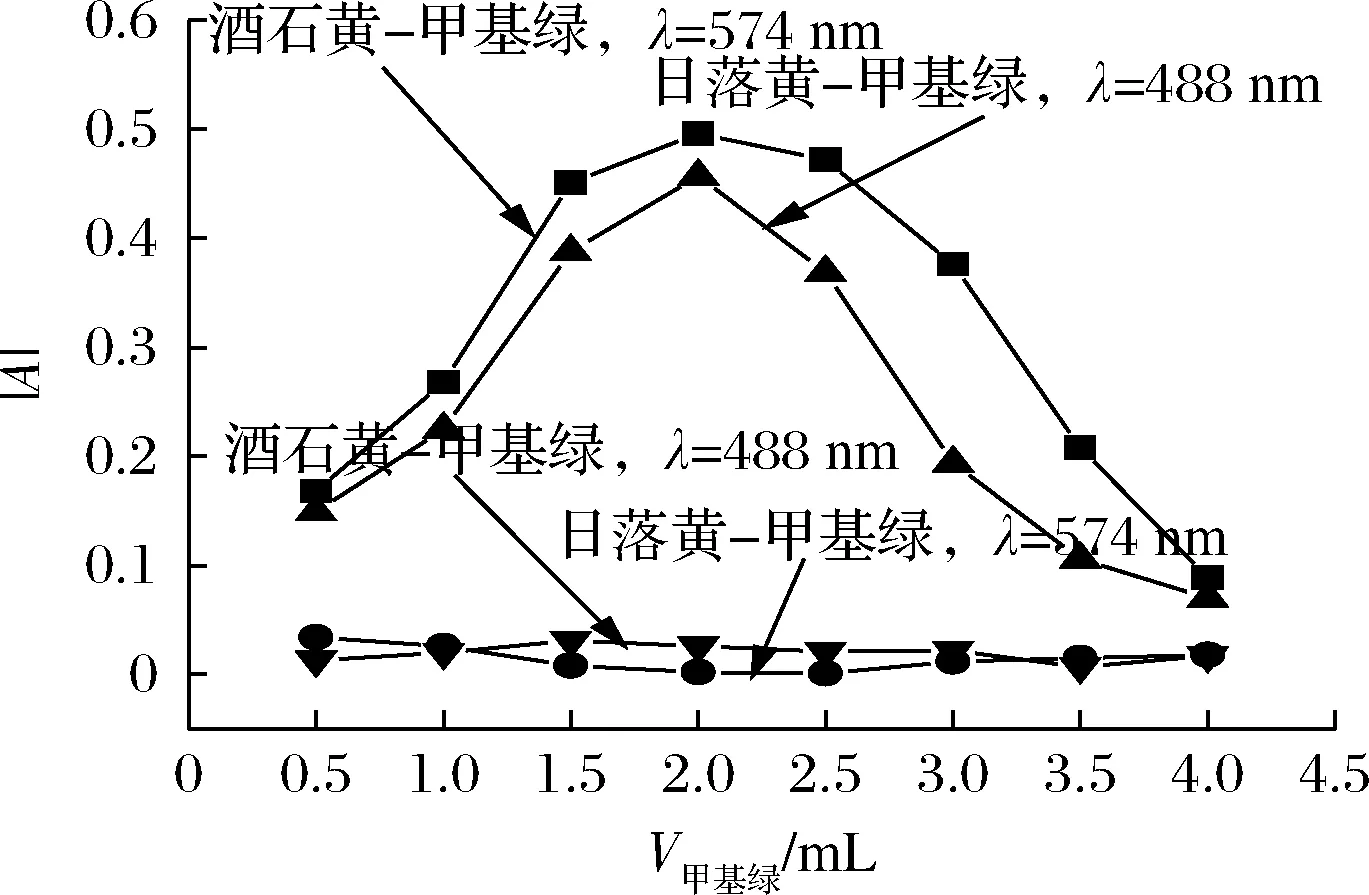
图5 甲基绿用量对|A| 的影响Fig.5 Effect of methyl green dosage on|A|
2.2.3 反应时间的选择
在前述选定的最佳条件下,考察了酒石黄、日落黄与甲基绿的反应时间对|A| 的影响。结果表明,酒石黄-甲基绿体系与日落黄-甲基绿体系在15 min 内均可反应完全,稳定时间约50 min。两体系均选在15 min 后测定。
2.3 方法学考察
2.3.1 酒石黄和日落黄的标准曲线及灵敏度
分别准确移取酒石黄和日落黄标准操作液0.00、0.50、1.00、1.50、2.00、2.50、3.00 mL,分别置于10 mL 比色管中,加入选定条件的pH 9.43 Tris-HCl 溶液1.00 mL 和甲基绿溶液2.00 mL,用水定容、摇匀,15 min 后,各体系以试剂空白作参比,测定各溶液的吸光度A,作574 nm 处酒石黄的A-ρ标准曲线和488 nm 处日落黄的A-ρ标准曲线。标准曲线相关参数见表2可知,该方法有较高灵敏度和较宽线性范围。

表2 酒石黄和日落黄标准曲线相关参数Table 2 Related parameters of standard curves of tartrazine and sunset yellow
2.3.2 方法的选择性
按实验方法,考察了酒石黄-甲基绿体系在574 nm 处测定5.34 mg/L 酒石黄,考察了日落黄-甲基绿体系在488 nm 处测定4.52 mg/L 日落黄,相对误差≤±5%,共存物的影响见表3。结果表明该方法有良好的选择性。
2.3.3 样品测定、准确度及精密度
取1.4中制备好的待测液2.00 mL,按实验方法分析其含量并计算原始饮料中酒石黄和日落黄的含量,同时参考文献方法[21]进行对照试验,见表4。
按样液的配制方法,准确移取30 mL 各饮料样品分别置于各小烧杯中,并称其准确质量(±0.000 1 g),再分别加入一定量的酒石黄或日落黄标准贮备液,并于45 ℃ 超声20 min,后续操作同1.4中样品处理,最后用水定容至100 mL。取该液2.00 mL,按实验方法测定各加标回收量,如表4所示。
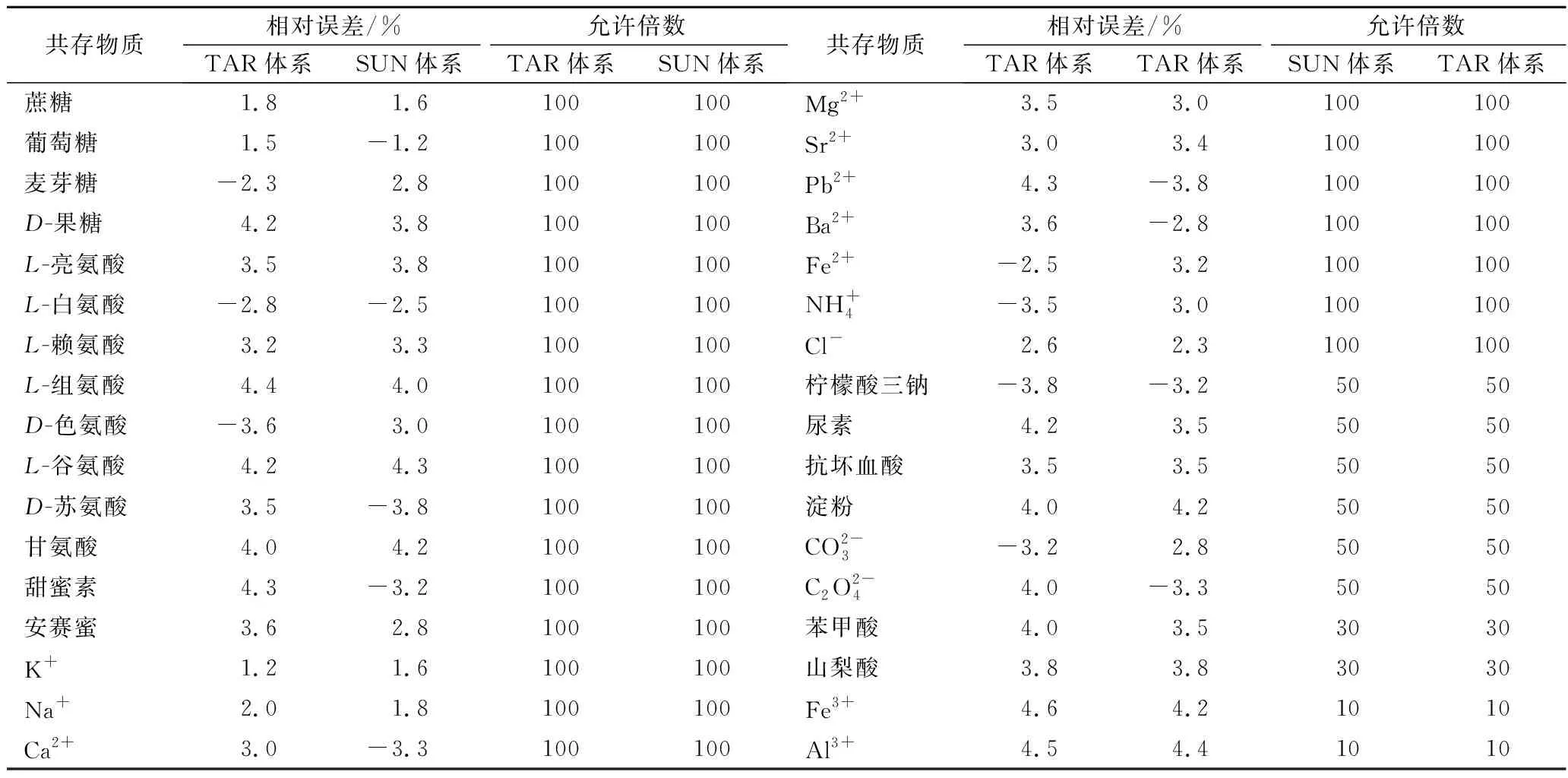
表3 共存物质的影响Table 3 Effect of coexistent substance

表4 市售饮料样品分析结果及回收试验(n=5)Table 4 Analysis results and recovery test of commercial beverage samples (n=5)
3 结论
共存色素酒石黄和日落黄含量的测定,可以用甲基绿作探针,通过控制溶液酸度,选择不同测定波长,达到分别测定共存物中两色素的目的。该方法简便,不需吸附、分离操作,也不用复杂的数学求解,快速,样品处理简单,准确度和精密度满足定量分析要求,并有较高灵敏度和较宽的线性范围,适用于饮料中共存酒石黄和日落黄含量的测定。

