液相色谱串联质谱法测定加工食品中丙烯酰胺的含量
刘 刚,王 毅*,王 鑫,雷 激,何 楠
(1.四川省食品药品检验检测院,四川 成都 611731;2.西华大学食品与生物工程学院,四川 成都 610039)
丙烯酰胺是一种白色晶状化合物,在工业生产中主要用于聚丙烯酰胺的生产。2002 年瑞典研究人员在经过高温加工后的食品中发现了丙烯酰胺的存在,而在生食材和煮制的食品中基本未发现丙烯酰胺[1]。其在食品中产生的途径源自加热工艺过程中的美拉德反应[2]。它通过一系列的脱氨脱羧消去反应便产生了丙烯酰胺[3]。丙烯酰胺俗称“丙毒”,具有潜在的神经毒性和准致癌性[4]。研究表明油炸、烧烤、高温烘焙等方式加工的含淀粉食品具有较高的丙烯酰胺水平[5],因此应在合理膳食的基础上,尽量远离这些不健康的食品。
目前关于检测食品中丙烯酰胺水平的方法有很多,包括酶联免疫法[6]、生物传感器法[7]、毛细管电泳法[8]、离子色谱法[9]、气相色谱法[10]、气相色谱质谱法[11]、高效液相色谱法[12]、高效液相色谱质谱法[13],其中色谱法是目前被认为最为准确有效的检测方案[14]。本文采用高效液相色谱串联质谱法,在对方法进行优化的基础上,对日常生活中主食及日常接触的部分零食中的丙烯酰胺含量进行了测定,作为日常饮食摄入量的参考。
1 材料与方法
1.1 仪器与设备
Agilent1200 高效液相色谱仪(美国安捷伦)、Agilent 6460 三重四级杆串联质谱仪(美国安捷伦)、XW-80A 型漩涡混合器(上海青浦泸西仪器厂)、离心机(湘仪实验室仪器开发有限公司)、氮吹仪(瑞典Biotage)、配氮吹发生装置(美国Parker)、超声波清洗器(德国ELMA)、电子天平(梅特勒−托利多精密仪器有限公司)、移液器(美国Gilson)、纯水仪(美国Millipore)。
1.2 材料与试剂
丙烯酰胺标准品(纯度99.3%,Dr.E)、13C-丙烯酰胺标准品(纯度99.0%,Dr.E)、乙腈(质谱级,Sigma-Aldrich)、甲酸(色谱级,Fisher Scientific)、甲醇(色谱级,Sigma-Aldrich)、正己烷(普通级,Sigma-Aldrich)、亚铁氰化钾(分析纯,成都市科隆化学品有限公司)、硫酸锌(分析纯,成都市科隆化学品有限公司)、实验用水均为自制超纯水,净化小柱(Agela Technologies)。
实验用样品来源于单位食堂及市售。
1.3 实验方法
1.3.1 标准溶液的配制
分别称取适量丙烯酰胺、13C3-丙烯酰胺标准品置于容量瓶中,用甲醇溶解定容,分别配制成1 000 μg/mL 的标准储备液,冷藏保存。
准确吸取丙烯酰胺储备液一定体积,用0.1%的甲酸水稀释定容至刻度,配制成10 000 ng/mL 的中间稀释液,备用;吸取一定体积13C3-丙烯酰胺储备液,0.1%的甲酸水稀释成1 000 ng/mL 的中间液,备用。将丙烯酰胺中间液稀以逐级稀释的形式配制成3、5、10、20、50、100、200、500、1 000、2 000 ng/mL 的工作液上机测试(其中均含100 ng/mL 的13C3-丙烯酰胺)。
1.3.2 仪器条件
液相条件:Agilent Hillic Plus 色谱柱 2.1 mm×100 mm× 3 μm;柱温:35 ℃;流动相:乙腈(A):0.1%甲酸水(B),采用梯度程序洗脱,洗脱程序0.00~3.10 min(A:60.0%),3.10~4.00 min(60.0%~95.0%),4.00~6.00 min(95.0%),6.10~8.00 min(60.0%);混合流动相流速:0.3 mL/min;进样体积:2 μL。
质谱条件:采用ESI 源正模式;离子源温度325 ℃;锥口电压500 V;毛细管电压2 000 V;氮气流速5.0 L/min;鞘气温度350 ℃;鞘气流速11 L/min;方法在正式加载检测样本时采用分段扫描,一方面可以将附近干扰峰从TIC 图中去除,使图谱更加整洁,另外可以减轻批量不间断进样造成的锥口污染,影响质谱灵敏度和响应,分段情况可根据方法目标物及内标出峰时间定义。本文分段方案如表1所示,质谱MRM 参数如表2 所示。
1.3.3 样品的前处理方案
液体样品应均质混匀,固体样品取可食部分用粉碎机均匀粉碎。称取2.0 g 待测样本于50 mL 离心管中,加入200 ng 当量的13C-丙烯酰胺,加入35mL 的超纯水(液态样本用超纯水稀释至35 mL,较干净样本直接加水或稀释至40 mL),振荡器上以2 000 r/min 转速振荡约20 min,准确移取15%亚铁氰化钾溶液和30%硫酸锌溶液各2.5 mL 振荡摇匀,后转移至离心机10 000 r/min 离心5 min,转移上清液。对于含油较多的样本,应加入适量正己烷强烈振荡进行脱脂,离心后转移水相层备用,此时待净化备用液体积为40 mL。
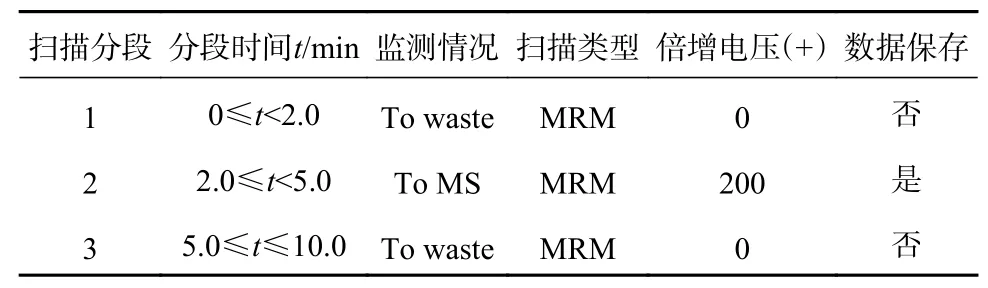
表1 丙烯酰胺及其同位素内标分段采集情况
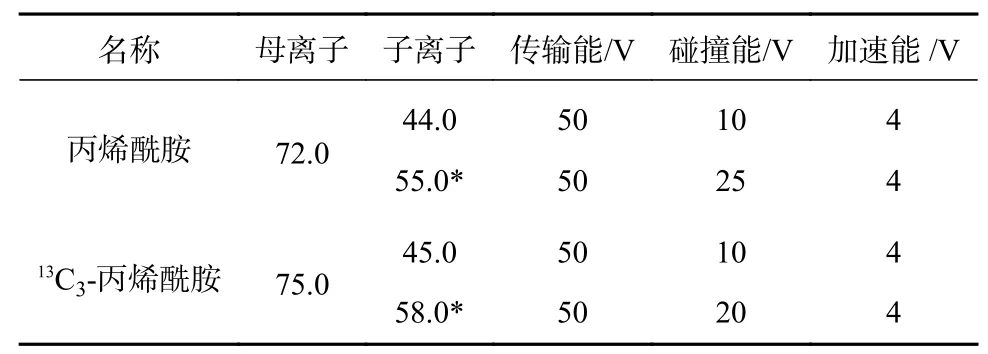
表2 丙烯酰胺及其同位素内标MRM 参数
采用对碱性化合物具有高度选择的复合型专用丙烯酰胺净化小柱,预先分别用5 mL 甲醇、5 mL 水对小柱活化,加载上述样液20 mL 于活化好的专用净化小柱中,等待液体自然通过至干,用5 mL 甲醇分2 次洗脱并收集虑出液体,残留在小柱中的液体应用注射器活塞慢慢压出。将收集好的滤液置于氮吹仪吹至近干(水浴温度40 ℃),用0.1%的甲酸水定容至1 mL,均质后过0.22 μm 水相滤膜上机测试。
2 结果与分析
2.1 分离柱的选择
本文对Zorbox-SB C8、Eclipse C18、T3、Hillic 4 种色谱柱对丙烯酰胺的分离情况进行了对比。实验发现使用Zorbox-SB C18、Eclipse C18对丙烯酰胺的保留均不理想,在样品测试中容易与干扰物质共流出,如图1 和图2 所示。即使将流动相水相比例提高到分离柱最大耐受极限,也不能改善保留时间,因此可以认为丙烯酰胺在Zorbox-SB C8、Eclipse C18上无保留。这与丙烯酰胺结构中仲胺基团具有较强极性有很大关系,因此Zorbox-SB C8、Eclipse C18不适合用于目标物质分离。T3、Hillic 色谱柱对丙烯酰胺具有较强的保留,可用于丙烯酰胺的分离。利用T3 色谱柱分离TIC 峰型尖锐,但有一定的拖尾现象,从峰的对称性看,本实验优选Hillic色谱柱用于分析,如图1 所示。
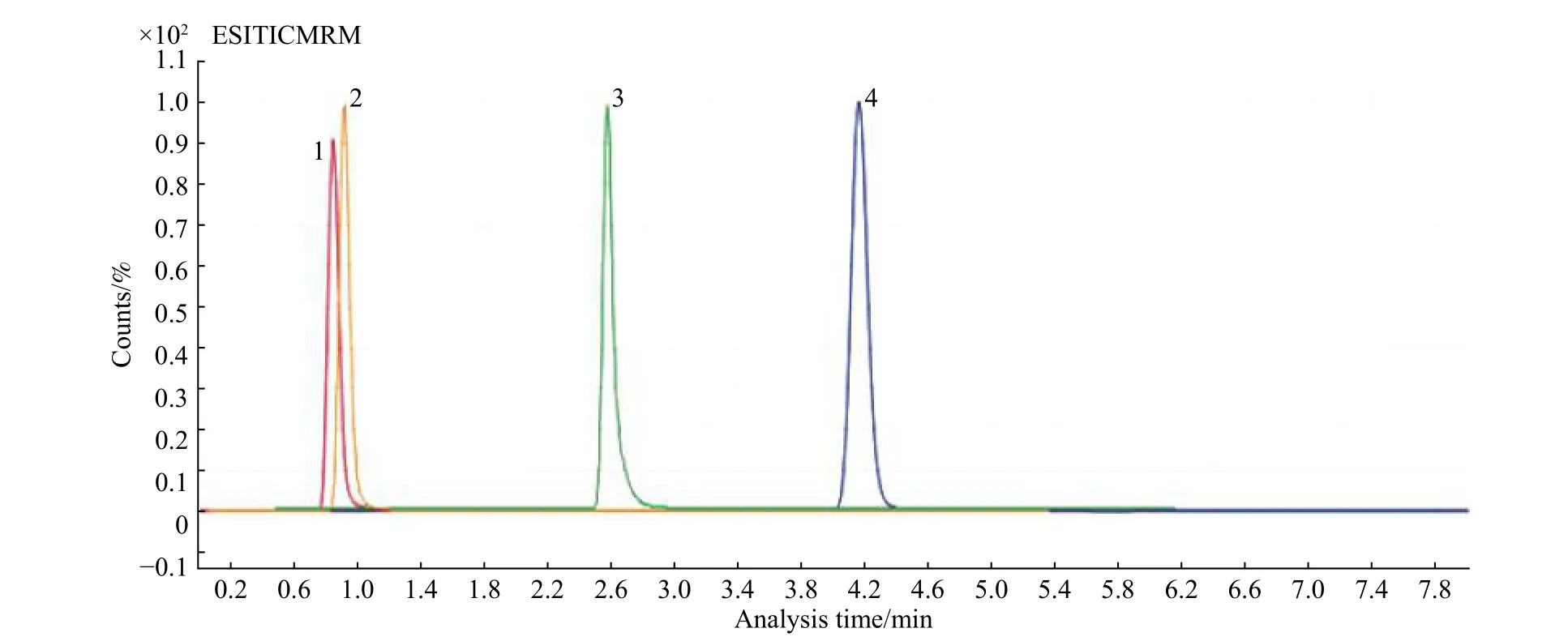
图1 不同类型色谱柱对丙烯酰胺对照品分离情况(左起1 为Zorbox-SB C8;2 为Eclipse C18;3 为T3;4 为Hillic)
2.2 洗脱流动相的选择
本文选取实验室常用的流动相进行比较。有机相为甲醇、乙腈,水相为超纯水、0.1%甲酸水。将流动相两两配比,实验发现所选有机相分别和水相两两配对作为洗脱流动相均能够表现出较好的响应和峰型。在正模式下,由于在水相流动相中加入适量的H+更有利于被测组分的离子化,提高响应,因此优选甲醇、乙腈与0.1%甲酸水搭配。本实验选取Hillic 色谱柱进行分离,其属于典型的正向色谱柱反向运用,色谱柱填料为未经特殊处理的裸硅胶,甲醇作为流动相可能会出现填料硅胶的溶出,对色谱柱造成不可逆破坏,因此本实验选取乙腈:0.1%甲酸水作为洗脱流动相(有机相不得低于60%)。加标样本中丙烯酰胺及其同位素内标的总离子色谱图(TIC)及多反应监测图谱(MRM)如图3所示。
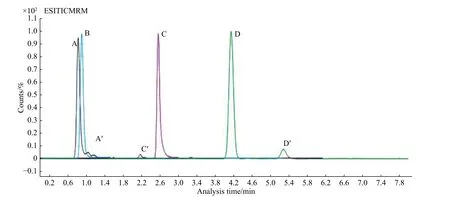
图2 不同类型色谱柱对加标样本的分离情况(左起A 为Zorbox-SB C8;B 为Eclipse C18;C 为T3;D 为Hillic;A′、C′、D′均为杂质)
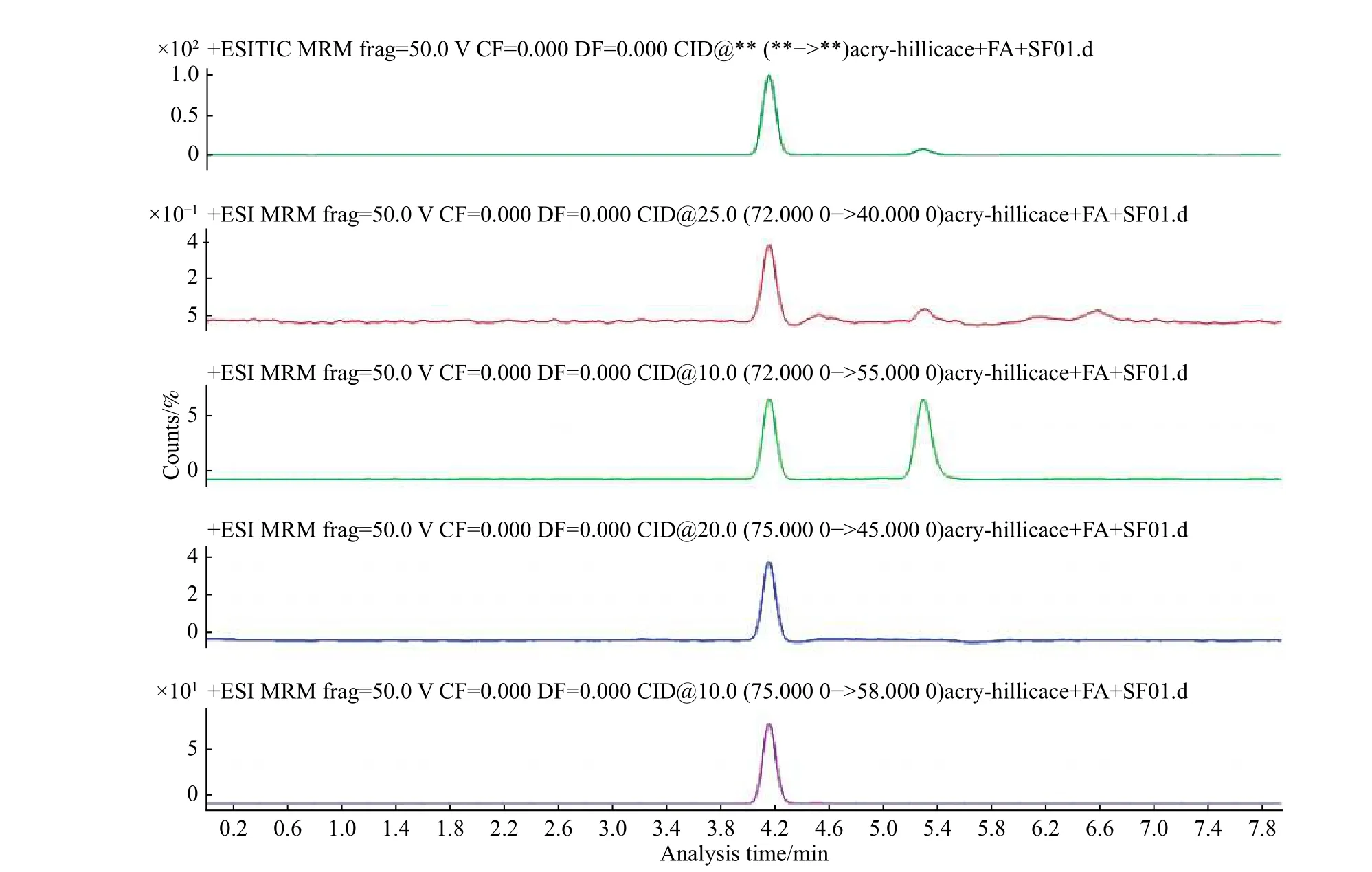
图3 加标样本中丙烯酰胺及其同位素内标的TIC 图及MRM 图(加标质量浓度10 ng/mL)
2.3 方法学验证
2.3.1 线性范围的选择及拟合相关性
按1.3 实验条件配制好标准工作曲线上液相色谱质谱,内标法定量,以一次线性方程拟合曲线绘制标准曲线(横坐标X为质量浓度,纵坐标Y轴为响应强度),结果表明在3~2 000 ng/mL 质量浓度范围内丙烯酰胺及其同位素内标离子化效果良好,具有良好的线性关系,相关系数R≥0.999。
2.3.2 检出限和定量限
选取米饭(蒸制不含油)、饺子(蒸制含油)样本为基质,分别向两种基质中加入较低质量浓度的丙烯酰胺标准品,按1.3.3 中的前处理方案处理后上机测试,所得响应在MassHunter 定性软件中计算信噪比(S/N),根据信噪比计算结果提示对加标量做调整,可得到较为准确的检出限。本文选用两种不同的基质对检出限进行了评估,在丙烯酰胺加入当量为6 ng 时基本都能满足信噪比S/N=3,因此本方法的检出限设定为3 μg/kg,定量限设定为10 μg/kg。
2.3.3 精密度及其回收率
以米饭(蒸制)作为空白基质样,均匀制样后称取适量样本A、B、C、D 四组,每组各6 份。分别加入丙烯酰胺标准品6、30、60、300 ng 按1.3.3 的方案进行前处理后上液相色谱质谱测定,所得结果如表3 所示,从结果中可见在检出限质量浓度加标回收中数据略有偏高的现象,这很有可能是低浓度加标受样本基质影响较大的原因造成的,随着加标浓度的增加,平均回收率基本能达到一个较为平稳的水平。从表3 整体数据以及实验中累积的其他基质的数据看,均符合相关方法确认技术要求[15]。
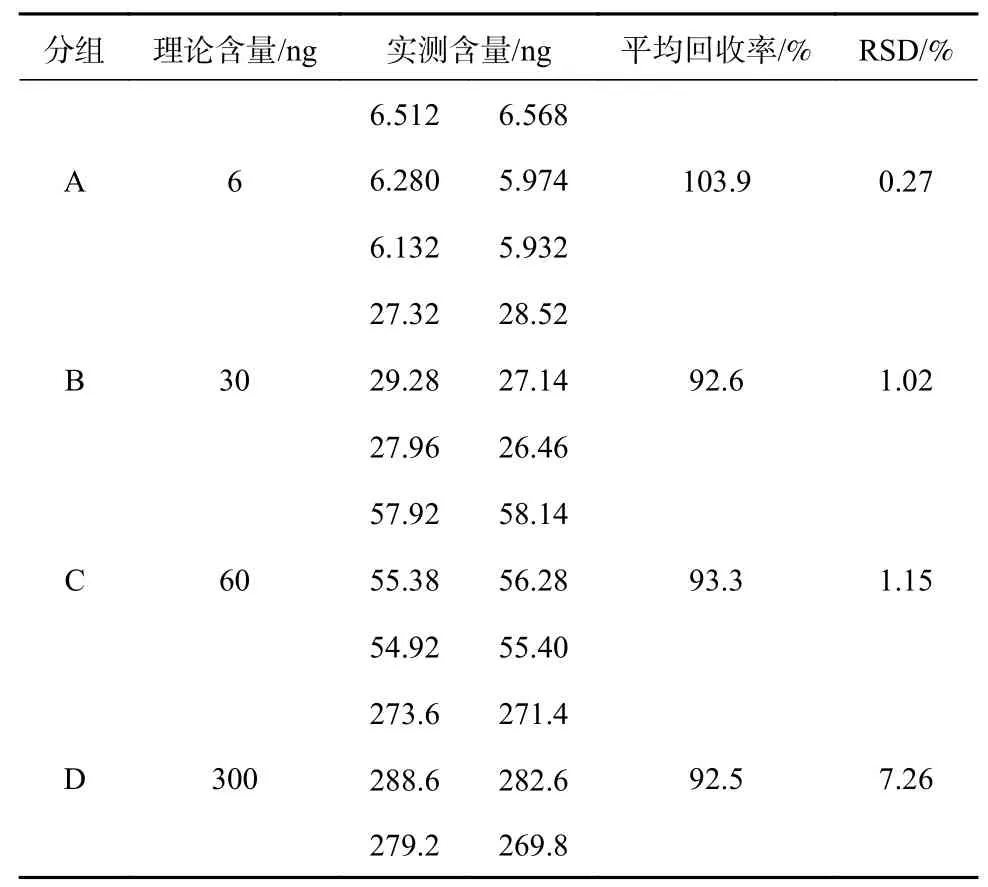
表3 以米饭为基质丙烯酰胺加标的精密度和回收率(n=6)
2.3.4 样品的测定
本文对作者所在单位食堂中的日常食品,摊贩售卖及商店中的部分典型食品进行了不定期采样测定,结果仅做参考,数据如表4 所示。分析发现一般通过蒸制、直接水煮的食物基本都不容易检出丙烯酰胺,如日常主食蒸煮米饭、面条,水煮蔬菜、纯牛奶等,这可能是由于在有充足水分条件下加热食物,不会触发美拉德反应进而抑制了丙烯酰胺的产生。而通过油炸、焙烤、炒制的食物,或多或少都能够发现丙烯酰胺的影子,其中含淀粉较高的油炸类食品、部分烘焙类食品表现尤为突出,农贸市场自制售卖油炸土豆片、个别膨化食品甚至出现上千当量的情况,这也说明了在油炸、烘焙等高温条件下,含淀粉较高的食品容易出现褐变从而激发一系列丙烯酰胺生成的联锁反应[16]。
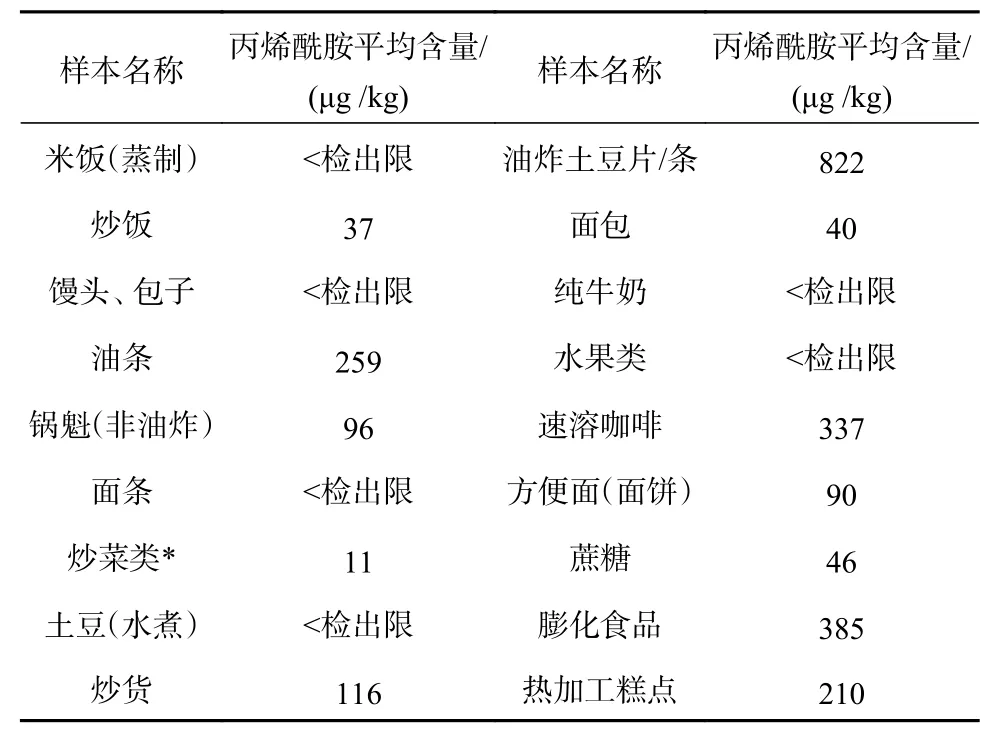
表4 不同食品中丙烯酰胺含量统计
3 总结
本文对丙烯酰胺色谱分离柱进行了初步筛查,同时对色谱质谱条件进行优化,建立了加工食品中丙烯酰胺分析检测的液相色谱质谱分析方案。实验表明,不同基质的样本经净化处理,采用Hillic 色谱柱,以乙腈和0.1%甲酸水为流动相分离经质谱分析后具有良好的重复性和回收率,该方案适用于不同类型加工食品中丙烯酰胺含量的检测。通过日常生活中典型食品中丙烯酰胺的初步监测结果不难发现,丙烯酰胺含量较高的食物大多是含含碳水化合物较多且经过高温油炸、烘焙或炒制的,而通过蒸制、水煮的食物、传统炒菜等含量较低或检不出,因此日常以常规三餐为主的人群在丙烯酰胺这个潜在有害物质的暴露量上是相对较小的。

