共载TPE衍生物和纳米银的PLGA复合载药体系的抑菌活性研究
匡 昭,张伟伟,项驷文
(安徽工程大学 生物与食品工程学院,安徽 芜湖 241000)
感染性疾病是致死率最高的病症之一。抗菌药物的广泛使用和滥用已经导致细菌多药耐药性的出现。耐药性细菌感染则需要使用高剂量的抗生素,但这会导致更高的药物毒性,更长的住院时间和更高的死亡率。耐药性细菌的全球影响更难以量化,因此,寻找一种安全、高效且不会出现耐药性细菌的治疗方法受到了科研人员的广泛关注。
如今纳米技术在诸如医学、生物学等大多数研究领域中起着重要的作用,在生物制药应用中具有潜力。纳米材料已开始越来越多地用于生物医学应用,纳米医学也成为了治疗多种疾病的有力工具。聚乳酸-羟基乙酸共聚物(PLGA)是递送系统(例如微球)的首选材料,在过去的几十年中,包含乳酸和乙醇酸的聚合物及其共聚物作为药物和组织工程中的预期药物递送载体而引起了人们的关注。PLGA由于分子结构、形态、机械性质和药物载体而具有出色的生物降解性和生物相容性,所以它是封装抗菌化合物的合适选择。
近年来,无机和金属配合化学治疗领域成为研究热点,过渡金属离子螯合的有机杂环配体是潜在的药物开发领域。1,10-菲啰啉是研究的N,N'-杂环螯合配体之一,相关报道了基于1,10-菲啰啉化合物的抑菌活性。Raman等合成了一系列具有通式[M(L)(phen)] Cl的配合物,其表现出广谱的抑菌活性和抗真菌活性。1,10-菲啰啉-5,6-二酮衍生物(TPE)显示出对革兰氏阴性细菌的高抗菌活性。基于1,10-菲啰啉-5,6-二酮的化合物具有良好的抗菌活性,因此具有开发用于预防和治疗由耐药性细菌引起的感染的新的化学治疗手段前景。银及其化合物具有很强的抑菌杀菌作用,对真菌和病毒具有广谱抗菌活性。纳米银(Ag NPs)与细菌的特异性相互作用、随后的渗透以及局部释放的Ag离子均可导致细菌死亡。因此,Ag NPs因其有效的杀菌作用而受到人们的广泛关注。
研究通过复乳法合成复合纳米载药体系PLGA@TPE@Ag,通过表征手段对其形貌和特性进行研究,再进一步探究该复合纳米载药体系对耐药性细菌的抑制活性。
1 材料与方法
1.1 试验材料
PLGA(50∶50,Mw:7 000~17 000 kDa)、聚乙烯醇(PVA,MW:30 000~70 000 kDa;水解度87%~89%)、二氯甲烷、AgNO粉末(99.99%)、NaBH(≥96%)和NaOH购自Sigma-Aldrich Chemical(美国)。所有试验用水均为蒸馏水。TPE衍生物为实验室合成。
1.2 Ag NPs合成
十一巯基烷酸和AgNO(0.017 g)等摩尔混合,剧烈搅拌5 min。预配置的NaBH(0.004 56 g)溶液在同一室温条件下迅速加入到上述溶液中,剧烈搅拌1 h。在磁力搅拌器上继续搅拌6 h,最后10 000 rpm离心收集产物。
1.3 PLGA载药纳米体系合成
PLGA(500 mg)溶解于2 mL的二氯甲烷中,涡旋5 min后,形成一种乳化液。再次将1 mL的TPE衍生物(四氢呋喃溶液)加入到上述溶液中,继续涡旋15 min。将5 mL PVA(5%)溶液加入到上述溶液中,探头式超声3 min,形成W1/O溶液。超声结束后,加入25 mL PVA(0.3%)溶液,形成W1/O/W2型溶液。然后磁力搅拌过夜,离心除去有机溶剂,次日收集纳米粒子(5 000 rpm,5 min),合成的纳米粒子为PLGA-TPE。如果将TPE衍生物替换成Ag NPs粒子,合成的纳米粒子为PLGA-Ag。如果将TPE衍生物和Ag NPs同时加入,合成的纳米粒子为PLGA@TPE@Ag。
1.4 表征试验
紫外-可见光谱(UV-vis,S-3100,Scinco Co.,Korea)检测UV-可见吸收光谱。透射电子显微镜(TEM,HT7700,Tokyo Japan,Hitachi)观察Ag NPs和PLGA@TPE@Ag的形态。扫描电镜(S-4800,Hitachi,Japan)观察合成的PLGA形态。动态光散射(DLS)测量PLGA和PLGA@TPE@Ag粒径分布情况。
1.5 载药量和包封率试验
称取一定质量干燥的各种PLGA纳米体系(PLGA-TPE、PLGA-Ag和PLGA@TPE@Ag),溶解在1 mL的二氯甲烷溶液中,涡旋震荡10 min溶解后,再加入1 mL PBS溶液,继续涡旋震荡10 min,吸取一定体积的上清液进行不同波长的紫外检测,目的是检测TPE和Ag NPs吸光度。然后根据已建立的药物标准曲线,计算溶液中药物的含量。PLGA@TPE@Ag载药体系是将二者的药物的总量计算在内。
包封率=溶液中药物质量/总的投药量,载药量=溶液中药物质量/干燥载药体系质量。
1.6 药物缓释试验
探究PLGA载药纳米体系(PLGA-TPE、PLGA-Ag和PLGA@TPE@Ag)的体外缓释特性试验方法如下:将适量的单个PLGA载药纳米体系溶解在PBS缓冲液中,然后将溶液转移至已预处理的透析袋中(MWCO=10 kDa),透析袋置于合适的装有PBS缓冲溶液的烧杯中。然后分别在不同的时间点检测溶液的吸光度,计算材料累积的浓度百分比。
1.7 细菌培养
常见的革兰氏菌(大肠杆菌ATCC 8739,金黄色葡萄球菌ATCC 6538和枯草芽孢杆菌ATCC 6633)从安徽农业大学生命科学学院获得,在37 ℃条件下活化培养24 h。将单菌落重新接种至液体培养基,继续在37 ℃、200 rpm摇床条件下培养12 h。最后,将此转接的细菌混悬液按照1∶40的比例置于新鲜的LB液体培养基中,在37 ℃、200 rpm摇床条件下培养2~3 h,当测得OD=0.5时可知,此时细菌处于对数生长期。
1.8 抑菌活性试验
对数期的细菌细胞的溶液(金黄色葡萄球菌、枯草芽孢杆菌和大肠杆菌)经过合适浓度稀释后,分别在含有空白PLGA、TPE、Ag NPs、PLGA-Ag、PLGA-TPE和PLGA@TPE@Ag的溶液中孵育1 h。然后涂布于LB-琼脂平板,PLGA、TPE、Ag NPs、PLGA-Ag、PLGA-TPE作为对照组,无任何处理的细胞作为空白组。通过计数菌落形成单位(CFU)来统计存活细胞数量。
不同材料溶液(PLGA、TPE、Ag NPs、PLGA-Ag、PLGA-TPE、PLGA@TPE@Ag、氨苄青霉素和卡那霉素溶液)的最小抑制浓度(MIC)是利用液体浑浊度培养法进行评估测定的。简言之,将对数期的金黄色葡萄球菌和大肠杆菌接种在含有不同材料梯度稀释液的液体LB培养基里,并在37 ℃、200 rpm培养12 h。之后将每组药物对应的试管进行浑浊度对比。MIC值被定义为可以抑制细菌的最低药物浓度。每种材料溶液对应的两种细菌分别进行3次重复试验,MIC最终值取3次平均值。
1.9 LIVE-DEAD试验
对数期耐药性大肠杆菌和金黄色葡萄球菌与PLGA@TPE@Ag(20 μg/mL)共同孵育1 h后,继续在37 ℃、200 rpm培养12 h。同样浓度的TPE、Ag NPs、PLGA-TPE和PLGA-Ag处理的细胞作为对照组,不作任何处理的细胞作为空白组。培养结束后,收集细菌细胞并使用PBS(0.1 M)洗去培养基两次。使用LIVE/DEAD细菌试剂盒(SYTO9和碘化丙啶(PI),Life Technologies)在黑暗中染色细菌30 min,染色结束后继续使用PBS(0.1 M)洗涤细胞两次,目的是除去多余的染色液。吸取5 μL稀释至合适浓度的细胞悬浮液滴在载玻片上,在荧光显微镜下观察染色后的细胞。
1.10 超薄切片试验
对数期耐药性大肠杆菌和金黄色葡萄球菌与PLGA@TPE@Ag(20 μg/mL)共同孵育1 h后,继续在37 ℃下,200 rpm培养12 h。同样浓度的TPE、Ag NPs、PLGA-TPE和PLGA-Ag处理的细胞作为对照组,不作任何处理的细胞作为空白组。培养结束后,收集细菌细胞(3 000 rmp,5 min)并用PBS(0.1 M)洗涤两次。然后用2.5%戊二醛溶液(w/v)和2%多聚甲醛(w/v)4 ℃过夜固定,次日同样使用PBS(0.1 M)洗涤细胞两次。最后通过透射电镜观察复合载药体系作用细胞后的细胞内部形态的变化。
1.11 毒性试验
对PLGA@TPE@Ag的生物毒性进行评估,主要是通过探究小鼠重要器官(心、肝、脾、肺和肾)受到的损伤情况来断定。主要的检测手段是对器官切片进行HE染色,观察组织损伤情况。将小鼠分为两组试验,第一组为空白组,仅仅使用PBS处理小鼠;第二组为PLGA@TPE@Ag,注射剂量为2 mg/kg,连续30天对小鼠进行注射。30天后安乐死处死小鼠,收集所有组小鼠的重要器官并进行HE染色。
2 结果与分析
2.1 表征
合成了一种共载TPE衍生物及纳米银的PLGA复合载药体系,该纳米载药体系的表征结果如图1所示。首先对Ag NPs、PLGA、PLGA-TPE和PLGA@TPE@Ag的紫外分光光谱图进行检测分析,结果如图1a所示。由图1a可知,PLGA-TPE相对于空白的PLGA,其特征峰有明显的红移,红移大约为10 nm左右,此结果说明PLGA包裹TPE是成功的。同时再比较Ag NPs和PLGA@TPE@Ag的特征峰的位置,明显发现Ag NPs被包裹进PLGA载药体系内后,其特征峰发生90 nm的位移。图1a结果可作为PLGA@TPE@Ag成功合成的主要判定方法之一。PLGA载药后的粒径的分布情况结果如图1b所示。 由图1b可知,空白的PLGA和PLGA@TPE@Ag的平均粒径的大小是类似的,大约在300 nm左右,从分布情况来说,PLGA@TPE@Ag更加集中。载药体系形态是通过电镜直接观察得到,结果如图1d和图1e所示。图1d是空白的PLGA NPs,可观察到形态大小几乎一致,分散均一,形态呈现圆形结构,表面光滑;图1e是PLGA@TPE@Ag的透射电镜图像,结果可发现大小和空白的PLGA几乎一致,且形态方面也类似,可明显观察到PLGA@TPE@Ag内部颜色较深的核心区域。此结果的出现间接证明了其包裹的原子序数较高的Ag和TPE中的元素存在。同时我们也通过透射电镜观察了Ag NPs的形态,其大小在5 nm左右(见图1c)。综上所述,表征的相关试验证明了共载TPE衍生物及Ag NPs的PLGA复合载药体系成功合成,其粒径大小在300 nm左右,分散均一,形态呈现光滑的圆形结构。
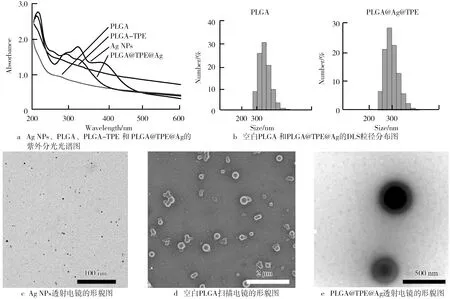
图1 PLGA@TPE@Ag的表征试验结果
2.2 PLGA复合载药体系药物缓释研究
PLGA包裹的小分子药物具有药物缓释的特性,药物缓释可将包裹的药物以适当的浓度持续地释放出来,使治疗效果达到最大值,不会对机体产生大的毒性损伤,结果如图2所示。研究了Ag NPs和TPE两种药物的缓释,结果可以看出未包裹的Ag NPs在20 h内,其释放达到80%左右,说明单纯的Ag NPs没有药物缓释特性。而PLGA包裹后的Ag NPs,其药物释放明显减缓,前24 h药物释放仅仅达到32%,且后期三天的内释放也是缓慢的,符合药物缓释特性。同样的释放曲线出现在PLGA@TPE@Ag载药体系中,其释放的Ag NPs比例相对于PLGA包裹后的Ag NPs略微下降,但是差别不是很明显。由图2a可知,PLGA复合载药体系具有药物缓释特性且可间接判断PLGA@TPE@Ag包裹Ag NPs含量相对于PLGA-Ag是相差无几的。TPE的药物缓释曲线如图2b所示。由图2b可知,结果与Ag NPs缓释曲线类似,PLGA复合载药体系具有药物缓释特性且可间接判断PLGA@TPE@Ag包裹TPE含量相对于PLGA-TPE是相差无几的。说明其PLGA复合载药体系相对于单载药体系,其总载药量是明显增加的,结果如表1所示。在PLGA纳米体系的载药量和包封率的试验测试结果中,PLGA@TPE、PLGA@Ag和PLGA@TPE@Ag包封率分别是68±2.8%、62±1.3%和73±0.9%,载药量分别是18±2.5%、22±1.1%和35±3.7%。共载TPE衍生物及纳米银的PLGA复合载药体系具有明显的药物缓释特性。通过载药量和药物释放结果也明确了复合载药体系的载药量明显高于单一的载药量。
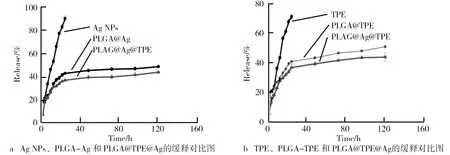
图2 PLGA@TPE@Ag缓慢释放测试结果

表1 PLGA纳米载药体系的包封率和载药量
2.3 抑菌活性初步探究
在MIC试验研究中,结果如表2所示。PLGA@TPE@Ag对大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌MIC值分别是2.3±0.09 μg/mL、1.9±0.04 μg/mL和1.2±0.05 μg/mL。卡那霉素抑制三种细菌的MIC值分别为0.8±0.03 μg/mL、0.2±0.01 μg/mL和0.5±0.01 μg/mL,氨苄青霉素抑制三种细菌的MIC值分别为12.3±0.17 μg/mL、3.9±0.08 μg/mL和0.3±0.03 μg/mL。此结果说明PLGA复合载药体系对细菌具有高效的抑制活性,且具有一定的广谱抑菌效果。单纯的TPE对三种细菌的抑制活性较低,这和其极低的水溶性的关联是分不开的。空白的PLGA是不会对细菌产生任何抑制活性的,因此可排除该材料的抑菌活性影响。PLGA@TPE@Ag的抑菌活性优于单一的载药体系(PLGA-TPE和PLGA-Ag),此现象也说明了复合载药体系的优越性。
CFU试验结果如图3所示。图3a中是PLGA@TPE@Ag对大肠杆菌的CFU试验结果,由图3a可知,PLGA@TPE@Ag质量浓度在20 μg/mL时对大肠杆菌的菌落生成的抑制率达到98%以上,而单纯的相同浓度的TPE仅仅为72%,Ag NPs为38%;单一载药的PLGA-TPE和PLGA-Ag也具有一定的抑制率,效果分别是28%和26%。此结果说明了单一载药体系的纳米材料对大肠杆菌的抑菌活性低于复合载药体系,单一载药的PLGA-TPE和PLGA-Ag有类似的抑菌效果,间接说明水溶性被逆转的TPE本身也具有较强的抑菌活性。类似的结果也出现在图3b中,在抑菌试验的初步研究中可得知PLGA@TPE@Ag展现较强的抑菌活性,相对于单一的载药体系,说明PLGA复合载药体系是成功的。

表2 大肠杆菌、金黄色葡萄球菌、枯草芽孢杆菌的最小抑制浓度数值
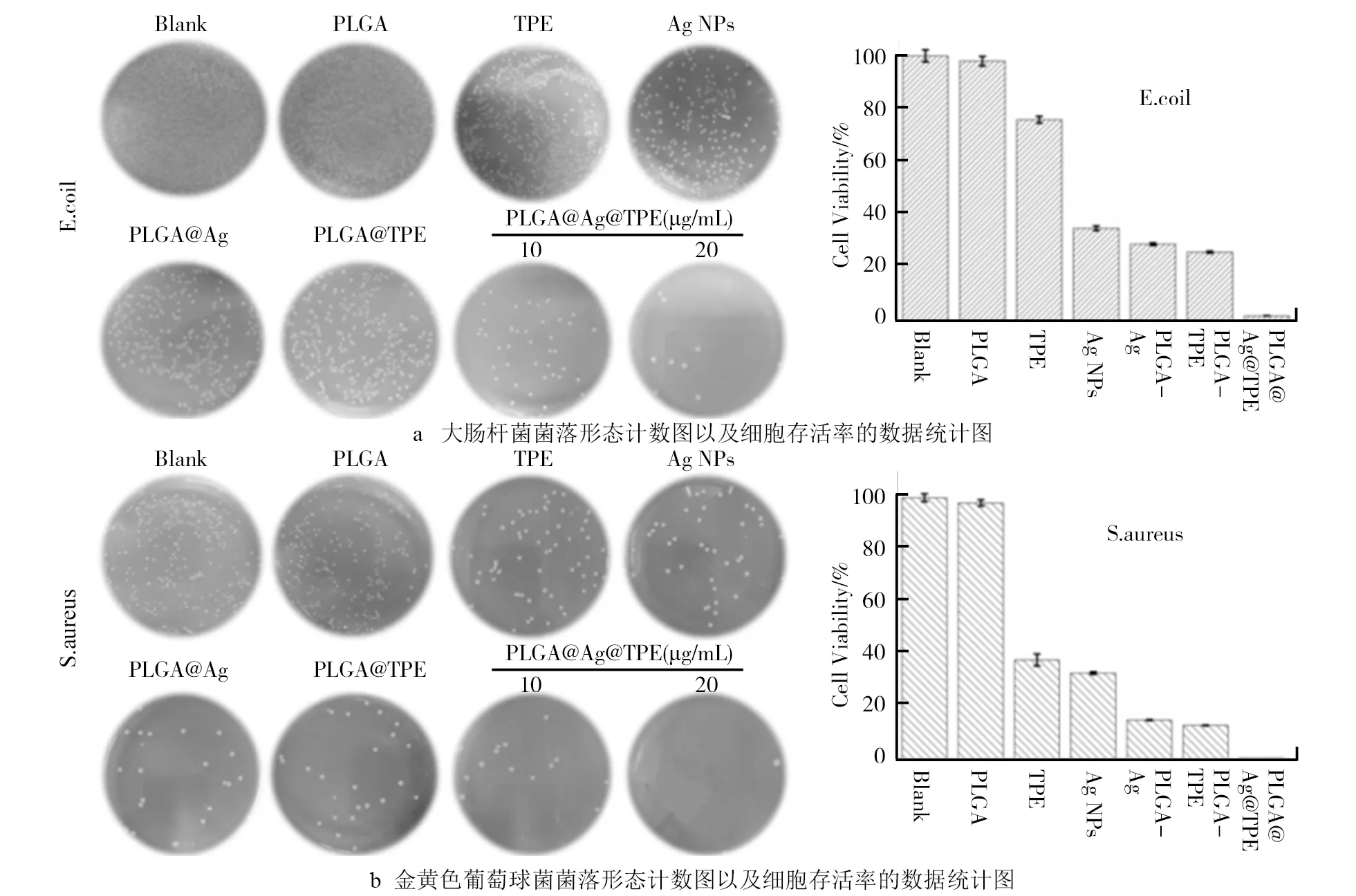
图3 PLGA@TPE@Ag抑菌活性试验结果注:没有任何处理的两种细菌细胞的CFU为空白组、PLGA、TPE、Ag NPs、PLGA@TPE和 PLGA@Ag为对照组(20 μg/mL)。
2.4 细胞凋亡率测定
利用荧光染料对药物处理的细胞进行染色,活细胞可被SYTO9染色成绿色荧光细胞,死细胞可被PI染色成红色荧光细胞,通过共定位处理后可直观地观察到细胞死亡比例。PLGA@TPE@Ag(20 μg/mL)处理后耐药性大肠杆菌和金黄色葡萄球菌细胞的荧光共聚焦成像图分别如图4a与图4b所示。同样浓度的TPE、Ag NPs、PLGA-TPE和PLGA-Ag作用的细胞的染色结果作为对照组,细胞不经过任何处理的作为空白组。由图4可知,TPE组含有少量的红色荧光细胞,说明其导致了部分细胞的凋亡。相对于TPE组,Ag NPs、PLGA-TPE和PLGA-Ag三组中出现的红色荧光细胞明显增多,说明三者的抑菌活性是增强的,PLGA-TPE组抑菌活性的增强说明PLGA包裹TPE后,提高了TPE的抑菌活性。Ag NPs和PLGA-Ag类似的抑菌活性,说明PLGA包裹Ag NPs后形成的单一载药体系对该纳米粒子抑菌活性的提高是不明显的。通过观察复合载药体系PLGA@TPE@Ag作用细菌后的荧光共定位图像可得知,大部分的细菌均被染色成红色荧光,说明细胞已经凋亡。复合载药体系PLGA@TPE@Ag对耐药性的大肠杆菌和金黄色葡萄球菌的抑制率可达95%以上,该复合载药体系的抑菌活性得到进一步地肯定。
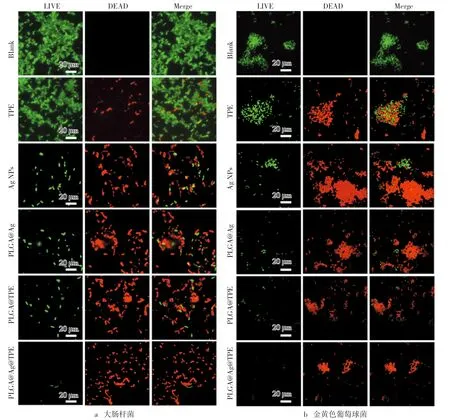
图4 PLGA@TPE@Ag荧光共聚焦成像图注:TPE、Ag NPs、PLGA@TPE和PLGA@Ag为对照组(20 μg/mL)。SYTO 9(绿色荧光)和PI(红色荧光)染色细胞(30 min)。细胞不经过任何处理的作为空白组。
2.5 细胞内部形态的研究
在进行了超薄切片试验,观察复合载药体系作用细胞后其内部形态的变化,结果如图5所示。大肠杆菌和金黄色葡萄球菌的空白组细胞保持完整的内部细胞形态,胞内的细胞核和其他细胞器是清晰存在的。TPE组少部分的细胞区域出现破损,细胞基本保持完整性,说明TPE对细胞具有一定的破坏。但是在Ag NPs、PLGA-TPE和PLGA-Ag组中细胞开始出现大面积的破损,胞内物质出现,细胞出现部分空洞情况。此结果说明了三者具有一定的抑制活性。复合载药体系PLGA@TPE@Ag组中,大肠杆菌和金黄色葡萄球菌细胞破损的区域非常大,几乎可观察到大部分细胞出现破损情况,内含物流出,无完整的细胞形态,细胞变得非常空洞。复合载药体系PLGA@TPE@Ag相对于单一载药体系(PLGA-TPE和PLGA-Ag),其抑菌活性又得到较大的提高,说明相同浓度下复合载药体系的抑菌活性更强。复合载药体系PLGA@TPE@Ag可破坏细胞的内部形态,这也有可能是导致其细菌被抑制存活的主要机制。
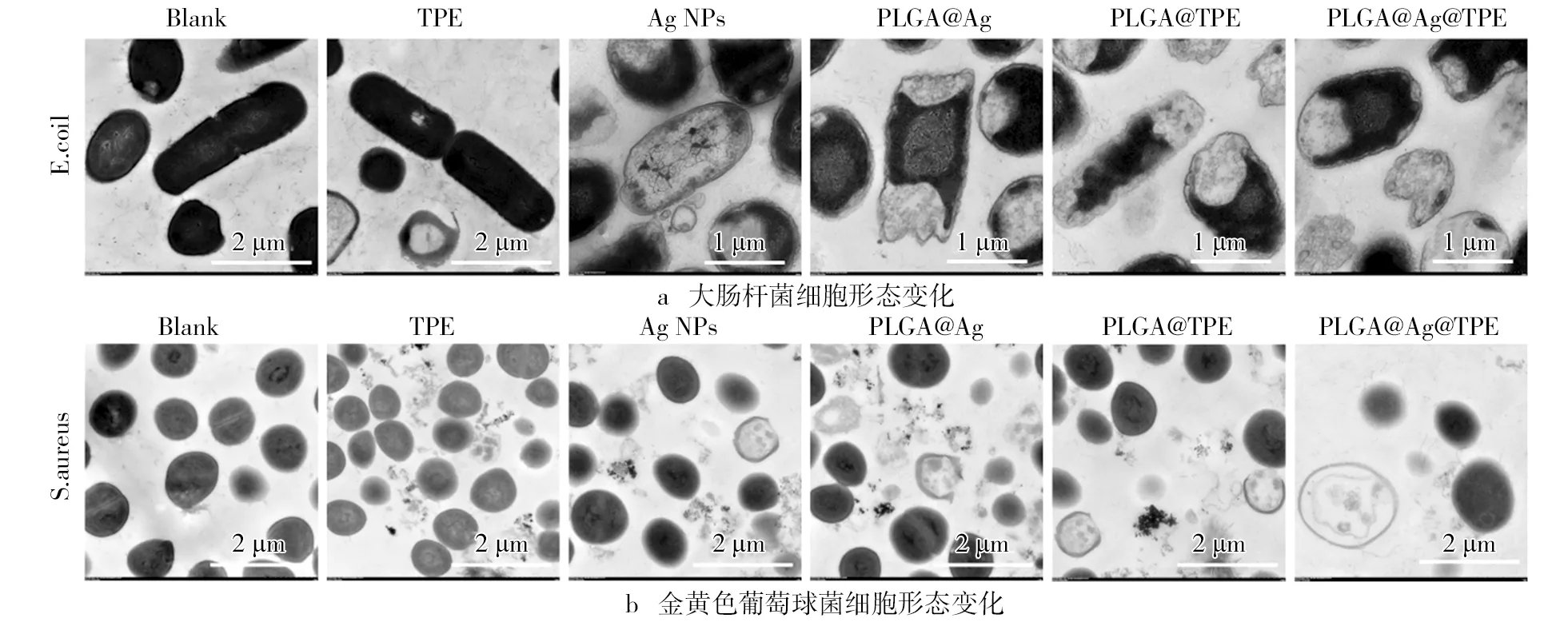
图5 PLGA@TPE@Ag超薄切片试验结果注:TPE、Ag NPs、PLGA-TPE和 PLGA-Ag(20 μg/mL)作用的细胞被设置成对照组,无任何处理的细胞设置成空白组。
2.6 毒性分析
复合载药体系PLGA@TPE@Ag在体内体外均展现较强的抑菌活性,是一种潜在的纳米级的药物。但是作为潜在的纳米级药物,其生物毒性是必须要考虑的主要因素。因此通过免疫组化,将PLGA@TPE@Ag连续注射正常小鼠30天,观察小鼠器官组织学变化,从而来判定该纳米体系药物会不会对小鼠造成很大的损伤,结果如图6所示。通过与空白组对比,主要器官的HE染色结果是完全类似的,全部展现较好的生理学特征,无任何的细胞凋亡、组织水肿、组织损伤情况。此结果说明该复合载药体系PLGA@TPE@Ag对小鼠是无任何毒性的,可作为一种潜在的纳米级的抗菌药物。

图6 小鼠HE组织染色评估PLGA@TPE@Ag毒性结果注:使用1 mL PBS(0.1 M)处理的小鼠设置为空白组,使用2 mg/kg 剂量的PLGA@TPE@Ag处理小鼠设置为处理组。
3 小结
研究成功合成了复合纳米载药体系PLGA@TPE@Ag。由共载TPE衍生物及Ag NPs的PLGA复合载药体系的表征试验结果可知,其粒径大小在300 nm左右,分散均一,形态呈现光滑的圆形结构。作为一种包裹型的纳米粒子,其载药量达到了35±3.7%,包封率为73±0.9%。通过相关的药物缓释肯定了复合纳米载药体系PLGA@TPE@Ag具有明显的药物缓释特性。通过载药量和药物释放结果也明确了复合载药体系的载药量明显高于单一的载药量,其抑菌活性相对于单一的载药体系理论上也会有极大的提高。PLGA@TPE@Ag对耐药性的大肠杆菌、枯草芽孢杆菌和金黄色葡萄球菌MIC值分别是2.3±0.09 μg/mL、1.9±0.04 μg/mL和1.2±0.05 μg/mL。PLGA@TPE@Ag浓度在20 μg/mL时对金黄色葡萄球菌和大肠杆菌的菌落生成的抑制率都高达90%以上。通过荧光染色试验也进一步肯定了复合载药体系PLGA@TPE@Ag对耐药性的大肠杆菌和金黄色葡萄球菌的抑制。该合成的载药体系PLGA@TPE@Ag对形态的破坏是明显的,这一点也有可能是导致其细菌被抑制存活的主要机制。在毒性试验探究中,PLGA@TPE@Ag注射的小鼠的主要器官的HE染色结果展现较好的生理学特征,无任何的细胞凋亡、组织水肿和组织损伤情况。

