浅论β-内酰胺类抗生素对肺结核的治疗
桑嘉翌
(西安高新第三中学 陕西西安 710000)
肺结核由结核杆菌引起,通过活性肺结核患者打喷嚏,咳嗽等方式,散播在空气中,然后经呼吸道进入健康人群的肺部[1],接着人体免疫系统的巨噬细胞很快将其捕获,被捕获的大部分结核杆菌都被巨噬细胞杀死,但是仍有少量结核杆菌可以在巨噬细胞里生存下来,如果人体免疫系统正常,结核杆菌将被层层免疫细胞包围,形成一个肉芽肿的组织,以保护人体其他部位不被结核杆菌感染,此时患者不会显示任何肺结核症状,同时不具有传染性,称为潜伏性肺结核[2]。据估计世界上有三分之一的人口患有潜伏性肺结核,其中85%到90%的潜伏性肺结核患者可以终生维持这种状态,但是当其免疫系统不能正常运转,比如癌症患者,艾滋病患者及器官移植患者等,他们转化为活性肺结核的几率会大大提高[3]。活性肺结核就是我们常说的肺结核,临床显示咳嗽,消瘦,盗汗,咳血等症状,同时也具有传染性。对肺结核的治疗,目前通常使用国际健康组织(WHO)推荐的疗法:异烟肼,利福平,吡嗪酰胺和乙胺丁醇一起使用两个月,之后再使用异烟肼和利福平四个月。共计六个月时间[4]。联合用药的主要目的是为了避免耐药菌的产生,尽管如此,当前耐药性肺结核的发展仍然十分迅速,对其的治疗只能使用包括喹诺酮和氨基糖苷类在内的二三线抗结核药物,通常是八到十种不同药物同时用药达两年之久。二三线抗结核药往往毒性大,治疗活性比一线药物差,因此,耐药性肺结核的治愈率低,所以研发新的抗结核药迫在眉睫[5]。
β-内酰胺类抗生素是目前使用最广泛的抗生素[6],最早的β-内酰胺类抗生素是青霉素,也是第一个发现的抗菌药。β-内酰胺类抗生素的作用机理为抑制青霉素结合蛋白(也称为D,D-转肽酶)的活性,从而抑制细菌细胞壁肽聚糖层的合成。其耐药机理一般有两种,第一种,也是最主要的一种,细菌通过分泌β-内酰胺酶,水解青霉素的β-内酰胺环使其失活。第二种,细菌可以改变青霉素结合蛋白的结构,使得β-内酰胺类抗生素无法与靶标结合,从而失去其抗菌活性[7]。为了解决β-内酰胺类抗生素的耐药性问题,药物化学家不断的对其结构进行改造,同时也改善了其抗菌谱窄,化学性质不稳定的特点。目前,根据结构来分,除了青霉素外,还有头孢菌素类(也可称为先锋霉素)、碳青霉烯类和单环内酰胺类抗生素[8]。现在β-内酰胺类抗生素作为广谱抗菌药,对革兰氏阳性菌及革兰氏阴性菌都有杀伤作用。结核杆菌属于特殊的革兰氏阳性菌,其细胞壁肽聚糖的合成也需要青霉素结合蛋白,也就是说正常情况下,青霉素可以抑制结核杆菌的青霉素结合蛋白的活性,从而杀死结核杆菌,但是现实情况却是β-内酰胺类抗生素很少用于肺结核的治疗,本文在此对该现象进行了深入分析。
一、β-内酰胺类抗生素对肺结核无效的原因
(一)结核杆菌的细胞壁
跟普通的革兰氏阳性菌和阴性菌细胞壁相比,结核杆菌的细胞壁干重占其总干重的40%,而大多数革兰氏阳性菌和阴性菌的细胞壁干重占比则分别为5%和10%[9]。结核杆菌细胞壁的主要组成部分是称之为霉菌酸的一类脂肪酸,为分支杆菌属所特有,是至今发现碳链最长的天然脂肪酸,脂肪酸的亲脂性取决于碳链的长度,因此可以推定结核杆菌拥有自然界脂溶性超强的细胞壁[10]。这样的蜡状细胞壁为结核杆菌形成了一层天然的保护屏,阻挡了大多数抗菌药的入侵。
(二)结核杆菌的肉芽肿结构
结核杆菌可以在肺部形成肉芽肿的结构。肉芽肿结构主要是以感染的免疫细胞为内核,然后更多的免疫细胞将其包裹起来,从而保护人体的其他组织不被结核杆菌感染[11]。表面上看来这个肉芽肿组织主要是用于限制结核杆菌的复制与活动,从而保护人体。但是科学家逐渐发现,这样的肉芽肿组织同时也阻挡了抗结核药物接触到其内部的结核杆菌,因此在某种程度上对结核杆菌也产生了保护作用[12]。
(三)结核杆菌的其他保护机制
结核杆菌有高度发达的外排泵系统,主要功能是将有毒的物质或代谢废物排到细菌外面。当细菌将抗生素排到细胞外面时,抗生素就很难在细菌内部积累,达到杀菌所需要的浓度。这样一来,细菌没有被杀死,反而衍生出耐药性菌,因此结核杆菌的耐药性与这个外排泵系统有关[13]。此外结核杆菌的复制周期长达20个小时左右,然而大多数细菌的复制周期,如大肠杆菌则在20秒之间。鉴于大多数抗菌药的靶标都是针对细菌的复制周期,因此繁衍慢的细菌天然就对大多数抗菌药有抵抗作用。综合以上几点原因,当医生发现β-内酰胺类抗生素对肺结核无效的时候并没有感到非常意外。
(四)结核杆菌分泌的β-内酰胺酶
科学家在研究耐药性肺结核时,发现同时使用β-内酰胺类抗生素与克拉维酸对其有效。这样之前关于β-内酰胺类抗生素对肺结核无效原因的推论就不能成立[14]。后来通过研究发现,该类抗生素对肺结核无效的真正原因是结核杆菌可以表达大量的β-内酰胺酶,该酶可以水解青霉素类抗生素的β-内酰胺环从而使其失活。而当β-内酰胺类抗生素与克拉维酸同时使用的时候,克拉维酸可以结合β-内酰胺酶,与其形成不可逆的复合物,使β-内酰胺酶失活[15]。从而减小该酶对于β-内酰胺类抗生素的影响,因此β-内酰胺类抗生素与克拉维酸合用时对肺结核就产生了治疗效果。
二、β-内酰胺类抗生素对持留结核杆菌的影响
(一)持留性结核杆菌
在治疗结核病的过程中发现,有一些结核杆菌始终不能被杀死,这类结核杆菌在人体内可以调整其代谢状态,转化为休眠或代谢慢的结核杆菌,我们称之为持留结核杆菌[16]。持留结核杆菌是造成结核病复发率高,治疗周期长的主因。而肺结核的长治疗周期不仅给病人造成很大的药物负担,同时也导致大多数病人不能完成肺结核的治疗周期。治疗周期的缩短为残存在病人体内的结核杆菌发生基因突变提供可能,从而进一步导致耐药性肺结核的产生。因此可以推断持留性结核杆菌不仅是导致肺结核治疗长周期的关键,也是造成耐药性肺结核加剧的主要因素。当前一线抗结核药物中异烟肼,乙胺丁醇只对代谢正常的结核杆菌有效,而对持留菌无效[71],剩下的一线药物中吡嗪酰胺被证实有抑制持留性结核杆菌的疗效,利福平对代谢时快时慢的结核杆菌有杀伤作用[17]。事实上,在最初研究抗结核的治疗方法时,随着利福平和吡嗪酰胺的加入,肺结核的治疗周期有原先的1到2年缩短到6到8个月[18]。这就证明了对持留菌有效的药物可以大幅度的缩小肺结核的长治疗周期。但是随着异烟肼及利福平耐药菌的出现,我们需要研发出新的抑制持留菌的药物[19]。
(二)结核杆菌的L,D-转肽酶
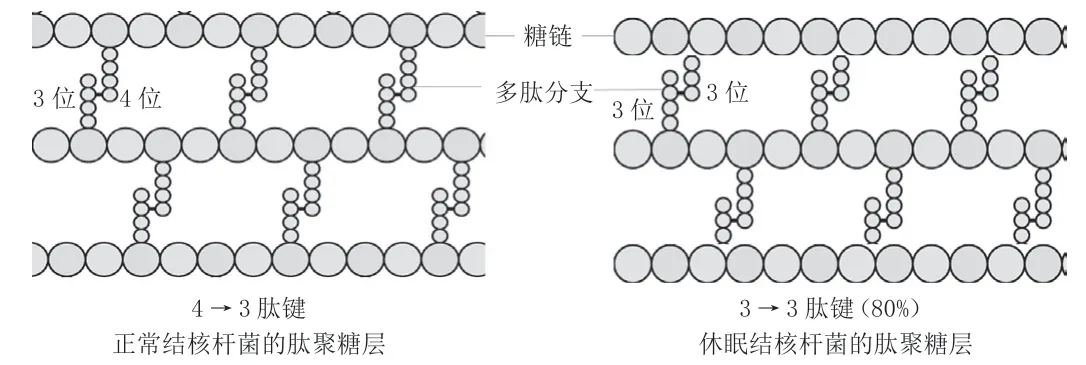
图1 结核杆菌肽聚糖层的结构
细菌细胞壁的肽聚糖层是由糖链和多肽分支组成,多肽链之间有肽键链接(图1)。对于正常的细菌来说,该肽键为4→3位的氨基酸连接而成,由D,D-转肽酶合成,也就是俗称的青霉素结合蛋白,即β-内酰胺类抗生素杀菌的作用靶标。而持留性结核杆菌80%的肽链分支由3→3位的氨基酸连接,由L,D-转肽酶合成[20]。研究发现,碳青霉烯类的抗生素可与该酶结合为不可逆的复合物,从而抑制其活性。因此,该类抗生素可作为抗结核药物研发的先导物,进行深入的结构优化,也许可以发现新的对持留性结核杆菌有活性的药物。
三、结束语
综上所述,β-内酰胺类抗生素与克拉维酸合用时对耐药性肺结核有效,另外持留性结核杆菌是造成肺结核长治疗周期和耐药性加剧的主要因素,因此找到对持留菌有效的药物至关重要。而研究发现碳青霉烯类抗生素有望成为研发抗持留结核菌的先导物。相信在不久的将来,该类抗生素会对肺结核的治疗做出应有的贡献。

