外用红色诺卡氏菌细胞壁骨架效力测试实验方法的研究
窦 恒, 樊 华, 王秀英, 佟东辉,曲 晶,王 丹,孙 鹤,张怡轩
(1.沈阳药科大学 生命科学与生物制药学院,辽宁 沈阳 110016;2.辽宁格瑞仕特生物制药有限公司,辽宁 本溪 117004;3.辽宁省检验检测认证中心 辽宁省药品检验检测院,辽宁 沈阳 110030)
外用红色诺卡氏菌(Nocardiarubra)细胞壁骨架是一种非特异性免疫调节剂,具有增强体内巨噬细胞和自然杀伤细胞的免疫活性[1],有效促进免疫细胞吞噬和杀灭病原体,提高人体抗感染的能力[2],可以迅速消除局部炎症,加快糜烂面的愈合[3]。巨噬细胞是机体免疫系统中具有抗原递呈功能的细胞之一,具有直接吞噬和杀伤病原体和肿瘤细胞的功能[4],还具有参与抗原加工、递呈免疫调节的重要作用,检测巨噬细胞吞噬功能对于判断巨噬细胞的功能,了解机体的特异性和非特性免疫状态具有重要作用[5]。原有外用红色诺卡氏菌细胞壁骨架检测巨噬细胞吞噬情况的方法为先将B/C小鼠两次免疫后,腹腔注入鸡红细胞与巨噬细胞共同作用数小时,抽取腹腔液共同孵育染色,显微镜下观察,计算巨噬细胞的吞噬率和吞噬指数,以此判断巨噬细胞的吞噬功能。该检验方法统计学上差异明显,可作为日常检验的依据。但由于需要操作者显微镜下计数,人工涂片及观察,人工选择观察视野,因此受主观因素影响较大;另外观察的细胞数量有限,方法的灵敏度和准确度都有所降低。近年来,文献报道有学者应用流式细胞术检测巨噬细胞吞噬功能,如荧光微球法、FITC标记大肠埃希菌法等[6]。流式细胞仪技术用于巨噬细胞的吞噬率检测可以轻易地将观察细胞数从几百提高至几千[7],而且具有分析速度快、重复性好和特异性强等优点[8]。荧光微球被细胞吞噬后,其荧光信号可迅速被流式细胞仪检测,具有荧光信号的巨噬细胞即视为出现吞噬现象,可快速、准确地测定巨噬细胞的吞噬率[9]。本研究探索了外用红色诺卡氏菌细胞壁骨架两种新的效力测定方法,即流式细胞术-荧光微球法和流式细胞术-免疫双标法(荧光微球+荧光抗体),并与国家食品药品监督管理局批准的方法进行比较,为该药品测定方法的改进提供参考。
1 材料与方法
1.1 材料
1.1.1 药品来源 外用红色诺卡氏菌细胞壁骨架(Nr-CWS),批号201605001、201701001、201806001;成分为阿拉伯半乳聚糖、胞壁酸和粘肽等,辅料为右旋糖酐40;性状为白色疏松状体或粉末;生产公司为辽宁格瑞仕特生物制药有限公司。
1.1.2 实验小鼠 SPF级BALB/C鼠,雌性,21~24 g,北京维通利华实验动物技术有限公司提供。
1.1.3 实验材料 羧酸基修饰荧光微球(黄绿色,直径2.0 μm,美国Invitrogen公司);BSA(牛血清白蛋白,规格1 g,北京奥博星生物技术有限责任公司);F480荧光抗体(成熟小鼠巨噬细胞标志物,规格0.1 mg,美国BD Pharmingen公司);同型抗体(成熟小鼠巨噬细胞标志物,规格0.1 mg,美国BD Pharmingen公司);Giemsa(吉姆萨色素,规格 1 g,国药集团化学试剂有限公司);一次性无菌注射器(1、2、5、10 mL)、洗瓶、染缸、搪瓷盒(金属盒/载玻片湿盒)、纱布、载玻片、移液枪(200 μL)、枪头(200 μL)、眼科手术剪、眼科手术镊子、100 mL锥形瓶,一次性静脉输液针、棉球、10 mL玻璃离心管、勾菌环。75%乙醇、甲醇、无水乙醇、姬姆氏色素(希格玛)、甘油、香柏油。5%鸡红细胞(辽宁格瑞仕特生物制药有限公司提供)。
1.1.4 主要仪器与设备 流式细胞仪(C6 plus,美国BD公司);生化培养箱(IPP260,美国Memmert公司);超声器(HU-10260B,天津恒奥科技发展有限公司);恒温水浴(SW22,德国Julabo实验设备公司);恒温水浴锅(DK-98-II,天津泰斯特);低速台式离心机(TDL-80-2B,上海安亭);双目显微镜(DM3000,德国莱卡)。
1.2 方法
1.2.1 显微镜观察法 ①样品制备:将红色诺卡氏菌细胞壁骨架溶于生理盐水中,分别制成浓度为100和50 μg/mL的红色诺卡氏菌细胞壁骨架样品溶液。②5%鸡红细胞的制备:用10 mL注射器吸取3 mL阿氏液,从鸡翅静脉采血,于阿氏液中4 ℃贮存。将贮存于阿氏液中的鸡血混匀,并取出一定量含鸡红细胞的阿氏液1 500 r/min离心5 min,弃上清,再加0.9%氯化钠注射液至原量,混匀鸡红细胞,1 500 r/min离心5 min,用0.9%氯化钠注射液共洗3次,第3次同速离心10 min,弃上清,并用0.9%氯化钠注射液配成5%鸡红细胞悬液,4 ℃贮存,使用前镜检,发生溶血弃去。③操作:将检疫合格的BALB/C鼠,随机分为供试品高剂量组(100 μg/mL)、供试品低剂量组(50 μg/mL)和正常对照组,供试品组分别于第1天和第6天腹腔注射红色诺卡氏菌细胞壁骨架样品溶液0.2 mL/(只·次);末次注射后第4天,腹腔注射新配制的5%鸡红细胞,2 h后,颈椎脱臼处死小鼠。沿正中线剪开腹壁皮肤,经腹膜注入0.9%氯化钠溶液,轻揉后,吸取腹腔液1.0 mL,分别滴于两张载玻片上并涂匀,放入湿盒,温箱孵育30 min后,固定5 min,浸于Giemsa染液中染色10 min,然后水洗。④检测:待载玻片干后,将其置于显微镜下观察、镜检并计数。⑤判定标准:鸡红细胞呈椭圆、具细胞核,染色后胞浆呈粉红色,核呈紫蓝色;中性粒细胞核呈蓝色,胞浆呈浅紫色,颗粒呈蓝紫色;嗜酸性粒细胞的颗粒呈红色;嗜碱性粒细胞核呈暗蓝色,颗粒呈暗紫红色。实验以吞噬率和吞噬指数表示小鼠巨噬细胞的吞噬能力。显微镜法吞噬率和吞噬指数按公式(1)和(2)计算。应用统计学分析数据进行分析,其中吞噬率采用卡方检验,采用独立样本t检验进行吞噬指数两两比较,如供试品组的吞噬率或吞噬指数与正常对照组的吞噬率或吞噬指数比较,有显著性差异,方可判定该供试品效力实验阳性。


1.2.2 流式细胞术-荧光微球法 ①荧光微球的制备:应用1%的BSA溶液(稀释200倍)制备含微球溶液。37 ℃避光孵育30 min,超声5 min。临用现配。②实验步骤:检疫合格的BALB/C鼠,雌性,21~24 g,随机分为供试品组和正常对照组。各实验组分别于第1天、第6天腹腔注射相应药液0.2 mL/(只·次)免疫小鼠;末次免疫后第4天(加鸡红细胞实验小鼠需在麻醉前2 h腹腔注射新配制的5%鸡红细胞各0.5 mL),取各组小鼠麻醉至小鼠不再挣扎,浸泡消毒3 min。腹腔注射生理盐水3 mL/只,轻轻按揉腹部,将腹壁剪开一个小口,吸取腹腔洗液2 mL用75 μm过滤器过滤至试管内,调整巨噬细胞数为(4~6)×105/mL。移液枪吸取1 mL腹腔洗液于6孔培养板中,加入已经预调理过的荧光微球,37 ℃二氧化碳细胞培养箱避光孵育90~120 min,孵育结束后弃上清(含未贴壁细胞和多余荧光微球),每次使用1.0 mL生理盐水轻轻洗涤2次,去上清后再加入4 ℃生理盐水0.3 mL,用细胞刮刮下贴壁细胞,轻轻吹打均匀后经75 μm过滤器过滤后上机分析。③流式细胞术检测分析[10]:a.设门:首先设立APC-SSC二维散点图,通过调节APC和SSC电压值,以巨噬细胞设门界定分析的巨噬细胞群,最大限度地排除其他有核细胞、细胞碎片等的干扰;b.获取:在荧光微球发射光的荧光通路检测巨噬细胞的荧光强度,每份样本获取5 000个巨噬细胞,数据可显示于二维散点图和直方图中。在二维散点图中可通过设门圈定未吞噬荧光微球的巨噬细胞群和吞噬荧光微球的巨噬细胞群;在直方图中可通过标尺标定未吞噬荧光微球的巨噬细胞群和吞噬荧光微球的巨噬细胞群,全部数据经相关软件分析未吞噬荧光微球的巨噬细胞和吞噬不同数量荧光微球的巨噬细胞的比例[11]。④考察鸡红细胞对流式细胞术-荧光微球双标法的影响实验[12]:同流式细胞术-荧光微球法的相关操作,同时做1组不加5%鸡红细胞的供试品组高剂量组、供试品组低剂量组和正常对照组。⑤判定标准:应用统计学分析数据进行分析,其中吞噬率采用卡方检验,采用独立样本t检验进行吞噬指数两两比较,如供试品组的吞噬率或吞噬指数与正常对照组的吞噬率或吞噬指数比较,有显著性差异,方可判定该供试品效力实验阳性。
1.2.3 流式细胞术-免疫双标法(荧光微球+荧光抗体) ①制备样品:将红色诺卡氏菌细胞壁骨架溶于生理盐水中,分别制成质量浓度为100和50 μg/mL的红色诺卡氏菌细胞壁骨架样品溶液。将检疫合格的BALB/C鼠,随机分为供试品高剂量组(100 μg/mL)、供试品低剂量组(50 μg/mL)和正常对照组。供试品组分别于第1天和第6天腹腔注射红色诺卡氏菌细胞壁骨架样品溶液0.2 mL/(只·次);末次注射后第4天,取供试品高剂量组、供试品低剂量组和正常对照组小鼠,依次放入装有乙醚棉球的离心管,麻醉至小鼠不再挣扎。将小鼠放入装有75%乙醇的烧杯中,浸泡消毒3 min后,将小鼠放入紫外灭菌后的超净台上,手术暴露腹腔膜,通过腹腔壁注入3 mL生理盐水。反复按摩小鼠腹部后,分别吸取腹腔液2.0 mL,备用。②制备荧光微球:将羧酸基修饰荧光微球用BSA溶液稀释,制备羧酸基修饰荧光微球BSA溶液,避光孵育30 min后,超声5 min。③操作:将超声后的羧酸基修饰荧光微球BSA溶液,均匀分配到6孔板上,同时准确加入获得的腹腔液,冲匀微球,上下左右平行移动6孔板,使液体充分混合,然后置于生化培养箱中避光孵育2.5 h;将培养后的6孔板取出,弃上清,加入生理盐水洗涤,用细胞刮刮取细胞,吸入EP管中,并加入F480抗体[13]混匀,经过滤器过滤,取滤液。④流式细胞术检测分析[14]:分别根据F480荧光抗体和同型抗体细胞对R1门进行调整,确定R1门后其他操作同2.2.3流式细胞术检测分析。⑤判定标准:应用统计学分析数据进行分析,其中吞噬率采用卡方检验、吞噬指数两两比较采用独立样本t检验,如供试品组的吞噬率或吞噬指数与正常对照组的吞噬率或吞噬指数比较,有显著性差异,方可判定该供试品效力实验阳性。
2 结果与分析
2.1 原方法-显微镜观察方法
检疫合格的BALB/C鼠,进行3次重复实验,取三批外用红色诺卡氏菌细胞壁骨架产品,批号为201605001、201701001、201806001,每次随机分成供试品高剂量组、供试品低剂量和正常对照组3组。实验结果见表1~3。

表1 201605001批次外用红色诺卡氏菌细胞壁骨架显微镜法测定结果

表2 201701001批次外用红色诺卡氏菌细胞壁骨架显微镜法测定结果

表3 201806001批次外用红色诺卡氏菌细胞壁骨架显微镜法测定结果
由表1~3可知,采用成熟的显微镜法,三批次外用红色诺卡氏菌细胞壁骨架,高、低剂量供试品组与正常对照组比较吞噬率明显升高(P<0.01)、吞噬指数明显增大[15](P<0.01),判定结果为阳性。
2.2 流式细胞术-荧光微球法[16]
检疫合格的BALB/C鼠,进行3次重复实验,取三批外用红色诺卡氏菌细胞壁骨架产品,批号为201605001、201701001、201806001,每次随机分成供试品高剂量、供试品低剂量和正常对照组3组。实验结果见表4~6。
由表4~6可知,实验数据统计学分析显示,第1次实验100和200 μg/mL供试品组与正常对照组比较呈吞噬率明显升高(P<0.05),吞噬指数明显增大(P<0.01)(表4);而第2次实验100和200 μg/mL供试品组与正常对照组比较呈吞噬率明显降低(P<0.05、P<0.01),吞噬指数明显减小(P<0.01)(表5);第3次实验100和200 μg/mL供试品组与正常对照组比较呈吞噬指数明显升高(P<0.01、P<0.05)(表6),检验结果不稳定。
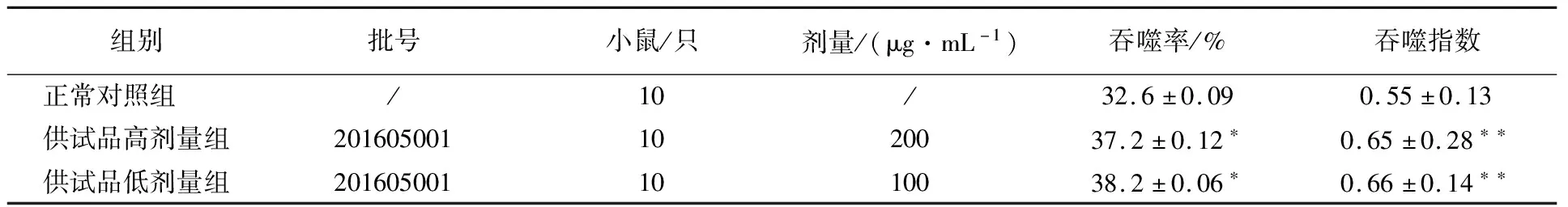
表4 流式细胞术-荧光微球法第1次实验结果

表5 流式细胞术-荧光微球法第2次实验结果

表6 流式细胞术-荧光微球法第3次实验结果
2.3 鸡红细胞对流式细胞术-荧光微球法的影响
加入鸡红细胞的影响实验,检疫合格的BALB/C鼠,进行重复实验,随机分成供试品高剂量组、供试品低剂量组和正常对照组3组。实验结果见表7。由表7可见,各组在加或未加鸡红细胞处理后,吞噬率和吞噬指数数值差异较大,如正常对照组未加鸡红细胞处理的吞噬率为32.60%±0.09%,约为加鸡红细胞处理(12.10%±0.04%)的2倍以上。实验结果提示,5%鸡红细胞对巨噬细胞吞噬荧光微球有干扰,使得最终获得的数据偏小。因此,流式细胞术荧光微球双标法不添加鸡红细胞。

表7 鸡红细胞对流式细胞术-荧光微球法的影响
2.4 流式细胞术-免疫双标法(荧光微球+荧光抗体)
检疫合格的BALB/C鼠,进行3次重复实验,取三批外用红色诺卡氏菌细胞壁骨架产品,批号为201605001、201701001、201806001,每次随机分成供试品高剂量组、供试品低剂量组和正常对照组3组。实验结果分别见图1与表8、图2与表9、图3与表10。
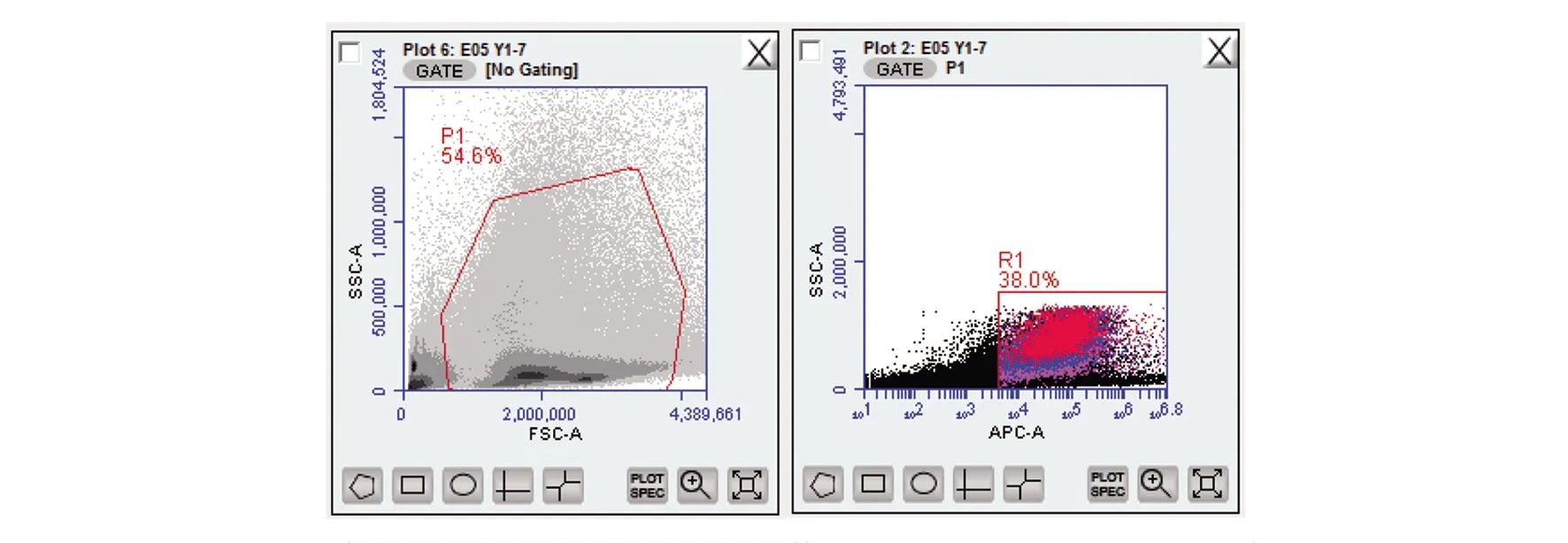
图1 流式细胞术-免疫双标法(荧光微球+荧光抗体)检测数据(201605001)

表8 流式细胞术-免疫双标法(荧光微球+荧光抗体)检测数据(201605001)
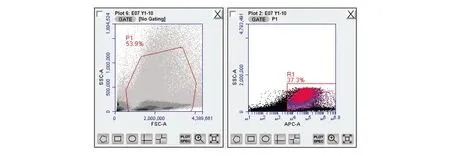
图2 流式细胞术-免疫双标法(荧光微球+荧光抗体)检测数据(201701001)

表9 流式细胞术-免疫双标法(荧光微球+荧光抗体)检测数据(201701001)

表10 流式细胞术-免疫双标法(荧光微球+荧光抗体)检测数据(201806001)

图3 流式细胞术-免疫双标法(荧光微球+荧光抗体)检测数据(201806001)
在流式细胞术-荧光微球法基础上,加入F480荧光抗体,流式细胞术-免疫双标法(荧光微球+荧光抗体)检验结果由表8~10可见,供试品组的吞噬率或吞噬指数与正常对照组的吞噬率或吞噬指数比较,三批外用红色诺卡氏菌细胞壁骨架,高/低剂量供试品组与正常对照组比较吞噬率均明显升高(P<0.01),吞噬指数明显增大(P<0.01、P<0.05),有显著性差异,判定该供试品效力实验阳性。
3 讨 论
流式细胞仪利用荧光抗体与单克隆抗体技术结合的标记技术,保证检测的灵敏度和特异性,利用计算机系统对流动的单细胞悬液中单个细胞的多个参数信号进行数据处理分析,保证了检测速度和统计分析精确度[18]。
以上述两种流式细胞术的实验方法来分析,流式细胞术-免疫双标法(荧光微球+荧光抗体)比流式细胞术-荧光微球法检测更为稳定,检测结果重复性较好。荧光微球能够对具有吞噬功能的巨噬细胞进行识别[19],但检测结果的稳定性较差。加入的F480荧光抗体(成熟小鼠巨噬细胞标志物,EMR1),也称小鼠含生长因子样模体黏液样激素样受体,是一种细胞表面糖蛋白,是成熟小鼠巨噬细胞表面特异性标志物抗体,可用于标记小鼠巨噬细胞,增加了流式细胞仪收集巨噬细胞的准确性,两者结合应用更能准确反映供试品对小鼠巨噬细胞吞噬功能的作用。流式细胞术-免疫双标法(荧光微球+荧光抗体)获取的巨噬细胞数量5 000个远多于显微镜计数的200个巨噬细胞,数据获得快,且客观。
检测巨噬细胞吞噬实验结果以统计学分析数据来判断,其中吞噬率采用卡方检验,吞噬指数两两比较采用独立样本t检验,如供试品组的吞噬率或吞噬指数与正常对照组的吞噬率或吞噬指数比较,有显著性差异,方可判定该供试品效力实验阳性。
显微镜法通过目视多个显微视野,观察计数200个巨噬细胞是否吞噬及吞噬的数量,以吞噬率及吞噬指数的标准值来判定是否有效。而流式细胞术-免疫双标法(荧光微球+荧光抗体)一次性计数5 000个巨噬细胞,根据荧光抗体标记技术,统计巨噬细胞吞噬情况。检测数据以统计学分析,判定药品对比对照组的吞噬效力的结果是否有效。两种方法计数方式不同,统计原理不同,判定结果的方式也不同,因此不需要用显微镜法和吞噬率及吞噬指数的标准值来要求流式细胞术-免疫双标法(荧光微球+荧光抗体)。
鉴于巨噬细胞体外检测的特殊性,利用流式细胞仪开展检验产品的巨噬细胞吞噬情况,是具有可行性的,但目前检验数据及检验方法还需进一步确认,需更多的上机磨合,保证检测的准确性及科学性,本研究提出的方法可为该项检验提供参考。