新疆伊犁野生阿魏菇菌株的分离鉴定与培养特性
木古丽·木哈西, 吾尔恩·阿合别尔迪, 刘 方
(1.南开大学 生命科学学院微生物学系 分子微生物学与技术教育部重点实验室,天津 300071;2.伊犁师范大学 微生物资源保护与开发利用重点实验室, 新疆 伊宁 835000)
阿魏菇(Pleurotusferulae)又名阿魏侧耳、阿魏蘑,属真菌门(Eumycota)担子菌亚门(Basidiomycolina)担子菌纲(Basidiomycetes)伞菌目(Agarieales)侧耳科(Pleurotaceae)侧耳属(Pleurotus),是一种珍稀食、药用菌。我国野生阿魏菇主要分布在新疆塔城和阿勒泰地区[1]。据文献报道,阿魏菇含有丰富的多糖、蛋白质、脂肪酸、维生素和食用纤维,且富含多种矿质元素和微量元素[2]。因其生于阿魏植物根际,故其与阿魏草的医疗效果相似[3]。研究还发现,人工栽培阿魏菇的不同生物活性提取物具有抗氧化、抗炎、抗肿瘤、提高机体免疫力等功效[4-6]。1983年起,我国科学家相继对分布于新疆托里县、木垒县、青河县及石河子地区的野生阿魏菇进行了人工驯化栽培,同时进行遗传分类研究[7-8]。截止目前,还没有关于新疆伊犁野生阿魏菇菌株的分离鉴定与培养特性等方面的相关研究。在前期的伊犁野生阿魏菇资源野外调查中,笔者在分布区采集到两种形态特征各异的野生阿魏菇子实体,如果能成功将其驯化并推广,将具有较高的应用价值。因此,本研究以该两种野生阿魏菇为研究对象,进行菌种分离纯化与鉴定,并对优良菌株的培养条件进行初步筛选,研究结果将对伊犁野生阿魏菇菌种资源的保护利用及我国食用菌资源库的丰富有重要意义。
1 材料与方法
1.1 材料
1.1.1 供试菌株 两种伊犁野生阿魏菇子实体采自新疆伊宁县喀什乡新疆阿魏原生境保护区,地理位置分别为E82°07′32.7″、N43°44′48.7″和E82°06′40.3″、N43°44′28.4″,海拔分别为1 192 m和1 092 m。通过子实体组织分离及菌种纯化,获得伊犁野生阿魏菇菌株YL-A1和YL-A2,并保存于新疆伊犁师范大学微生物资源保护与开发利用重点实验室。
1.1.2 培养基 ①PDA培养基:马铃薯200 g,葡萄糖20 g,琼脂粉20 g,蒸馏水1 000 mL,用于菌种分离、形态特征观察、菌种培养及保藏。②基础培养基:马铃薯200 g,葡萄糖20 g,蛋白胨4 g,KH2PO41 g,琼脂20 g,蒸馏水1 000 mL,用于确定菌丝体最适培养条件。
1.1.3 仪器与设备 立式压力蒸汽灭菌器(YXQ-LS-75SII,上海博讯实业有限公司);隔水电热恒温培养箱(GHP-9050,上海艾牧生物科技有限公司);超净工作台(JJ-CJ-2FD,苏州净化);电子天平(TP-213,北京赛多利斯仪器系统有限公司);高速台式离心机(HC-3018R,安徽中科中佳科学仪器有限公司);琼脂糖水平电泳仪(G500320,上海生物工程股份有限公司);基因扩增仪(TC-48/H(a),杭州博日科技有限公司)。
1.2 方法
1.2.1 菌种分离培养 菌种分离纯化采用组织分离法[9]。将野外采集到的阿魏菇子实体,用75%酒精和1%升汞依次进行表面消毒,在超净台下沿中线切开子实体,切取菌盖与菌柄连接处内部组织数块于PDA培养基平板上,25 ℃恒温避光培养3~5 d,并多次进行菌丝转接,最终获得纯培养物,并进行试管保种。
1.2.2 菌株鉴定 ①子实体形态特征及菌丝拮抗试验:观察菌株YL-A1和YL-A2野生子实体形态,记录其表观特征,参照相关文献[10-11]进行形态学初步鉴定;观察菌丝在平板上的生长情况,记录菌落形状、大小及色泽等特征。将活化后的菌株YL-A1和YL-A2,同时接种于一个PDA平板上相距2 cm左右的位置,3次重复,25 ℃避光培养,观察菌株的生长特性及菌丝间的拮抗情况[12-13]。②基于ITS序列的分子鉴定与系统发育分析:称取约0.5 g野生子实体及菌丝体,液氮冷冻研磨,再使用真菌基因组DNA小量抽提试剂盒(上海生工生物工程有限公司)提取野生子实体和菌丝体的基因组DNA,经凝胶电泳定性检测后,作为模板,用真菌通用引物ITS1F(CTTGGTCATTTAGAGGAAGTAA)和ITS2(GCTGCGTTCTTCATCGATGC)进行PCR扩增[14-15]。扩增体系为10×PCR Buffer 2.5 μL,dNTP(2.5 mmol/L)25 L,引物(10 μmol/L)0.5 μL,TaqDNA聚合酶(5 U/μL)0.25 μL,模板DNA 1 μL,ddH2O补足至25 μL。PCR扩增程序为94 ℃预变性5 min;94 ℃变性30 s,55 ℃退火45 s,72 ℃延伸45 s,共30个循环;最后72 ℃延伸10 min,终止温度为4 ℃。PCR产物经电泳检测后送至测序机构(上海生工生物工程有限公司)。将序列测定结果提交至NCBI(National Center for Biotechnology Information)数据库,获取GenBank登录号,再用BLAST程序进行在线同源性比对,下载相似度较高的已发表序列,以香菇Lentinulaedodes(GenBank登录号:U33092)的ITS序列为外类群,应用MEGA 3.1软件[16],采用邻接法构建系统发育树。
1.2.3 供试菌株YL-A1菌丝生长条件优化的单因素试验 ①温度对菌丝生长的影响:根据前期的预试验,初步确定供试菌株生长的最适温度范围在18~30 ℃之间。采用PDA培养基,在直径为7 cm的平板上接种直径5 mm菌丝块,分别置于18、20、22.5、25、30 ℃下避光培养5 d,每个处理均设置3次重复。按照文献[17]中的方法测量菌落直径后计算菌丝生长速度,同时记录其长势。②pH值对菌丝生长的影响:经前期预实验后,将菌丝块分别接种于pH为6.5、7.0、7.5、8.0、8.5的PDA培养基上,置于25 ℃培养,接种、培养及测量方法同1.2.3①,每个处理3次重复。③碳源对菌丝生长的影响:在基础培养基中分别添加20 g不同的碳源(葡萄糖、蔗糖、麦芽糖、可溶性淀粉和乳糖),接种、培养及测量方法同1.2.3①,每个处理均设置3个重复。④氮源对菌丝生长的影响:在基础培养基中分别添加4 g不同氮源(蛋白胨、酵母浸粉、硝酸钾、硝酸铵、硫酸铵),接种、培养及测量方法同1.2.3①,每个处理3次重复。⑤无机盐对菌丝生长的影响:将基础培养基中1 g KH2PO4,分别用MgSO4、NaCl、CaCl2、KCl替换,接种、培养及测量方法同1.2.3①,每个处理3次重复。
1.2.4 不同培养因子对供试菌株YL-A1菌丝生长影响的正交试验 不同单因子之间的交互作用对菌丝生长会有一定的影响,故在不同温度、碳源、氮源和无机盐等单因素试验结果的基础上,进行L9(34)正交试验,四种单因素及其水平见表1,主要指标为菌丝生长速度,最终筛选各因子之间的最优组合,每组试验设3次重复。

表1 菌株YL-A1菌丝生长正交试验因素与水平
1.2.5 数据统计分析 采用MEGA3.1软件分析ITS序列片段,绘制系统发育树;用Excel和SPSS13.0软件进行数据分析。
2 结果与分析
2.1 伊犁野生阿魏菇菌株鉴定
2.1.1 不同菌株的形态特征及菌丝间的拮抗反应 菌株YL-A1的野生子实体生于新疆阿魏的根茎部土壤(图1A),单生,白色、松软,花瓣形,表面有龟裂花斑,盖缘微向内卷曲,菌盖腹面淡黄色,有葱蒜样臭味(图1B);菌株YL-A2的野生子实体生于经砍伐后剩余的新疆阿魏腐烂根上,群生,淡黄色,近圆形,表面光滑,无龟裂花斑,内实,菌肉奶油色,有葱蒜样臭味(图1C)。二者经分离纯化后的菌落形态无显著性差异,均为白色,菌落平展,边缘较整齐(图1D)。上述描述的子实体和菌落形态特征,与曹玉清等[18]、牟川静等[19]和陈忠纯[8]报道的阿魏菇基本一致。菌丝生长特性比较及拮抗试验结果表明(图1D),在相同培养条件下,菌株YL-A1不仅生长速度快,而且菌丝致密,二者之间还具有明显的拮抗反应。因此,以YL-A1为优良菌株进行后续的培养特性优化。
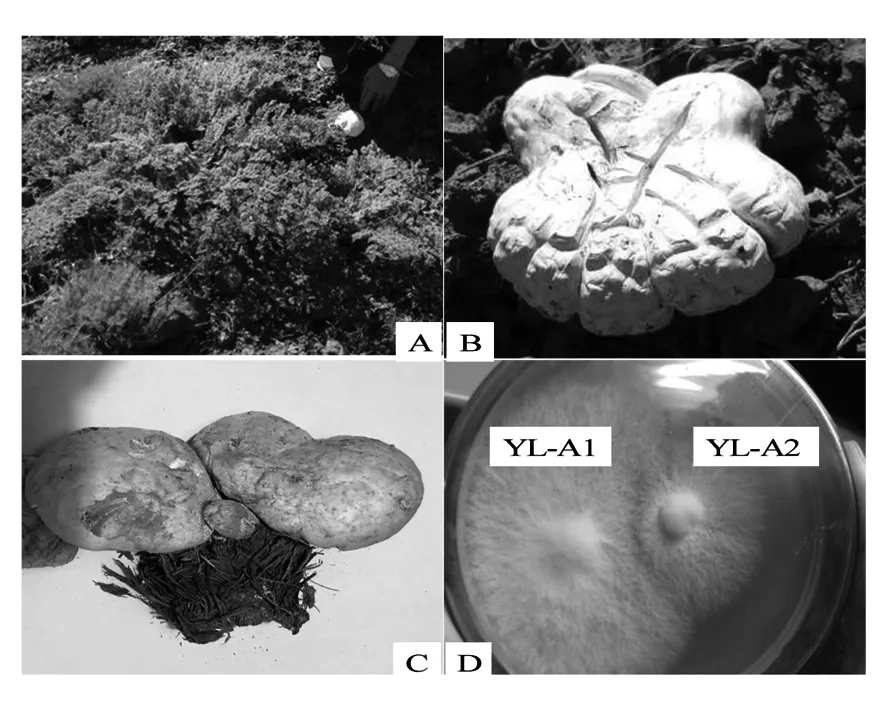
图1 伊犁野生阿魏菇菌株YL-A1和YL-A2形态特征
2.1.2 分子鉴定与系统发育分析 rDNA ITS区段序列测定结果显示,分别从子实体和菌丝体扩增的ITS片段是一致的,这说明经组织分离培养后得到的菌丝纯培养物来源于该子实体。分离菌株YL-A1(ITS序列 GenBank登录号:MN460317)和YL-A2(ITS序列 GenBank登录号:MN809132)的目标扩增产物长度为分别为322 bp和326 bp。通过在线BLAST比对,发现二者序列相似度达99%,菌株YL-A1与YL-A2相比,有1个缺失位点和1个转换位点。且二者与阿魏菇(Pleurotusferulaginis)(ITS序列 GenBank登录号:NR_158885)[20]的遗传关系最近,相似性均达到96%,结合生境特征及形态特征,将菌株YL-A1和YL-A2鉴定为阿魏菇(Pleurotuseryngiivar.ferulae)。系统发育分析(图2)发现,菌株YL-A1和YL-A2单独聚为A组,且二者有一定的遗传距离,C[21-22]和D[22]组均来自欧洲,而E组[21,23]均来自中国。这说明即使同为阿魏菇,因长期处于不同生态环境,导致在遗传背景上出现差异。
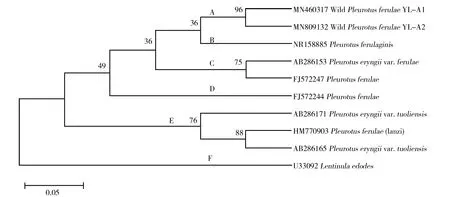
图2 基于ITS序列构建的系统发育树
2.2 不同培养条件对阿魏菇菌株YL-A1菌丝生长影响的单因素试验
2.2.1 温度 由表2可以看出,在18.0~30.0 ℃时菌丝均能生长,这与预试验结果一致。在22.5 ℃条件下,菌丝生长最快,生长速度为(3.62±0.05)mm/d;25.0 ℃条件下,菌丝生长稍慢,但菌丝生长势较好,表现为菌丝致密均匀。因此,综合菌丝生长速度和长势可知,菌株YL-A1菌丝体的最适培养温度为22.5~25.0 ℃,属中低温型菌株。

表2 不同温度对菌丝生长的影响
2.2.2 pH值 由表3可知,在pH 6.5~8.5的培养基上,菌丝均能生长,但就生长势而言存在差异。pH 7.0~8.0时,菌丝生长致密、洁白,而在pH 6.5和8.5时,菌丝出现老化且稀疏,分析原因可能是不合适的pH改变了酶活性基团的构象,从而改变了底物的特性,对菌丝造成胁迫所致。故菌株YL-A1培养的最适pH为7.5,生长速度可达4.26 mm/d;其次为pH 8.0,生长速度为4.13 mm/d。因此,阿魏菇的菌丝体适宜在弱碱性的培养基中培养。

表3 不同pH值对菌丝生长的影响
2.2.3 碳源 由表4可知,伊犁野生阿魏菇菌丝生长过程中对碳源的利用具有选择性,在以葡萄糖为碳源的培养基上生长最快(4.86 mm/d),菌落完整、菌丝洁白,且致密健壮;而以蔗糖和麦芽糖为碳源时,菌丝体的生长速度和长势一般,当以乳糖为碳源时,其生长速度最慢,菌落稀疏且不完整。而以淀粉为碳源,其菌丝虽浓密而洁白,但生长速度缓慢。故最适于阿魏菇菌株YL-A1生长的碳源为葡萄糖。

表4 不同碳源对菌丝生长的影响
2.2.4 氮源 由表5可知,在添加不同氮源的培养基中菌丝体均能生长,其中在含蛋白胨和硝酸钾的培养基中长速最快,其次是酵母浸粉,硫酸铵中最慢。从菌丝长势上看,蛋白胨和酵母浸粉为氮源时最佳,菌丝粗壮浓密、洁白,菌落厚重、致密,表面平坦,边缘规则,故菌株YL-A1的最佳氮源是蛋白胨,其次为酵母浸粉。
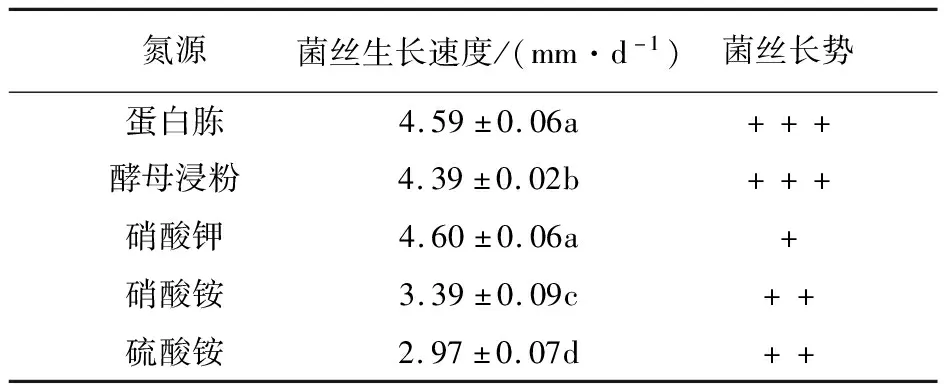
表5 不同氮源对菌丝生长的影响
2.2.5 无机盐 培养基中不同无机盐的添加对菌丝体生长的影响不同(表6),KH2PO4最佳,菌丝体日均长速达3.26 mm。其次为MgSO4,生长速度为3.05 mm/d,而且菌落边缘整齐,菌丝粗壮,洁白。

表6 不同无机盐对菌丝生长的影响
2.3 不同培养条件对阿魏菇菌株YL-A1菌丝生长影响的正交试验
按表1设计的各个单因素及其不同水平,进行影响菌丝生长的正交试验,结果见表7。根据R值可知,各因素对菌丝生长的影响顺序依次为无机盐(D)>温度(A)>碳源(B)>氮源(C)。综合各因素的K值和直观比较,得出菌株YL-A1的最佳培养条件为A3B1C2D1。由方差分析结果可知,四个单因素影响的统计学意义并不显著,可知各因素间组合对菌丝生长具有影响,因此考虑交互作用。最终确定菌株YL-A1的最佳培养条件:在培养基中添加20 g/L葡萄糖、4 g/L蛋白胨、1g/L KH2PO4,25 ℃恒温避光培养,此条件下菌丝生长速度快且长势最佳(表7)。
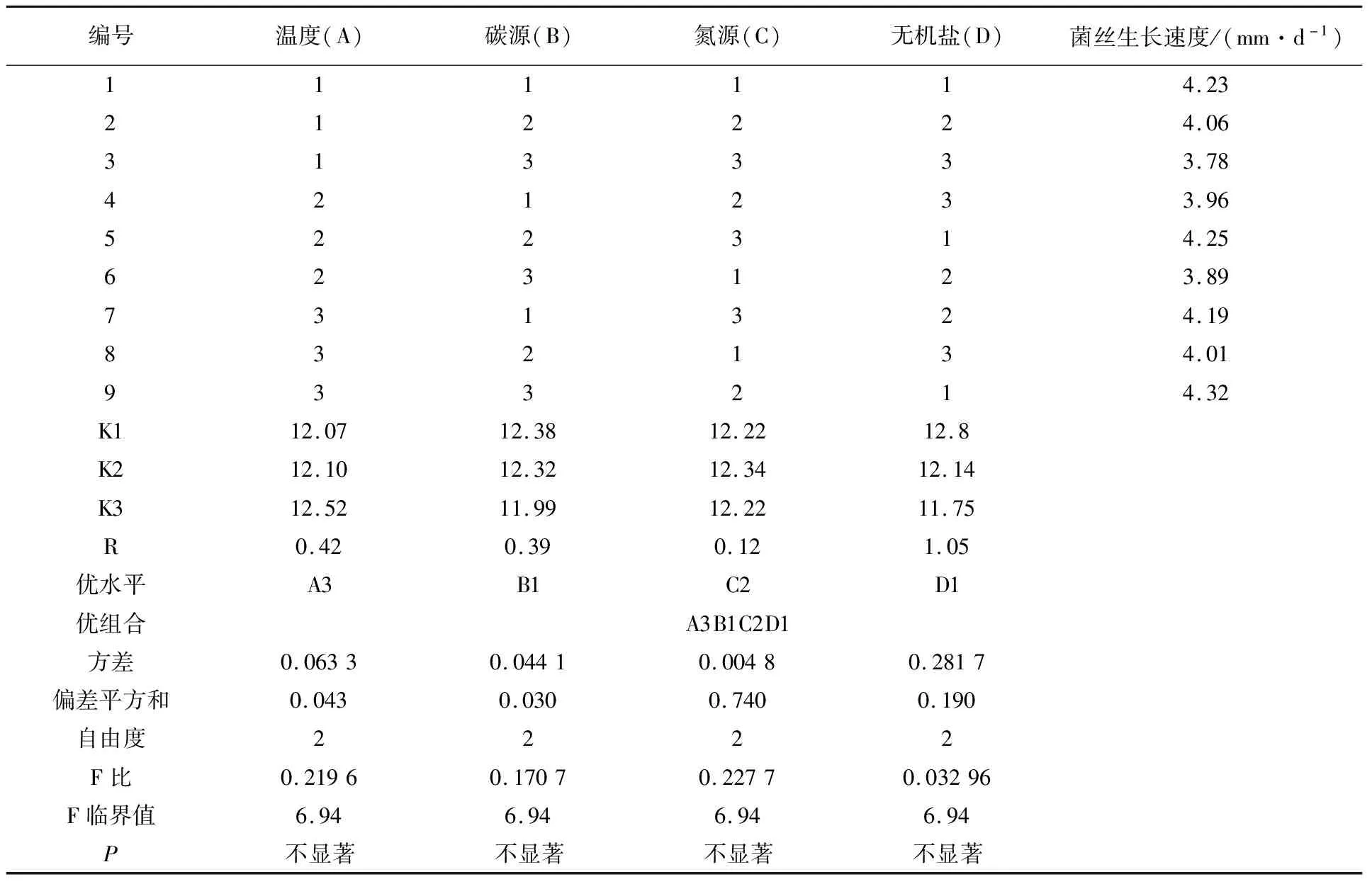
表7 正交试验结果
3 讨 论
伊犁河谷牧区具有独特的生态环境,蕴藏了大量未知、有待开发和利用的丰富、独特的食、药用真菌资源。其中野生阿魏菇的人为破坏严重,导致自然资源匮乏[24],且还未实现菌种资源的异地保护。本研究成功实现了两株伊犁野生阿魏菇菌种的分离纯化和保藏。菌株YL-A1在生长速度和长势上优于YL-A2,且相互拮抗。分子鉴定及系统发育分析发现,菌株YL-A1和YL-A2虽都鉴定为阿魏菇(Pleurotuseryngiivar.ferulae),但有一定的遗传差异,说明即使来源于相同的地理位置,也可能因为生长基质、植被、海拔等环境因素的不同导致遗传变异,ITS序列表现出差异。该试验也表明仅通过ITS序列,在NCBI中进行BIAST比对后得出的结果可能会受具体物种ITS区的可变程度及基因库的完善程度等因素的影响,并不可信,故不能盲目下结论[25-26],这与燕勇等[27]得出的rDNA-ITS分子鉴定方法并不能鉴定出所有真菌的结论一致,认为在野生大型真菌的分类鉴定过程中,须在传统的形态学表型鉴定方法的基础上,结合现代分子鉴定方法,综合加以确定分类地位。而本研究中的两株野生阿魏菇菌株在遗传上的差异也成为其在生物学培养特性上的必然差异。因此,选择生物学特性相对优良的菌株YL-A1进行后续培养特性的优化。
对于大型真菌而言,优良性能菌株的主要筛选指标是其菌丝生长速度和长势[28]。本研究中,通过不同单因素和正交试验,确定菌株YL-A1最适生长温度为22.5~25.0 ℃,该结果与陈忠纯等[29]的研究相似,而与刘志宏等[30]最适27 ℃的研究结果稍有偏差,分析原因可能与菌种遗传特性及菌株生长的地理环境的不同有关。最适pH为7.5,这与刘志宏的研究结果一样,而与曹玉清等[18]的研究结果存在一定的差异,其原因可能是在长期的进化过程中,该大型真菌为适应当地生态地理环境而进化成对酸碱度范围具有一定耐受性的新菌种。最适碳源为葡萄糖,其次是蔗糖和麦芽糖,说明该菌能较好的吸收利用单糖和二糖,这与该大型真菌本身的酶系及其酶调节活动相关,如Kakde等[31]研究表明,葡萄糖能促进菌丝中脂肪酶活性的提高,促进菌丝生长、菌落密度的加厚和分枝的增多。菌丝生长最适氮源为蛋白胨,这一结果与宫志远等[32]的研究结果一致。这是因为蛋白胨既提供氮素,又能提供碳素营养和生长因子;酵母浸粉属于菌类蛋白质,更易吸收利用;此外,铵态氮的吸收利用效果优于硝态氮,分析可能是铵态氮中的氮化合价与细胞有机合成中的氮原子处于相同的氧化水平,而硝态氮中的氮需要进行同化还原才能被吸收利用;由于硫酸根离子浓度过高会对菌丝产生毒害作用[33],故该菌不能很好地利用硫酸铵。此外,在培养基中添加KH2PO4和MgSO4对菌丝生长状态具有一定的促进作用,这与文献中报道的磷和镁元素是糖代谢中许多酶类发挥作用所必需的结论相一致[31,34]。本研究对伊犁野生阿魏菇进行了分离鉴定,确定了菌丝最适培养条件,这将有助于选育高产、抗逆的阿魏菇新菌株,为进一步人工驯化和开发利用提供参考。