海洋酸化和铜离子胁迫对海月水母碟状幼体的影响
王 雷,彭赛君,董志军
1 中国科学院烟台海岸带研究所牟平海岸带环境综合试验站, 烟台 264003 2 中国科学院大学,北京 100049 3 中国科学院海洋大科学中心,青岛 266071
海洋酸化是继“温室效应”之后又一因CO2过量排放而引起的全球性环境问题[1]。工业革命以来,海洋吸收了大约1/3的人类排放CO2量,已造成海水pH下降0.1[2]。国外研究者预计2100年表层海水pH将下降0.3—0.4个单位[3],至2300年可能下降0.77[4]。近年来我国近岸海域季节性海水酸化问题严重,2011年秋季黄海海域底层pH降至7.79—7.90,渤海海域则仅为7.64—7.68[5]。海洋酸化导致海水化学环境改变,会影响海洋生物的基因表达、能量代谢和细胞应激等生理活动,进而影响海洋生物发育、繁殖、生物钙化等生命过程[6- 13]。同时,工业废水、城市污水及农业生产中使用的含Cu2+肥料和杀虫剂等通江河径流汇入近海,导致一些沿海地区海水铜含量超标[14- 16]。铜作为分布最广泛的环境污染物,近岸海域Cu2+浓度受陆源输入和人为污染源影响而变化非常大,在我国辽东湾北部海域Cu2+最高浓度可达25.55 μg/L[17],锦州湾海域海水Cu2+含量为0.73—13.2 μg/L[18],而渤海湾海域则在0.38—2755 μg/L之间[19]。铜也是生命体一种必需微量元素,与生物体内30多种酶氧化还原催化酶和分子氧载体功能的有关[20]。但高浓度Cu2+可造成水生动物抗氧化系统损伤、组织结构发生病理变化和遗传毒性作用,引起海洋生物严重的组织损伤甚至死亡[21- 23]。
海洋酸化可能改变重金属在水环境的形态,促进Cu2+等金属离子从沉积物或岩石中迁移至海水中,从而提高Cu2+在海水环境的浓度水平和水生生物体的生物利用率[24- 25]。Richards等[26]通过模型预测2100年海洋pH值(7.845)条件下,平均Cu2+浓度将增加115%。海洋酸化还会通过改变pH敏感金属的生物效应和潜在毒性间接影响海洋生物种群,有研究发现,铜污染结合海洋酸化、低氧和升温等应激源将导致海葵和珊瑚等海洋生物更严重的氧化应激效应,抑制生物体金属离子酶活性,降低海洋生物对环境胁迫的耐受性[27-28]。Marques等[29]研究发现,Cu2+和海水酸化造成有孔虫Amphisteginagibbosa的Ca2+-ATP酶活性受到严重抑制,生长速率显著降低,白化率更高。
水母作为海洋中一类重要的胶质性浮游动物,在碳、氮、磷等元素的生物地球化学循环中扮演重要角色,并在维持海洋生态系统能量流动和物质循环过程中起到重要作用[30]。海月水母(Aureliacoeruleavon Lendenfeld,1884)是我国近海常见大型水母之一,其暴发给人类社会活动和海洋生态系统带来许多负面影响[31- 33]。海月水母具有典型的世代交替现象[34],包括无性繁殖的营底栖生活的螅状幼体阶段和有性繁殖的营浮游生活的水母体阶段。国内外研究者进行了大量研究探索温度、盐度、pH、重金属等环境因素对海月水母生活史早期阶段的影响,以预测未来海洋环境变化下海月水母种群变动趋势[35- 43]。
海月水母碟状幼体为浮游阶段水母体的幼体形态,每只螅状幼体在横裂期间可产生多达20—30个碟状幼体[44]。钵水母是海洋毒理学研究最多的刺胞动物之一,常用指标例如出芽繁殖、横裂繁殖、碟状幼体形态和收缩频率等[45]。海月水母具有多种无性繁殖方式,繁殖速度较快,可以通过横裂繁殖获得体型和发育阶段一致的碟状幼体;碟状幼体的生长速度较快,生长率、收缩频率等易受到环境因素的影响。因此,海月水母也被认为是环境毒理学研究的潜在模式生物和海洋环境污染监测的重要指示物种[45- 47]。
过去10年间,研究者开展了海洋酸化对不同水母的影响研究,如:Kikkawa等[48]发现,海月水母Aureliasp.碟状幼体在pH 6.896海水中暴露96 h后发育畸形,pH 6.366时停止发育。Winans等[47]研究则表明,海洋酸化条件(pH 7.5和7.3)对海月水母(Aurelialabiata)螅状幼体和碟状幼体的生存或无性繁殖没有显著影响,但酸化海水会抑制碟状幼体平衡石发育。与其他刺胞动物相比,代谢率较高的立方水母更容易受到海洋酸化影响[49]。Boco等[50]发现2300pCO2(即pH 7.5)海洋酸化条件对立方水母目Carybdeaxaymacana水母阶段具有严重毒性影响,暴露于酸化海水12 h后C.xaymacana死亡率显著增加。但海洋酸化与重金属两种环境压力对水母胁迫效应的研究仍处于空白。碟状幼体作为海月水母生长阶段初期,主要栖息于近岸河口区域,其生长发育易受到环境胁迫影响,了解海月水母碟状幼体在海洋酸化和Cu2+胁迫下的生理变化,可以更有效预测未来海月水母种群变动。本研究设置两个pH水平(pH 8.1和pH 7.6)和3个Cu2+浓度水平(0、10 μg/L和25 μg/L),通过测定抗氧化酶过氧化氢酶(CAT)、超氧化物歧化酶(SOD)及离子转运酶Ca2+-ATP酶活性、呼吸率、收缩频率和伞部直径等生理指标,分析海月水母碟状幼体在海洋酸化和Cu2+胁迫下的生理响应。这些结果旨在了解海洋酸化和Cu2+对海月水母碟状幼体生理代谢和生长发育等过程的差异影响,有助于预测未来环境条件下生物多样性和其他生态进程的变化趋势。本研究结果将为评估全球和区域海洋环境问题对海洋生物的影响以及海洋环境监测提供理论基础和技术支撑。
1 材料与方法
1.1 海月水母碟状幼体收集
海月水母成体2019年9月采集于烟台市养马岛附近海域(37°26′43″N, 121°34′25″E),运回牟平海岸带环境综合试验站的水母养殖实验室收集海月水母浮浪幼虫。浮浪幼虫发育为螅状幼体后,喂食孵化卤虫(Artemiafranciscana)1日龄幼虫。螅状幼体生长至16触手后,将培养温度从15℃降至10℃刺激螅状幼体横裂[51]。螅状幼体在10℃下4—5周后停止喂食,开始进行横裂。为获得大致相同发育阶段的碟状幼体,前12 d释放的碟状幼体不用于实验,仅选择个体健康、形状良好、大小一致的1日龄碟状幼体进行实验。
1.2 实验设置
海水酸化水平参照政府间气候变化专门委员会(IPCC)模型预测RCP 8.5情景下2100年海水pH值(7.6),通过气体流量控制系统调节空气-CO2混合气体的比例和进气量,实现海水酸化条件[52]。Cu2+浓度参照中华人民共和国海水水质标准(二类海水Cu2+≤ 10 μg/L)以及渤海近岸海域环境相关浓度(辽东湾北部海水Cu2+最高值25.5 μg/L)设定,通过添加CuCl2溶液实现海水的Cu2+暴露浓度。
暴露实验包括两个pH水平(pH 8.1和pH 7.6)和3个铜暴露浓度(0、10 μg/L和25 μg/L)共6个处理组,每个处理设置3个300 L水族箱进行实验海水预处理。每个水族箱通过水泵连接10 L的U型水母缸,实验海水以40 mL/min流速通过水母缸,保证水母缸25 min左右更新一次海水。每个水母缸碟状幼体实验数目为100只。实验海水经过沙缸过滤和紫外线杀菌处理,温度控制在22℃。暴露实验共进行16 d,期间每天向水母缸中定时投饵卤虫1日龄无节幼体10 mL(50只/mL)。
每天使用NBS标准溶液校准的pH电极监测实验水体pH,使用YSI仪测定温度、盐度和溶解氧(DO)。每周从水族箱中收集水样,使用自动电位滴定仪测定水体总碱度(TA)。根据TA值和测量参数(温度、盐度和pH值),利用CO2SYS软件计算海水碳酸盐化学的其他相关参数[53]。每周更换一次海水,更换海水后将pH和Cu2+浓度调节为设置条件。实验结束时测定海月水母的呼吸率、收缩频率和伞径,液氮保存组织样本进行酶活测定。
1.3 抗氧化酶和离子转运酶活性
采用南京建成生物工程研究所试剂盒,分别对保存样品的过氧化氢酶(CAT)、超氧化物歧化酶(SOD)和Ca2+-ATP酶的活力水平进行检测,同时采用考马斯亮蓝法测定匀浆液的蛋白质浓度。
称量0.2 g左右的海月水母组织(n=6),按照匀浆稀释5倍的比例加入一定量的匀浆介质(0.9%生理盐水),低温匀浆后离心10 min(2500 rpm,4℃),收集上清液分装待测。CAT、SOD和Ca2+-ATP酶活力的测定参照相关说明书进行,组织总蛋白浓度的测定采用考马斯亮蓝法。酶活性测定单位为U/mg蛋白,其中1 U代表单位质量蛋白在单位时间内吸光度的变化;蛋白浓度的测定单位为mg/mL组织匀浆。
1.4 呼吸率
根据Pettersen等(2017)的方法[54],在暴露实验结束后采用SensorDish Reader PreSens连接24通道微孔板测定海月水母碟状幼体的呼吸率,测定前使用空气饱和水和2%亚硫酸钠缓冲液校准传感器。测定时每个水母缸随机选择10只海月水母,每只单独放入含0.2 μm膜过滤海水的12孔板中,记录2 h的氧含量变化值。为消除生物环境应激效应等影响,测定期前1小时数据舍弃。呼吸率的测定在恒温培养箱22℃黑暗中进行,测定结果为微孔板中氧含量变化值MO。利用如下公式计算呼吸率(Respiration rates):
Respiration rates=(MjO-McO)/WW
式中,MjO为水母测定孔氧含量变化值,McO为背景空白孔氧含量变化值,WW为测定水母湿重。
1.5 收缩频率
根据Alguero-Muniz等(2016)的方法[43],在暴露实验结束后对每个处理组的海月水母收缩频率进行测定。每个水母缸随机选择10只海月水母碟状幼体放置在12孔板中,使用体视显微镜连接电脑软件OPT Pro摄像3 min,记录每只海月水母的收缩次数(p)。利用如下公式计算收缩率(Pulsation rates):
Pulsation rates=p/(t1-t0)
式中,p为t0至t1时间内的收缩次数。
1.6 伞部直径
根据Heins等(2018)的方法[55],在暴露实验开始前和结束时使用体视显微镜连接电脑拍摄软件OPT Pro,拍照测量碟状幼体的伞部直径。每个水母缸随机取10只实验个体,放置在含2 mm高度海水的培养皿中进行拍照测量。
1.7 数据分析
实验数据利用SPSS 22.0软件进行双因素方差分析(ANOVA),检验不同处理间均值的显著性,显著性水平定义为P<0.05;使用单因素方差分析分别对正常pH水平和酸化pH水平下不同浓度Cu2+处理组数据进行显著性分析;使用Tukey(方差齐性)检验,比较相同Cu2+浓度处理下,正常pH海水组和酸化海水组的差异。实验结果以平均值±标准差(Mean ± SD)表示。
2 结果
本实验通过充入CO2气体模拟海洋酸化环境,通过添加CuCl2溶液模拟近海铜污染环境。表1总结了海月水母暴露实验海水温度、盐度、pH以及其他碳酸盐化学参数。酸化海水处理的pH条件控制在预期海水酸化水平附近(±0.02)。实验过程中,海水温度均保持在22℃左右,盐度在31左右。
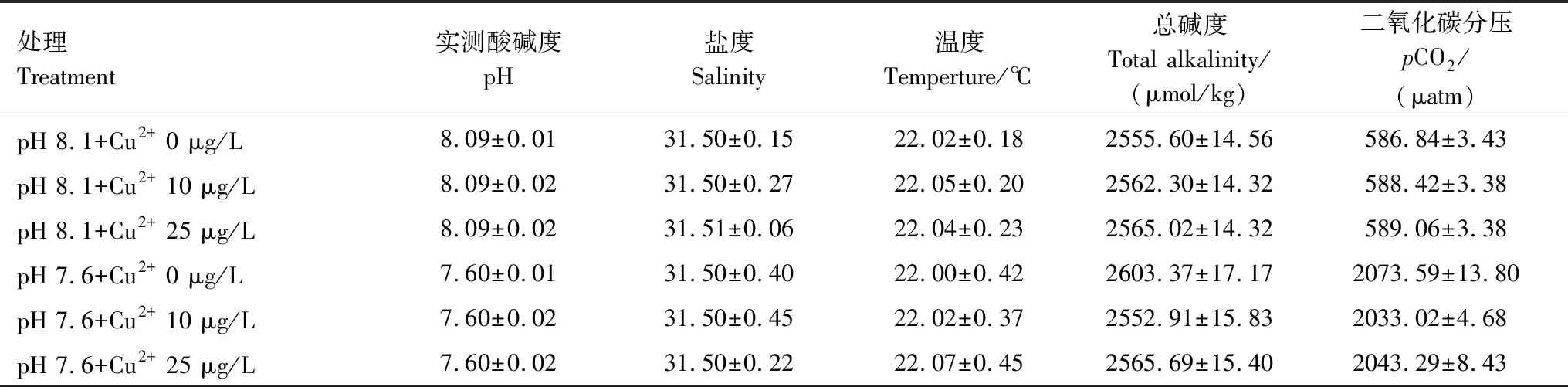
表1 海月水母暴露期间相关海水化学参数
2.1 抗氧化酶和离子转运酶酶活性
在海水酸化和Cu2+暴露16 d后,海月水母碟状幼体的CAT活性随着海水pH降低和Cu2+浓度增加呈现降低趋势。在0 μg/L Cu2+条件下,酸化海水组和正常海水组CAT活性差异极显著,但加入Cu2+后酸化对CAT活性影响不显著。在两个pH水平下,10 μg/L和25 μg/L Cu2+处理组的CAT活性显著低于0 μg/L Cu2+处理组。根据表2,海水酸化和Cu2+暴露对CAT活性具有极显著交互作用(P<0.01)(图1)。
暴露16 d后,海月水母碟状幼体的SOD活性随Cu2+浓度升高呈现显著增加趋势(P<0.01),酸化对SOD活性影响不显著。在两个pH水平下,25 μg/L Cu2+处理组的SOD活性显著高于0 μg/L和10 μg/L Cu2+处理组,但0 和10 μg/L 两个Cu2+处理组之间的差异性不显著(图2)。
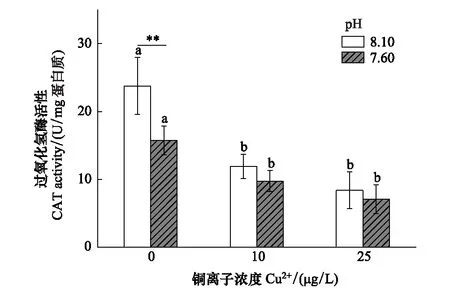
图1 海水酸化和Cu2+暴露下海月水母的CAT活性 Fig.1 CAT activities of A. coerulea ephyrae after elevated pCO2 and/or Cu2+ exposureCAT:过氧化氢酶Catalase; 不同字母表示相同的pH处理下,不同浓度的Cu2+处理之间存在显著性(P<0.05);星号(*)表示相同浓度的Cu2+处理下,正常pH与酸化pH之间存在差异(**P<0.01)

图2 海水酸化和Cu2+暴露下海月水母的SOD活性 Fig.2 SOD activities of A. coerulea ephyrae after elevated pCO2 and/or Cu2+ exposureSOD:超氧化物歧化酶Superoxide dismutase; 不同字母表示相同的pH处理下,不同浓度的Cu2+处理之间存在显著性(P<0.05)
随着pH降低和Cu2+浓度增加,海月水母Ca2+-ATP酶活性呈现显著降低的趋势。0和10 μg/L Cu2+条件下,酸化对Ca2+-ATP酶活性具有显著抑制作用。在两个pH水平下,10 μg/L和25 μg/L Cu2+处理组的Ca2+-ATP酶活性较0 μg/L Cu2+处理组显著降低。根据表2,海洋酸化和Cu2+暴露对Ca2+-ATP酶具有显著的交互作用(P<0.05)(图3)。
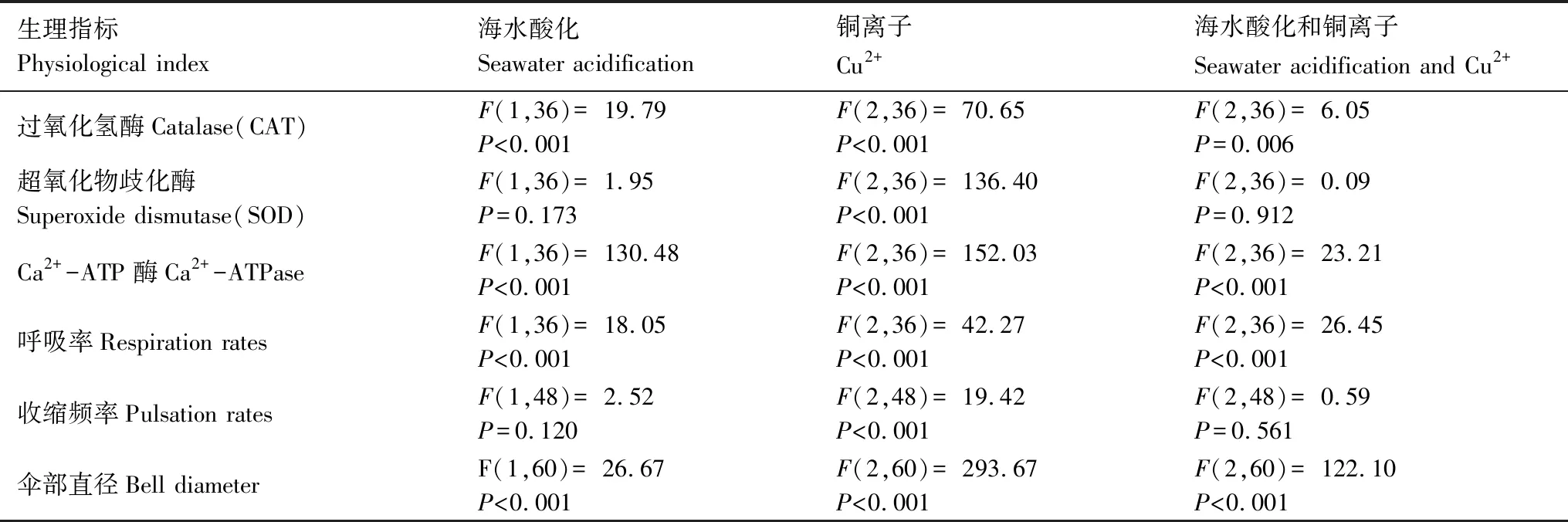
表2 双因素方差分析:海水酸化和Cu2+胁迫对海月水母碟状幼体的影响
2.2 呼吸率
海水酸化和Cu2+暴露对海月水母碟状幼体呼吸率具有显著影响(P<0.01)。当Cu2+浓度为0 μg/L时,酸化海水组呼吸率较正常pH海水组显著升高,但在10 μg/L和25 μg/L Cu2+时,正常pH海水组呼吸率明显高于酸化海水组。在正常pH海水中,海月水母的呼吸率随Cu2+浓度增加呈现显著增加趋势,但酸化海水组的呼吸率随Cu2+浓度增加先升高后降低。根据双因素方差分析,海水酸化和Cu2+对海月水母的呼吸率均具有显著的促进作用,两者存在显著的交互作用(P<0.01)(图4)。

图3 海水酸化和Cu2+暴露下海月水母的Ca2+-ATP酶活性 Fig.3 Ca2+-ATPase activities of A. coerulea ephyrae after elevated pCO2 and/or Cu2+ exposure不同字母表示相同的pH处理下,不同浓度的Cu2+处理之间存在显著性(P<0.05);星号(*)表示相同浓度的Cu2+处理下,正常pH与酸化pH之间存在差异(**P<0.01)

图4 海水酸化和Cu2+暴露下海月水母的呼吸率 Fig.4 Respiration rates of A. coerulea ephyrae after elevated pCO2 and/or Cu2+ exposure不同字母表示相同的pH处理下,不同浓度的Cu2+处理之间存在显著性(P<0.05);星号(*)表示相同浓度的Cu2+处理下,正常pH与酸化pH之间存在差异(*P<0.05,**P<0.01)
2.3 收缩频率
海水酸化和Cu2+暴露对海月水母碟状幼体收缩频率的影响如图5所示。暴露16 d后,在相同的Cu2+浓度处理下,酸化对海月水母收缩频率没有显著性影响。随着Cu2+暴露浓度的增加,海月水母收缩频率均呈现显著降低的趋势,25 μg/L Cu2+处理组的收缩率显著低于0 和10 μg/L Cu2+处理组。Two-way ANOVA 分析表明,海水酸化和Cu2+对收缩频率影响的交互作用不显著(P>0.05)。
2.4 伞部直径
图6为不同海水pH和Cu2+浓度下的海月水母碟状幼体伞部直径。碟状体初始伞径为(3.51±0.2)mm,各处理组之间碟状体初始伞径不存在显著性差异(P>0.05)。暴露16 d后,海月水母伞部直径随Cu2+浓度增加呈现显著降低趋势,25 μg/L Cu2+处理组的水母伞部直径显著小于0 μg/L Cu2+处理组。根据体视显微镜拍摄的暴露16 d后碟状幼体图像显示(图7),Cu2+严重影响碟状幼体的生长,并导致发育畸形。不同Cu2+浓度下,酸化对海月水母生长的影响不一致,0 μg/L Cu2+浓度时,正常pH海水组的水母伞径显著大于酸化海水组;但加入 Cu2+后,正常pH海水组的水母伞径明显小于酸化海水组。海水酸化和铜暴露对海月水母碟状幼体的生长均具有显著影响(P<0.01),两者存在显著拮抗作用(P<0.01)。
3 讨论
本研究首次探究了海月水母碟状幼体对海洋酸化和Cu2+两种环境胁迫因子的生理响应,从抗氧化酶和离子转运酶活性、呼吸、运动以及生长等方面探究两种胁迫因子在不同浓度下对海月水母的综合影响。研究结果表明,海月水母对两种环境胁迫因子敏感性不同,单独Cu2+暴露比单独酸化暴露的胁迫效应更严重,这与Siddiqui等[28]在海洋酸化和Cu2+对珊瑚生理影响的研究一致。本研究发现海水酸化与Cu2+对海月水母呼吸率和生长具有拮抗作用,海水酸化可缓解Cu2+对海月水母碟状幼体的毒性影响。Lewis等[56]也报道了类似现象,海胆Paracentrotuslividus体内的酸碱调节机制可在酸化条件下(pH 7.7)增加细胞外碳酸氢盐水平,保护性地对抗Cu2+毒性,减轻Cu2+暴露引起的DNA损伤。Larsen等[57]在对大西洋鳕鱼(Gadusmorhua)研究中也提出酸化对Cu2+毒性的保护作用,游离Cu2+将与HCO32-形成一系列络合物,升高的碳酸氢盐水平可以降低海水游离Cu2+的比例,从而减少铜毒性对生物造成的损害。
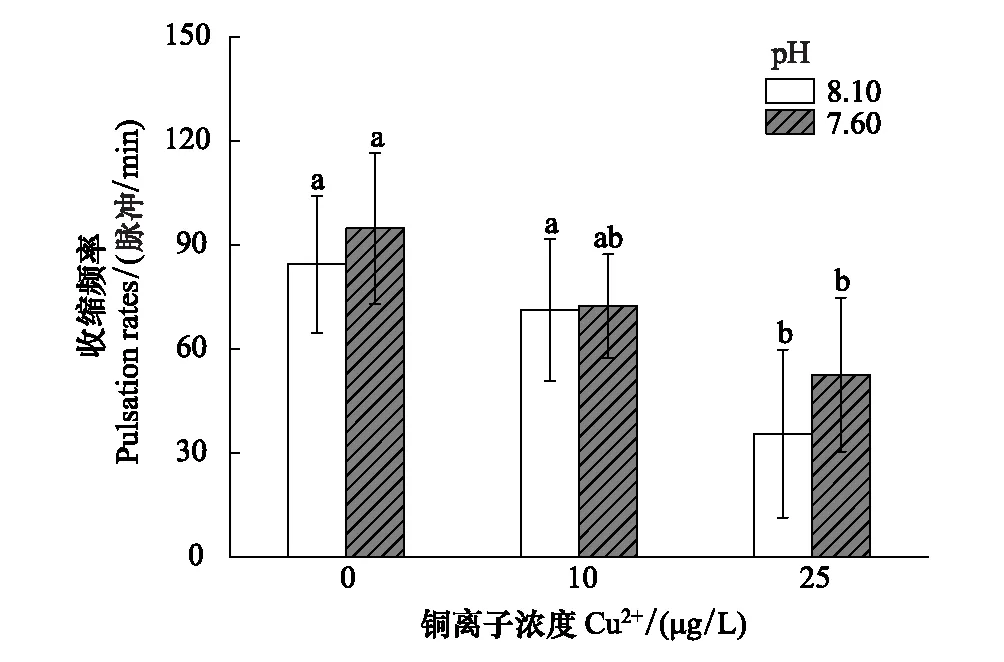
图5 海水酸化和Cu2+暴露下海月水母的收缩频率 Fig.5 Pulsation rates of A. coerulea ephyrae after elevated pCO2 and/or Cu2+ exposure不同字母表示相同的pH处理下,不同浓度的Cu2+处理之间存在显著性(P<0.05)
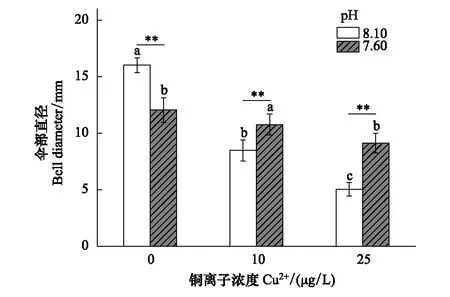
图6 海水酸化和Cu2+暴露下海月水母的伞部直径 Fig.6 Bell diameter of A. coerulea ephyrae after elevated pCO2 and/or Cu2+ exposure不同字母表示相同的pH处理下,不同浓度的Cu2+处理之间存在显著性(P<0.05);星号(*)表示相同浓度的Cu2+处理下,正常pH与酸化pH之间存在差异(**P<0.01)
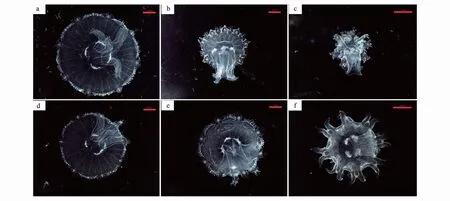
图7 海水酸化和Cu2+暴露下的海月水母碟状幼体Fig.7 A. coerulea ephyrae after elevated pCO2 and/or Cu2+ exposure在0 μg/L(a)、10 μg/L(b)和25 μg/L(c)Cu2+浓度下,正常pH海水组的碟状幼体;0 μg/L(d)、10 μg/L(e)和25 μg/L(f)Cu2+浓度下,酸化pH海水组的碟状幼体。比例尺:2 mm
3.1 海洋酸化和Cu2+对海月水母抗氧化酶和离子转运酶的影响
本研究表明,海洋酸化和Cu2+胁迫对海月水母抗氧化酶CAT和SOD以及离子转运酶Ca2+-ATP酶活性具有显著影响。CAT活性随着Cu2+浓度的增加而降低,SOD活性随着Cu2+浓度增加而增加,表明Cu2+可能引起海月水母较强的氧化应激效应,但会抑制CAT的活性。海水酸化对CAT活性也具有显著抑制作用。任虹等[58]研究重金属污染物对文蛤(Meretrixmeretrix)金属酶类发现,当Cu2+浓度高于5 μmol/L时对CAT的抑制效果显著。其他研究也发现,栉孔扇贝(Chlamysfarreri)内脏团组织的CAT活性随着Cu2+浓度增加,表现出“抑制-诱导-抑制”的规律,但整体表现为降低趋势,重金属对CAT的抑制作用可能由于Cu2+干扰酶分子铁卟啉环中Fe2+的结合而抑制其活性[59]。Siddiqui等[28]研究表明,随着pCO2增加,海葵Exaiptasiapallida的CAT、谷胱甘肽过氧化物酶(GPx)和谷胱甘肽还原酶(GR)活性显著降低。
Ca2+-ATP酶是Ca2+激活的Mg2+依赖性ATP酶,负责生物体钙的主动转运和维持细胞pH稳定[60]。Ca2+-ATP酶作为一种离子转运蛋白,也被认为是易受到环境干扰的敏感生物标志物[29]。许多重金属对珊瑚、贻贝和海胆等钙化生物的ATP酶活性具有抑制作用,通过氧化应激条件诱导膜损伤,重金属离子可以导致膜结合的ATP酶活性受损[61-62]。有研究表明,暴露于含Cu2+海水的珊瑚以及在高Cu2+浓度海域采集的有孔虫的Ca2+-ATP酶活性较低[23]。本研究结果也显示,海洋酸化和Cu2+均对Ca2+-ATP酶活性具有较强的抑制效应。以往研究发现,低pH条件下水螅幼体横裂释放出的碟状幼体平衡石明显较小[47]。海水酸化或重金属条件下,海月水母的Ca2+-ATP酶活性降低,可能影响水母体内钙的吸收和平衡石等钙质结构的形成。作为水母感受器官感觉棍的重要组成部分,平衡石的损伤或缺失将导致水母生长畸形和游泳行为不规律[47]。
3.2 海洋酸化和Cu2+对海月水母呼吸率的影响
呼吸率是海洋生物代谢活动的直接指标,浮游动物的呼吸率主要受环境温度和生物体重影响,还受生物的活力水平、环境深度和O2分压及物种特异性行为的影响[54,63-65]。本研究表明,正常pH海水条件下,海月水母呼吸率随Cu2+浓度的升高呈现显著升高趋势;而在酸化海水中,呼吸率随Cu2+浓度先升高后降低。结果表明铜暴露造成海月水母机体代谢水平升高,但酸化可能减缓Cu2+对水母体的毒性应激效应。Catarino等[65]研究表明,低温及低pH(7.7和7.4)暴露导致海胆Paracentrotuslividus呼吸率显著升高。也有研究发现,在Cu2+暴露环境中,草鱼(Ctenopharyngodonidella)幼鱼有氧代谢增加37.48%,同时草鱼幼鱼的游泳能力也受到影响,游泳效率降低[66]。当外界环境发生变化时,生物体可能需要通过离子调节等生理过程以适应环境变化,而生物消耗体内储存能量应对环境变化的生存策略,可能是导致机体代谢率升高的原因之一。
3.3 海洋酸化和Cu2+对海月水母收缩频率的影响
收缩行为是海月水母碟状幼体的主要运动方式,碟状幼体通过收缩缘叶进行游动,捕获猎物和躲避天敌等[48]。本研究表明,海月水母的收缩频率随着铜暴露浓度的增加逐渐降低,正常pH海水、25 μg/L Cu2+暴露处理海月水母的收缩频率最低。Tills等[46]研究发现,在pH 7.6酸化条件下暴露7天后,海月水母(A.aurita)碟状幼体收缩率显著降低,收缩周期更长。但本研究中,在0 μg/L Cu2+条件下,正常pH海水组海月水母收缩频率显著小于酸化海水处理组。可能原因是水母受到海水阻力随着伞部直径增加而增大,导致水母收缩频率降低。海月水母碟状幼体不同生长阶段收缩频率的变化,需要进一步研究。在10 μg/L和20 μg/L Cu2+浓度下,酸化海水组碟状幼体的收缩频率高于正常pH海水组,这可能表明海水酸化可以缓解Cu2+对海月水母碟状幼体收缩率的影响。之前的研究表明,水母对海洋酸化具有较高的耐受性,长期海洋酸化模拟实验发现pH值对海月水母无致命毒性影响[67]。Kikkawa等[48]研究发现,海月水母(Aurelia. sp)碟状幼体在暴露于5,000 matmpCO2酸化条件时收缩频率才出现降低趋势。
3.4 海洋酸化和Cu2+对海月水母生长的影响
本研究表明,海水酸化和Cu2+暴露对碟状幼体的生长具有显著抑制作用。暴露16 d后,正常pH海水和0 μg/L Cu2+的海月水母生长状况最好,该处理组中海月水母的平均伞径最大。当pH降低或加入Cu2+后,所有处理的海月水母生长发育均显示出负面影响,高浓度的Cu2+还会导致海月水母严重畸形。有研究表明,水体中过量的Cu2+会对鱼类的鳃片造成损伤,引起鳃片上皮细胞肿胀、变形和严重增生,最终导致鱼类缺氧死亡[68],其他研究也报道了有孔虫和贝类等生物Cu2+暴露后出现脂质囊泡增殖和组织损伤等细胞学异常现象[69-71]。有研究表明短期暴露于酸化海水或锌、镉等重金属污染物会极大地影响水母毒素的生物活性,造成水母毒素的溶血性降低[70]。此外,Morabito等[72]还发现重金属或海水酸化暴露下,夜光游水母(Pelagianoctiluca)离体刺细胞的离子通道和共转运蛋白活性降低,极大影响水母刺丝囊反应;低pH条件下细胞膜水渗透性降低,刺细胞释放过程延长甚至失去释放能力。含有毒素的刺细胞对于刺胞动物的捕食和生存至关重要,刺细胞损伤将影响水母的捕食行为,最终影响其能量摄入以及生长发育。
工业革命以来,人类活动造成的海洋环境变化速度正在加剧,这导致了水母暴发、赤潮、浒苔暴发等海洋生物灾害事件频繁发生,给人类生产生活和海洋生态系统多样性造成严重威胁。因此,利用生物评估模型预测海洋生物在未来海洋环境下的生理代谢变化和种群趋势具有重要意义。作为新兴的环境监测方法,生物评估模型中的生物化学(例如免疫应激有关的酶)和生理(例如生长率和收缩频率)变化等生物标记物可以比物理和化学监测手段更为直观地反映海洋生物受到环境污染的影响。
4 结论
海水酸化和Cu2+暴露共同影响海月水母生活史早期阶段碟状幼体的生理代谢和生长发育。在实验设置水平下,海水酸化和Cu2+对海月水母碟状幼体CAT、Ca2+-ATP酶活性具有抑制作用,造成SOD活性升高,引起免疫应激效应;呼吸率则表现出Cu2+促进效应,海洋酸化和Cu2+暴露下水母需要将更多的能量用于抵御逆境,但海洋酸化和Cu2+表现为拮抗效应,酸化可以缓解Cu2+对呼吸率的刺激作用;在Cu2+暴露下,海月水母的收缩频率显著降低,这可能导致海月水母捕食能力下降;海月水母碟状幼体的生长也受到海水酸化和Cu2+的抑制,伞径长度随pH降低和Cu2+浓度增加而减小。

