紫草素诱导三阴性乳腺癌细胞MDA-MB-231坏死性凋亡的作用及其机制
闫伟平,谢法红,郭瑞杰,聂 帅,郭晓辉
(中国人民解放军总医院医疗保障中心药剂科派驻第一医学中心原门诊药局,北京 100853;*通讯作者,E-mail:31352858@qq.com)
三阴性乳腺癌是一种临床免疫组织化学检查中雌激素受体(ER)、孕激素受体(PR)和原癌基因Her-2三者均为阴性的乳腺癌,占乳腺癌的15%-20%。且其恶性程度更高,患者预后更差,有较高的转移风险。目前主要的治疗手段为手术治疗、辅助化疗和靶向治疗等,但仍难以达到理想效果[1]。紫草素为草本植物紫草的主要有效成分,近年来研究发现紫草素及其衍生物有抗炎[2]、抗病毒[3]、抗免疫[4]等多种生物功效,它在抗肿瘤方面的研究更为广泛,紫草素可以通过诱导凋亡、坏死、坏死性凋亡等多种死亡形式来抑制肿瘤细胞增殖,同时通过对NF-κB信号通路的调控,降低MMP-9蛋白表达量,进而阻断肿瘤的侵袭与转移[5,6]。近年来,紫草素逐渐成为抗乳腺癌药物研究的热点,研究表明它能够降低MCF-7细胞中ER的表达,促进凋亡相关蛋白的表达,使细胞周期阻滞于G0/G1期[7]。但目前紫草素在三阴性乳腺癌中的作用尚未被阐明,为其在乳腺癌中的临床应用带来了一定的局限性。本研究旨在研究紫草素在三阴性乳腺癌细胞中所发挥的作用及其可能机制研究,为三阴性乳腺癌寻找新的治疗药物提供实验依据。
1 材料与方法
1.1 材料
紫草素购于上海源叶生物科技有限公司;噻唑蓝(5-diphenyltetrazolium bromide,MTT)、z-VAD-fmk和Necrostatin-1(Nec-1)购自美国Sigma公司;DAPI和Annexin Ⅴ-FITC/PI双染细胞凋亡检测试剂盒购自凯基生物;兔抗RIP1抗体购自美国Santa公司,Tubulin抗体购自南京巴傲德生物科技有限公司。
1.2 细胞株和细胞培养
人三阴性乳腺癌细胞株MDA-MB-231购自上海细胞库,由本实验室保存。该细胞在培养过程中使用含有10%胎牛血清的DMEM培养基(Gibco公司),并在37 ℃且含有5% CO2饱和湿度的培养箱中培养。
1.3 MTT法检测细胞存活率
当细胞处于生长对数期时,将其制成混悬液,以每孔8 000个细胞同时接种于三块96孔板中,每孔150 μl。培养箱中静置培养,待第2天细胞贴壁正常生长时,分别使用浓度为0,2.5,5,7.5,10,15 μmol/L的紫草素予以相应处理,同时设置空白对照孔。在药物作用24,48,72 h时每孔分别加入20 μl的MTT,培养2-4 h,取出孔板弃去上清,并加入150 μl的DMSO溶解甲臜结晶,37 ℃烘箱中继续放置10 min待结晶完全溶解,酶标仪在490 nm波长处测得每孔对应的OD值用于后续计算。当使用Caspase抑制剂z-VAD-fmk(20 μmol/L)时,设置分组为对照组、z-VAD-fmk组、紫草素组、紫草素与z-VAD-fmk联用组;坏死性凋亡抑制剂Nec-1(20 μmol/L)与紫草素联合作用时,设置分组为对照组、Nec-1组、紫草素组、紫草素与Nec-1联用组,均提前使用Nec-1或z-VAD-fmk对孔内细胞进行预处理1 h,吸去上清后重新加入含有抑制剂和紫草素的培养基进行处理,48 h后按照上述步骤进行检测分析OD值。
1.4 DAPI染色检测细胞核变化
选取处于对数生长期的MDA-MB-231细胞,吹打均匀后计数并制成混悬液,以每孔1.5×104细胞接种于12孔板中,第2天细胞贴壁后分别使用浓度梯度的紫草素(0,5,10,15 μmol/L)进行处理,24 h后弃去上清并使用4%多聚甲醛在4 ℃冰箱中固定20 min,PBS清洗后避光加入DAPI染色试剂,5-10 min后弃去孔内液体,PBS清洗3次后通过荧光显微镜进行观察并拍照,记录紫草素作用后MDA-MB-231细胞核的改变。
1.5 Annexin Ⅴ-FITC/PI双染试剂盒检测细胞凋亡率
将MDA-MB-231细胞按1×105/孔接种于6孔板中,第2天使用紫草素(0,5,10,15 μmol/L)进行处理,24 h后收取细胞,1 000 r/min离心5 min,弃去上清后加入适量预冷的PBS进行清洗3次,离心后弃上清并每样品中加入500 μl Binding Buffer,10 μl Annexin Ⅴ-FITC试剂轻轻弹匀,4 ℃冰箱中避光反应30 min后加入5 μl PI试剂,轻轻混匀后在2 h内进行流式细胞仪上机操作,保存结果并加以分析。与抑制剂联用时,均先使用抑制剂预处理1 h后加入抑制剂与紫草素的混合培养基。
1.6 Western blot法检测RIP1蛋白的表达
不同浓度紫草素处理MDA-MB-231细胞24 h后,使用RIPA裂解液提取获得细胞总蛋白,BCA试剂盒分别检测蛋白浓度。每孔取20 μg蛋白上样,进行SDS-PAGE凝胶电泳,转膜,牛奶封闭2 h后PBST清洗3次,8 min/次;一抗(RIP1,1 ∶1 000;Tubulin,1 ∶5 000)孵育2-4 h,PBST清洗3次后使用相应的二抗孵育1 h,PBST清洗3次,置于ECL发光液中并轻柔吹打,通过Bio-Rad凝胶成像系统拍照检测目的蛋白表达,Image J软件进行灰度值扫描分析。
1.7 统计学分析
所有实验数据使用SPSS 16.0统计软件进行分析,数据描述用平均数±标准差表示,组间差异分析使用t检验,P<0.05为差异有统计学意义。
2 结果
2.1 紫草素对MDA-MB-231细胞增殖的影响
MTT检测结果显示,浓度梯度的紫草素(0,2.5,5,7.5,10,15 μmol/L)作用三阴性乳腺癌MDA-MB-231细胞24,48,72 h,细胞的存活率随着紫草素给药浓度的增大和作用时间的延长而逐渐降低(见图1)。10 μmol/L浓度时,24,48,72 h时细胞存活率分别为(71.95±2.15)%,(58.62±1.12)%和(36.08±0.98)%,故在后续实验中使用10 μmol/L作为紫草素对MDA-MB-231细胞的作用浓度。
2.2 紫草素对MDA-MB-231细胞形态和细胞核的影响
将5,10,15 μmol/L紫草素作用于MDA-MB-231

与24 h组相比,*P<0.05,***P<0.001图1 紫草素对MDA-MB-231细胞增殖的影响Figure 1 Effects of shikonin on the proliferation of MDA-MB-231 cells
细胞后,细胞形态学变化见图2,DAPI染色后细胞核的变化见图3。与对照相比,随着紫草素浓度的增加,细胞数量逐渐减少,细胞发生明显皱缩;DAPI染色后细胞核浓缩,且在高浓度紫草素作用时有核碎裂情况发生。

红色箭头处为细胞发生明显皱缩图2 紫草素对MDA-MB-231细胞形态的影响 (×40)Figure 2 Effect of shikonin on MDA-MB-231 cell morphology (×40)
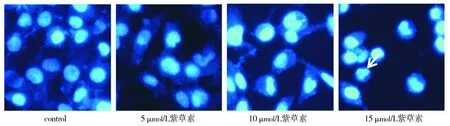
白色箭头处为DAPI染色后细胞核浓缩图3 紫草素作用下MDA-MB-231细胞DAPI染色结果 (×40)Figure 3 DAPI staining results of shikonin on MDA-MB-231 cells (×40)
2.3 Annexin Ⅴ-FITC/PI双染实验检测紫草素对MDA-MB-231细胞凋亡率的影响
流式细胞仪检测Annexin Ⅴ-FITC/PI双染结果见图4。5,10,15 μmol/L紫草素作用MDA-MB-231细胞24 h后细胞凋亡率分别是(6.4±1.2)%,(15.6±1.35)%和(29.0±2.11)%。

图4 不同浓度紫草素对MDA-MB-231细胞凋亡率的影响Figure 4 Apoptosis rate of MDA-MB-231 cells after treated with shikonin
2.4 紫草素诱导MDA-MB-231细胞发生坏死性凋亡
分别将凋亡抑制剂z-VAD-fmk和坏死性凋亡抑制剂Nec-1与紫草素联用处理细胞,结果表明与Nec-1联用时,紫草素对MDA-MB-231细胞增殖的抑制作用明显被逆转,单独使用紫草素时细胞OD值为0.65±0.02,联用时OD值为0.90±0.04,差异具有统计学意义(P<0.01);而与z-VAD-fmk联用时OD值为0.63±0.05,与单独使用紫草素(0.60±0.03)差异无统计学意义(P>0.05,见图5)。Annexin Ⅴ-FITC/PI双染得到相类似的结果,从图5中能够看到Nec-1可以显著逆转紫草素诱导的细胞凋亡。

图5 坏死性凋亡抑制剂Nec-1和凋亡抑制剂z-VAD-fmk对紫草素诱导的MDA-MB-231细胞增殖和凋亡的影响Figure 5 Effects of necroptosis inhibitor Nec-1 and apoptosis inhibitor z-VAD-fmk on cell proliferation and apoptosis of MDA-MB-231 cells induced by shikonin
2.5 紫草素诱导MDA-MB-231细胞中坏死性凋亡特异性蛋白RIP1表达升高
通过Western blot实验结果发现,当紫草素的使用浓度逐渐增高时,坏死性凋亡关键性蛋白RIP1的表达量随之也逐渐升高(见图6)。同时,当紫草素与Nec-1联用时,RIP1的表达量较单独使用紫草素时降低,差异均具有统计学意义(P<0.001,见图6);z-VAD-fmk与紫草素联用则对RIP1表达无影响(见图6)。

图6 紫草素和凋亡抑制剂对MDA-MB-231细胞中坏死性凋亡相关蛋白的影响Figure 6 Effects of shikonin and apoptosis inhibitors on necroptosis-related protein in MDA-MB-231 cells
3 讨论
三阴性乳腺癌(triple negative breast cancer,TNBC)作为乳腺癌中最具侵袭性的肿瘤类型,因其激素受体和原癌基因均为阴性而不能有效进行内分泌治疗和抗原癌基因治疗,故TNBC的患者预后差、肿瘤转移率和死亡率均明显较高[8]。因此寻找对于TNBC有效的治疗手段尤为重要。2018年研究者发现采用免疫治疗联合化疗的诊治策略在TNBC治疗中有较好的临床效果,研究者们在使用紫杉醇和蒽环类化疗基础上联合PD-L1拮抗剂Durvalumab使得患者缓解率提高10%[9]。PARP抑制剂Olaparib和Talazoparib在TNBC的治疗中同样取得良好效果,使TNBC患者病理完全缓解率约20%[10]。有研究报道紫草素对肝癌[11]、白血病[12]、骨肉瘤[13]、结肠癌[14]、乳腺癌[15,16]等均有抑制作用,因此被认为是极具有研究价值的天然抗肿瘤化合物。但目前较少有紫草素在TNBC中的相关报道。
研究显示,紫草素通过上调Bax表达下调Bcl-2蛋白表达诱导结肠癌细胞发生凋亡[14];Chen等[15]研究中表明,紫草素通过降低PI3K、Akt的表达及其磷酸化水平,同时促进乳腺癌MCF-7细胞发生自噬,抑制细胞活力,多种途径共同发挥抗肿瘤作用;An等[16]研究发现紫草素上调乳腺癌MCF-7细胞中凋亡相关蛋白Caspase-3和Caspase-9的表达,破坏细胞的凋亡调节平衡,诱导细胞发生凋亡。在急性淋巴性白血病中,紫草素能够特异性抑制PKM2生物活性,减少糖酵解的代偿,致使白血病细胞能量供应不足从而抑制其增殖[12]。Zhang等[17]研究中发现紫草素可以诱导鼻咽癌细胞CNE-2Z发生坏死性凋亡,同时伴有ROS的激活,体内实验证明其可以抑制小鼠肿瘤生长。坏死性凋亡(necroptosis)是由受体相互作用蛋白(RIP)介导的,Caspases非依赖性细胞死亡模式,是近年来死亡形式的热门研究之一。坏死性凋亡发生时,RIP1和RIP3两个关键性蛋白结合形成坏死性凋亡复合体necrosome,RIP3的S227自磷酸化并募集MLKL,导致MLKL的T357/S358磷酸化执行坏死性凋亡。该过程可以被小分子物质Necrostatin 1(Nec-1)特异性抑制[18,19]。研究报道坏死性凋亡过程在肿瘤细胞发生发展中被明显抑制,一些新的化合物或天然药物通过不同机制途径诱发坏死性凋亡,达到杀伤抑制肿瘤的作用[20]。绿茶提取物茶多酚[21]被发现可以诱导前列腺癌细胞发生坏死性凋亡,紫草素同样被报道可以作为坏死性凋亡的诱导剂[17]。以上研究结果表明,紫草素可以通过多种不同的途径发挥抗肿瘤作用,但其在三阴性乳腺癌中的具体作用机制尚不明确。
本实验研究中,我们使用不同浓度的紫草素作用于人三阴性乳腺癌细胞MDA-MB-231中,发现随着作用浓度的增加和作用时间的延长,MDA-MB-231细胞的存活率不断降低,细胞形态和细胞核发生明显皱缩。为了探究紫草素在MDA-MB-231中诱导的死亡形式,分别使用Caspase凋亡抑制剂z-VAD-fmk和坏死性凋亡抑制剂Nec-1与紫草素联用48 h,结果发现Nec-1可以有效逆转紫草素的杀伤作用,而z-VAD-fmk对于紫草素在MDA-MB-231中的作用几乎没有影响,因此猜测紫草素诱导MDA-MB-231细胞发生坏死性凋亡而抑制其增殖。为了进一步研究,检测了紫草素作用后坏死性凋亡特异性蛋白RIP1的表达,结果表明随着紫草素浓度的增加,RIP1的表达呈依赖性增加,且Nec-1可以逆转对RIP1的上调作用。
综上所述,紫草素可以抑制人三阴性乳腺癌细胞MDA-MB-231细胞的增殖,其作用机制可能与上调RIP1的表达从而诱导坏死性凋亡过程发生有关,为紫草素用于临床三阴性乳腺癌的治疗提供参考。但本实验只使用了一种人三阴性乳腺癌细胞株且未进行体内实验探究,存在许多不足之处,因此将在接下来的实验研究中继续予以探讨。

