心室辅助装置引发血管性血友病因子损伤的检测方法研究
葛婉宁 钟敏 张柳笛
0 引言
近年来,除心脏移植之外,心室辅助装置(ventricular assist device,VAD)成为临床上治疗心力衰竭的重要手段[1]。但是在VAD使用过程中,由于非生理性剪切应力(non-physiological shear stress,NPSS)造成血液机械损伤,引起一系列临床并发症,主要包括创伤性溶血和血栓的形成[2-4]。经过近几十年对VAD的研发与改进,溶血和血栓问题已经得到重大改善。然而,近年来,VAD在临床使用上的消化道出血问题开始引起越来越多的关注[5],VAD植入1年后的出血发生率可高达65%。一些研究发现,VAD中NPSS对血管性血友病因子(von Willebrand factor,vWF)的机械损伤是引发临床上出血症状的主要因素[6-9]。然而由于血液成分vWF的机械损伤现象发现和研究较晚,至今仍然定义模糊且缺乏相关的评价标准,非常不利于VAD的创新设计与发展。
vWF是一种在正常凝血过程中发挥重要作用的血浆糖蛋白,分子量较大,最小单体片段为500 kDa,高分子量部分可以超过10 000 kDa[10-12]。与vWF相关的评价参数主要包括高分子量血管性血友病因子(high molecular weight von Willebrand factor,HMW-vWF)的减少量、vWF抗原总含量、以及表征vWF抗原活性的vWF瑞斯托霉素辅因子活性和 vWF胶原结合活性[13]。其中HMW-vWF的损伤测试(vWF多聚体分析实验)可以最直观地反映vWF多聚体分子量分布状况,是评价VAD对vWF损伤的首选测试方法。HMW-vWF多聚体是决定vWF功能的重要部分,当血管破裂时,大量血小板会以HMW-vWF为中介,粘附在胶原纤维上形成血栓得以止血。NPSS对于HMW-vWF多聚体的降解,会直接破坏凝血机制,引发凝血功能异常并导致不同程度的出血事件[14-17]。然而,由于vWF分子量较大,没有合适的内参蛋白作为实验参照,也没有相应分子量的蛋白质分子量标准品来对应实验结果。除此之外,vWF多聚体分析实验的操作步骤复杂、影响因素众多、实验成本也较高,目前仅有极少数的实验室可常规检测,所使用设备和方法也不尽相同,给研究VAD中NPSS对于血液成分vWF机械损伤的影响规律造成困难,不利于VAD的创新设计和改进,因此合理设计vWF损伤的评价实验并优化实验方法十分必要。
本文针对VAD对vWF机械损伤这一临床问题,给出在NPSS环境下,血液成分HMW-vWF损伤程度的测试方法,为制定VAD中NPSS对血液成分vWF机械损伤的标准提供参考,使得VAD 领域内对具有临床意义的标准化实验方法形成共识,促进VAD的创新设计和改进。
1 研究方法
首先采用人血作为基础血样,通过将测得的vWF高、中、低分子量的灰度值比值与文献中实际数值做对比,验证实验方法的可行性。然后采用该方法,对经过血泵BPX-80剪切之后的猪血样本进行测试,以研究VAD对血液成分HWM-vWF的损伤情况,验证方法的有效性。其中剪切血样是利用标准化血泵体外检测平台制备的,该平台之前主要用于体外溶血测试,本研究成功将其应用扩展到对于vWF机械损伤的测试中[18]。
1.1 仪器与试剂
实验仪器包括美国Bio-Rad公司的制胶器(1704412,15 cm×10 cm)、电泳槽(Mini-Sub Cell GT,18 cm×40.5 cm×9.4 cm/1 L/3.0 cm)和转印槽(Criterion Blotter,12 cm×16 cm×18 cm/450 mL),以及北京六一仪器厂的双稳定时电泳仪电源(DYY-6C)。
使用试剂包括一抗(polyclonal rabbit anti-human von Willebrand factor,DAKO,美国)、二抗(anti-rabbit IgG HRP-linked antibody,Cell Signaling Technology,美国)、ECL发光液底液(Cell Signaling Technology,美国)、琼脂糖(Sigma-Aldrich,美国)、十二基硫酸钠(SDS,上海阿拉丁生化科技股份有限公司,中国)、10×Tris-乙酸-EDTA电泳缓冲液(TAE,海利克思,美国)、10×TBS缓冲液(海利克思,美国)、Tris-甘氨酸电泳缓冲液(海利克思,美国)、Tris-HCl缓冲液(海利克思,美国)、甘油(安诺伦生物科技有限公司,中国)、溴酚蓝(上海沪试实验室器材股份有限公司,中国)、Tween 20(上海碧云天生物技术有限公司,中国)、无水甲醇(上海沪试实验室器材股份有限公司,中国)、脱脂奶粉(北京索莱宝科技有限公司,中国)、显影液和定影液(上海源叶生物科技有限公司,中国)。
1.2 实验方法及步骤
实验使用免疫印迹法将电泳分离后的vWF分子从凝胶转移到固相载体聚偏氟乙烯膜(PVDF,Immobilon-P)上,然后用特异性抗体检测膜上vWF多聚体的分子量分布情况。整个过程一般需要3 d,主要步骤包括制胶、电泳、转印、免疫反应和显色5部分[19-23]。
1.2.1 测试样品的制备
人血为苏州大学唐仲英血液中心志愿者捐献,猪血从苏州大学动物实验中心取得,取血过程由专业人员进行操作,均已通过苏州大学伦理委员会批准。
为了制备血泵剪切血样,根据ISO和美国材料实验协会(American Socienty of Test Materials,ASTM)标准明确测试血液的选用标准,搭建标准化血泵体外检测平台[24-26]。实验用血采自体温正常、无明显疾病特征的猪,采血时按照 1∶20 的比例加入 0.4% 的肝素溶液抗凝。整个回路包括一根总长为 2 m,内径为 9.5 mm 的聚氯乙烯软管,一个储血袋,一个流量探头,压力传感器,螺旋夹和一台待测试离心式血泵 BPX-80。在血液灌输过程中注意用孔径为 74 μm 的滤网过滤之后通过重力作用灌输到如图1所示的回路中[25]。
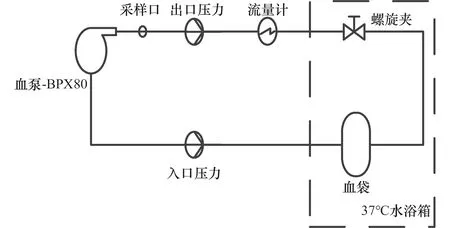
图1 标准化循环回路示意图Figure 1 Schematic diagram of standardized circulation loop
开启血泵,将其调整到待测试的实验条件。其中泵的流量设定为(2±0.25)L/min,压力设定为(110±3)mmHg,循环血液温度为(37±1)℃。测试周期为5 h,在血泵循环5 min 后采集第1个血样,之后每隔1 h 采集1次,共计6个血样。每次采集3 mL血样,将血液样本在4 000 r/min,10 min的参数下两次离心得到待测血浆样本,记录时间和编号,并置于-80℃冰箱保存留用。
1.2.2 制胶
将0.3 g琼脂糖粉末用50 mL电泳缓冲液(40 mmol/L Tris-乙酸,pH 7.8,0.1% SDS,1 mmol/L EDTA)混匀,微波炉中加热至溶液澄清透明,然后将冷却至55℃的琼脂糖溶液从一侧缓慢均匀倒入制胶器,插入梳子,待胶凝固后放入4℃冰箱30 min。
1.2.3 电泳
将解冻后的血浆样本在4℃下14 000 r/min离心15 min,再用上样缓冲液(65.8 mmol/L Tris-HCl,pH 6.8,2.1% SDS,26.3%甘油,0.01%溴酚蓝)按1∶20稀释。每个加样槽上样量为10 μL。将电泳槽置于4℃冰箱中,30 mA恒定电流下运行30 min后提高到50 mA,直到指示剂迁移到另一端,总过程约3.5 h。
1.2.4 转印
从冰箱中取出提前配置好的转印缓冲液(2.5 mmol/L Tris,19.2 mmol/L甘氨酸,20%无水甲醇,0.01% SDS,pH 8.8),将电泳完的胶浸入转印缓冲液中平衡15 min。为了活化 PVDF上面的正电基团,使它更易跟带负电的蛋白质结合,要提前将剪好的PVDF膜用甲醇浸泡1 min,纯水冲洗后浸入转印缓冲液中留用。同时要保证膜上无油脂类物质,以免影响蛋白结合和抗体杂交。在转印缓冲液中浸湿支撑保护PVDF膜和凝胶的黑色海绵和滤纸(美国BIO-RAD公司),按照胶夹安装顺序组装完成,将胶夹放置在转印槽中,PVDF膜的一侧朝向转印槽的阳极,凝胶则朝向转印槽阴极。向槽中添加转印缓冲液至刻度线,置于4℃冰箱中,在70 mA的恒定电流下过夜(运行约15~17 h)。
1.2.5 vWF多聚体的免疫反应
将转印完的PVDF膜浸入40 mL封闭液(5%的脱脂奶粉,0.1% Tween 20,TBS缓冲液)1 h,室温置于摇床上缓慢摇晃。使用0.1% TBS-T(0.1% Tween 20,TBS缓冲液)洗膜5次,先冲洗1次,再置于摇床上洗4次,每次10 min。再分别将一抗、二抗用抗体稀释液(即封闭液)按1∶4 000和1∶2 000稀释,室温下孵育PVDF膜各1 h,0.1% TBS-T洗膜5次,方法同上。最后使用TBS洗液洗膜一次(置于摇床上10 min)以去除Tween的影响。
1.2.6 vWF多聚体的呈像与分析
采用化学发光法(ECL),提前按照说明配制好ECL发光液,保证发光液能够全面覆盖PVDF膜。在工作台上铺一张保鲜膜,倒上ECL发光液,再将PVDF膜倒扣在上面反应1 min。将膜上多余的液体吸干,转移到在X光片夹中用保鲜膜包裹。在暗室红灯下剪裁3张比膜的长和宽均大1 cm的 X光胶片盖在膜上,压紧曝光过夜。
曝光完成后,取出X光片,迅速浸入显影液中显影,待出现明显条带后,即刻终止显影。显影时间一般为1~2 min(20~25℃),温度过低时(低于16℃)需适当延长显影时间。显影结束后,用纯水冲掉X光片上的显影液,迅速浸入定影液中,定影时间一般为5~10 min,以胶片透明为止。在室温下晾干胶片,放置在观片台上用相机拍照或扫描至电脑中。将所得图片导入ImageJ 软件,选中需要分析的样品区域,得到胶片选中区域的图像灰度,该灰度值即与此区域中vWF含量成正比。将每个样品的灰度值与初始样品的灰度值作比较即可得出HMW-vWF的降解程度,从而分析得出在NPSS环境下,血液成分HMW-vWF的机械损伤情况。
2 实验结果
为了确保实验方法的通用性,作者进行了多次重复性实验,本文仅选取了一组具有代表性的图片进行展示。
2.1 健康人血样本测试结果
图2即为所得的健康人血样本vWF分子量分布图像,条带清晰完整且容易区分,从下往上,条带中vWF多聚体的分子量依次升高。参照文献[27]中的vWF多聚体条带-分子量对照图,对图2中的条带进行分区,其中低分子量区域为条带1-2,对应分子量为500~2 500 kDa;高分子量区域为条带8以上,分子量大于5 500 kDa;介于两区域之间的条带3-7为中分子量区域,对应分子量为3 000~5 000 kDa。从图中可以看出,高分子量、中分子量、低分子量区域可以很容易地区分开,便于使用ImageJ软件进行样品之间的定量分析比较。将图像与文献[18,19,28]中健康人血vWF的实际数据进行对比,结果基本一致,证明了该方法的可行性。
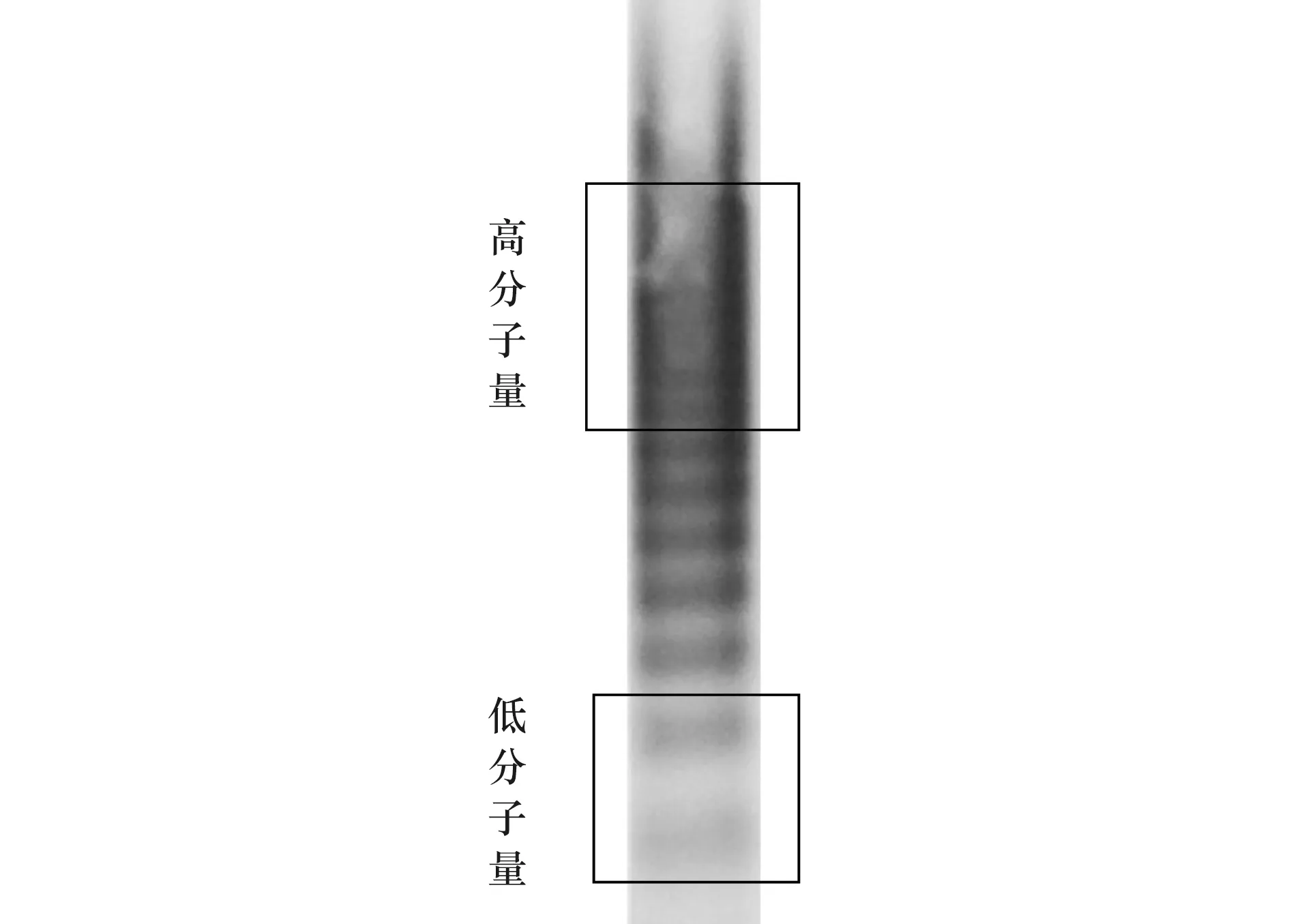
图2 健康人血样本vWF分子量分布Figure 2 Molecular weight distribution of vWF in healthy human blood sample
2.2 机械损伤前后猪血样本测试结果
使用免疫印迹法对经BPX-80血泵剪切前后的样本进行测试,图3中1通道对应BPX-80运行5 min采集的第一个血样,2-6通道分别对应5 h测试周期中,每隔1 h 采样的测试结果,由图中可以看出经血泵剪切之后的样本与健康人血样本一样,条带清晰完整,通过ImageJ软件得出不同通道高分子量区域的灰度值,将1-6通道的灰度值与1通道的灰度值做比较即可得出HMW-vWF的剩余量(图4),分析出在NPSS环境下,血液成分HMW-vWF的机械损伤情况。
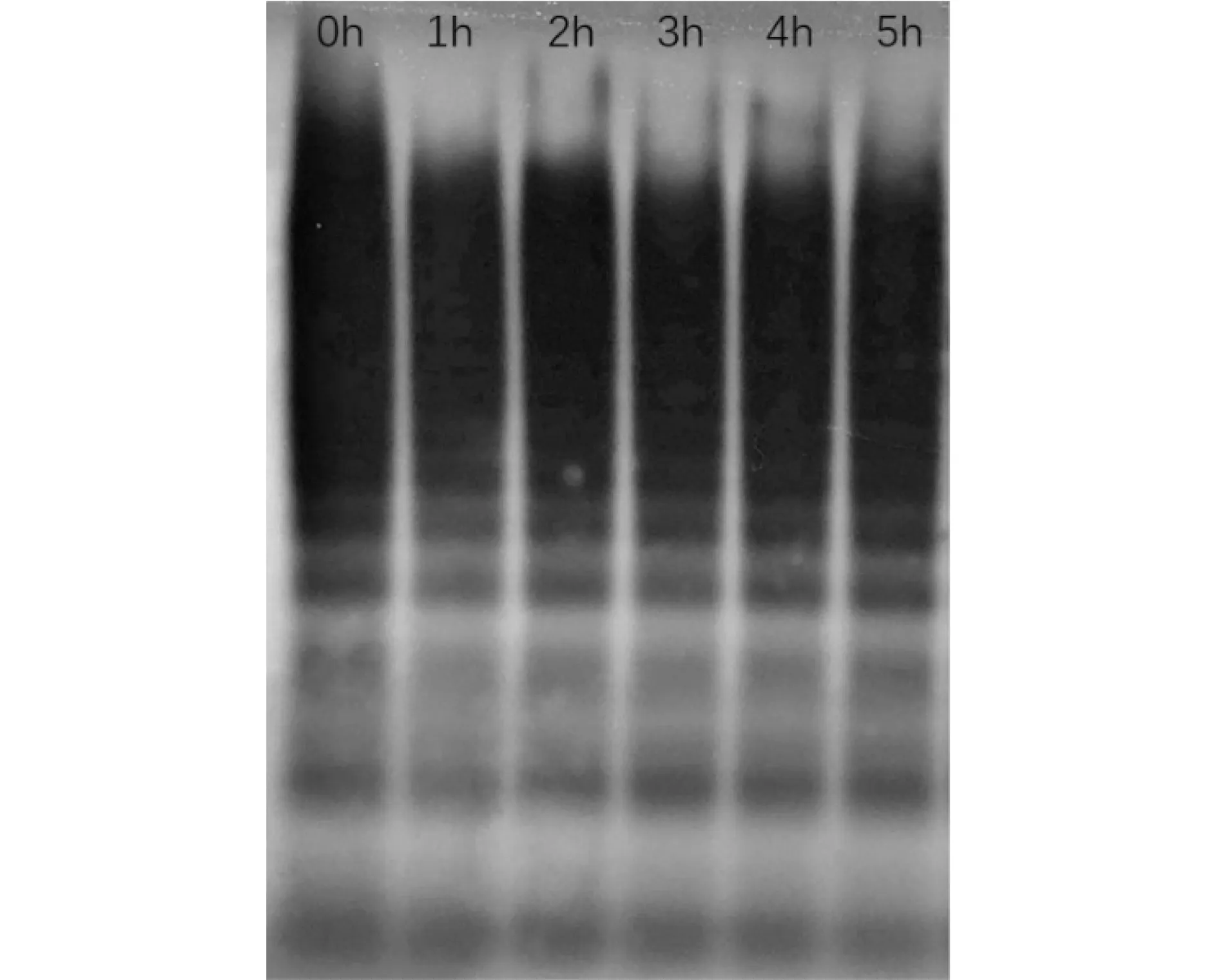
图3 BPX-80剪切血样中vWF多聚体条带分布图Figure 3 Distribution of vWF multimer for BPX-80 sheared
图4中灰度值比值随时间呈下降趋势,这表明在血泵运行期间,高剪切应力会造成血液成分HMW-vWF的降解,使得HMW-vWF被剪切应力破坏成为小分子,失去凝血功能。另外,从图4还可以看出,灰度值比值在初始1 h内下降较多(14%),后续趋于稳定,至实验结束损失量一直维持在20% 左右。该数值的大小代表了HMW-vWF受高剪切应力影响的降解量,可以用来衡量研发中的血泵对vWF的损伤程度,进而评估血泵的性能,保证血泵的有效性和安全性。由于本研究的主要目的是探讨vWF机械损伤测试方法的建立,因此课题组主要关注血泵剪切样品的相对损伤程度,这个方法最直观,后续还会进行vWF活性测定,以和本方法相互验证。
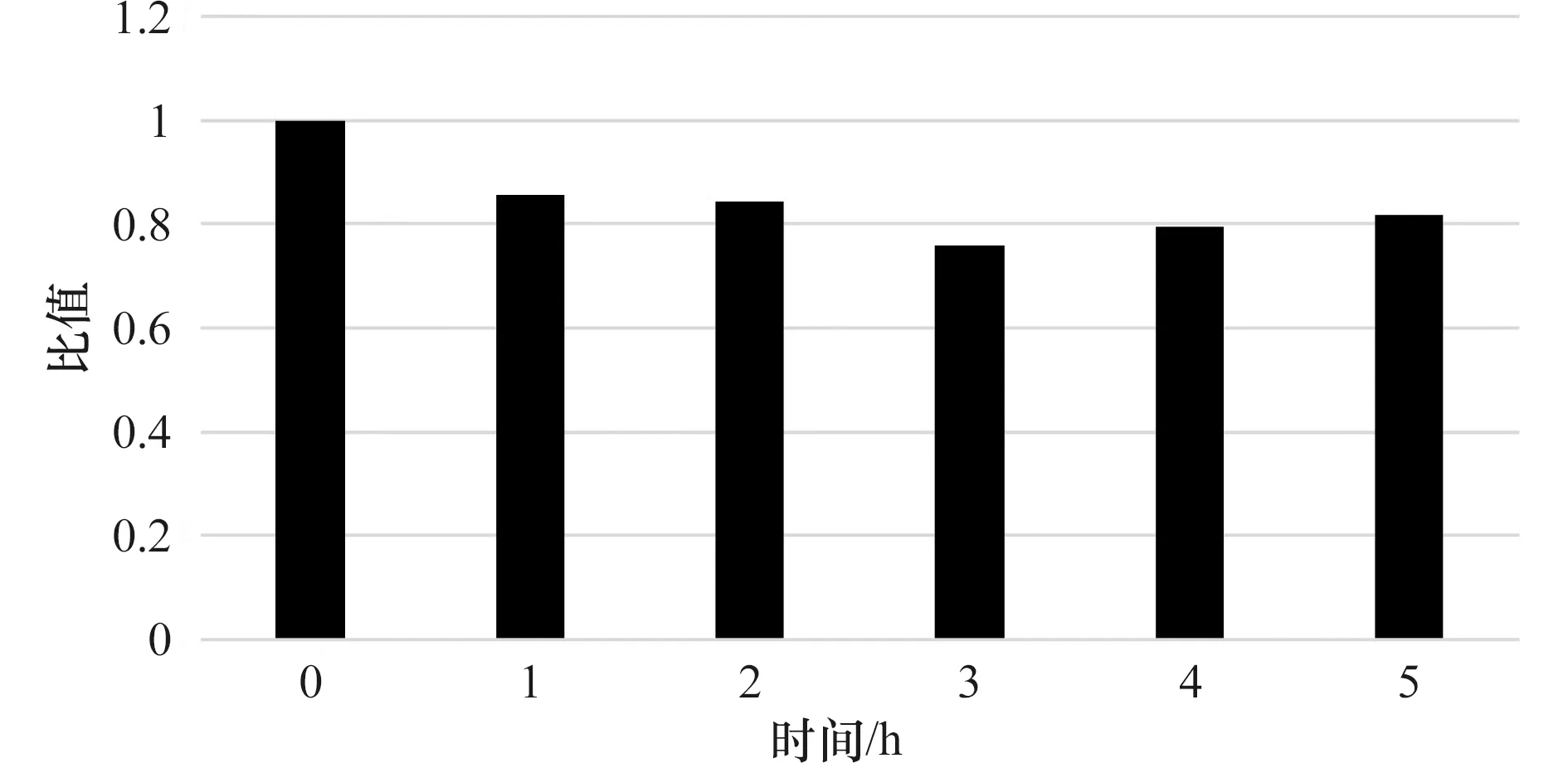
图4 各时间点样品中高分子量vWF与0时刻样品比值Figure 4 The ratio of HMW-vWF at each time point to the initial point
3 讨论
3.1 测试血泵和血样的讨论
3.1.1 测试血泵的讨论
目前,国际上很多新型血泵的研发中,常采用美国Medtronic公司的BPX-80和美国Abbott公司的CentriMag血泵来作为对照泵[23,29]。这两种泵都是技术较为成熟、性能稳定的体外离心泵,其中BPX-80是目前国内唯一能买到的商品化心室辅助装置,因此课题组选用BPX-80进行vWF损伤的研究。
在之前的研究中,BPX-80主要用于ASTM标准化体外溶血实验的对照泵,本研究成功将其应用到对vWF机械损伤的研究中,为后续更多相关实验,如vWF抗原总含量测定、vWF胶原结合活性测定等奠定基础。
3.1.2 测试血样的讨论
在血样的制备过程中,为了确保采样的准确性,需要舍弃采样口附近的2 mL血样。冰冻保存的样本须注意避免反复冻融,反复冻融过程中产生的机械剪切力将对样本中的蛋白质分子产生破坏作用,从而得出假阳性结果。此外,融化样本的混匀过程亦应注意,不要剧烈振荡,反复颠倒混匀即可。
3.2 电泳和转印方案的讨论
电泳是现在用于分离和纯化生物大分子最常用的技术。转印过程是将待测分子转移到固相载体上,在转印胶夹组装过程中,按照胶夹安装顺序:黑色海绵-滤纸-凝胶-PVDF膜-滤纸-黑色海绵,逐层铺在胶夹中,注意赶走气泡。需保证两张滤纸的长、宽分别比胶小,而膜的长、宽分别比胶大,避免上下两层滤纸因为过大而相互接触引起短路,影响转印的完整性。
需要注意的是,在电泳和转印的通电过程中,系统产热使温度升高,如果实验时间很长容易烧胶,因此整个实验通电过程在 4℃ 冰箱中进行。
3.3 vWF多聚体呈像方法的讨论
免疫印迹的检测方法分为荧光检测法和化学发光检测法,而荧光检测法又可分为可见红外检测和近红外荧光检测。其中可见红外检测已经被证实有很高的自发荧光,会降低检测的灵敏度。近红外荧光检测背景较低,可以提高检测的灵敏度,再结合其信号稳定、定量准确、动态范围广等特点,已经成为国内外很多蛋白质研究者的主流选择。化学发光检测法是通过酶标记的抗体和底物发生酶促动力学反应,然后利用暗室压片或者化学发光成像仪进行检测。
在实验探索的过程中,作者尝试使用近红外荧光检测法和化学发光检测法两种方法进行vWF多聚体的呈像对比。其中荧光成像技术采用Odyssey近红外荧光成像系统,依靠Image Studio软件进行数据分析。化学发光成像使用ECL发光液,在暗室中进行压片,根据结果调整曝光时间和曝光区域,得到最佳结果。在整个实验过程中,近红外荧光检测法和化学发光检测法都需要制胶、电泳、转印、封闭和免疫反应这些操作步骤。其差别在于在免疫反应过程中抗体的标记物不同,近红外荧光检测法使用荧光标记抗体,而化学发光检测法则使用酶标记抗体。
通过对比两种检测方法的实验结果,近红外荧光检测法所得到的图像背景较高,条带不清晰,后续分析计算比较困难。另外Odyssey近红外荧光成像设备价格昂贵,后期需要定期维护,并且需要购买特定荧光标记的二抗。而化学发光检测法所得的实验结果达到预期效果,并且该方法受实验条件的限制较少,只要设置一个暗室即可进行,因此在之后的实验过程中课题组没有继续探索完善近红外荧光检测法,而是选用化学发光法来实现vWF多聚体的呈像,如果后续实验需要,课题组将会做进一步的研究。对于没有条件购买红外设备的实验室,建议采用化学发光法,价格低廉的同时完全满足测试分析要求。
4 结论
本研究采用健康人血作为基础血样验证了免疫印迹法检测vWF机械损伤的有效性。基于该方法搭建的检测平台也成功定量检测出了BPX-80血泵剪切对猪血中vWF的损伤情况。该检测方法可用于对VAD的血液相容性评价,对于保证其安全性和有效性具有重要意义。文中明晰了实验方法和操作细节,希望供VAD研发和评价测试人员参考。

