长链非编码RNA通过ceRNA在乳腺癌中的调控机制
翟博雅,龚予希,杨野梵,张 响,张智弘
乳腺癌是全球女性肿瘤死亡的主要原因之一,其发病的分子机制复杂。长链非编码RNA(long non-coding RNA, lncRNA)在很长一段时间内均被认为是一种“转录噪音”,近十年来随着人们对非编码RNA的认知深入,lncRNA在人体内的调控作用才逐渐被重视。研究发现lncRNA、mRNA、环状RNA(circRNA)、假基因等通过竞争性内源性RNA(competing endogenous RNA, ceRNA)机制互相作用,形成ceRNA调控网络,干扰许多因子的表达影响疾病的整体进程。本文现就lncRNA通过ceRNA调控机制在乳腺癌中发挥作用的研究进展进行综述。
1 ceRNA调控机制
ceRNA假说由Salmena等[1]于2011年首次提出,假说以微小核糖核酸(microRNA, miRNA)为核心展开,其中心内容:除了传统的miRNA对mRNA作用之外,还存在RNA调控miRNA作用方式,即RNA分子之间可以双向调控。mRNA、lncRNA、假基因与真基因的基因组序列相似的非功能性DNA拷贝)等在体内并非处于互不干扰的状态,而是可以通过某种特殊的“语言”进行交流。miRNA反应元件(miRNA response elements, MREs)是各种类型RNA上可以被miRNA结合的小片段序列,当mRNA、lncRNA、假基因上有相同的MREs时,它们就能够和同一种miRNA结合,此时这些不同类型的RNA就可以竞争miRNA的结合位点,它们之间互为ceRNA。不同种类的RNA通过MREs这种新的“语言”相互“交流”,形成一张大规模ceRNA调控网络,从而影响癌症发生、物质代谢等一系列的生物活动。作为ceRNA网络的中心,miRNA是一类长度约为22个核苷酸的非编码RNA,其可以与靶基因的互补序列区域结合,从而降低靶基因的稳定性或者限制它们的翻译[2];miRNA通常被认为是活跃的调控元件,当处于调控网络中心的miRNA表达水平变化时,就会对上皮-间质转化(epithelial-mesenchymal transition, EMT)、免疫调节、肿瘤微血管形成、细胞自噬、糖脂代谢、细胞分化等产生影响[3]。此外,该假说认为所有类型的RNA,如lncRNA、mRNA、circRNA、假基因均可以竞争miRNA,因此ceRNA并非是一种RNA类型,而是一种RNA调控机制(图1)。

图1 lncRNA、mRNA、circRNA、假基因均可以结合miRNA,彼此互为ceRNA
2 lncRNA与miRNA的互相作用机制
lncRNA是一类长度大于200 nt的不具有编码蛋白质功能的RNA。lncRNA在细胞内发挥多种生命调控作用,如与转录因子相互作用参与转录调节、影响mRNA功能参与转录后调节及翻译调控、修饰染色体参与表观调节等,从而导致包括肿瘤等多种疾病的发生、发展[4-7]。
lncRNA常常在肿瘤和正常组织中差异表达,导致这种差异表达的因素很多[8-9]。当lncRNA作为ceRNA时,能够与miRNA结合,“占用”其MREs。当体内lncRNA的含量升高时,所结合的miRNA增多,miRNA与下游靶基因的结合位点减少,下游靶基因表达增加;反之,当体内lncRNA表达水平降低时,靶miRNA上的结合位点空出,更多下游靶基因就能够与该miRNA结合,体内能够检测到的下游靶基因含量就会减少。即有相同MREs的两种RNA表达趋势是一致的(图2)。当RNA发挥这种作用时也被称为“分子海绵”作用。值得注意的是,一个miRNA上可以存在多个RNA结合靶点,而一种lncRNA也可以和多种miRNA结合,此时涉及的基因更多,机制更加复杂[10]。ceRNA网络中各因子的合作有助于协调许多生物学过程。若靶基因与lncRNA结合的miRNA或与lncRNA有相同MREs的RNA参与了疾病的发生、发展,那么lncRNA的含量变化就会影响疾病进程。

图2 有共同MREs的RNAs表达趋势一致
3 lncRNA通过ceRNA调控机制在乳腺癌中发挥的作用
WHO针对全球癌症发病情况的报告指出:乳腺肿瘤是导致女性因癌症死亡的常见肿瘤之一[11]。因此,对乳腺癌的病因、发病机制进行研究有着重要的意义。
3.1 ceRNA网络在乳腺癌增殖、侵袭、转移中的作用lncRNA在细胞内具有重要的调控作用,参与了肿瘤增殖、侵袭、转移、迁移等过程[12](图3)。Chi等[13]的研究结果表明,lncRNA SNHG5是乳腺癌中的致癌基因和潜在的乳腺癌预测标志物,其作为miR-154-5p的“分子海绵”,削弱了miR-154-5p对靶基因PCNA的抑制作用,加强乳腺癌细胞的增殖,提示了ceRNA在乳腺癌增殖中的作用。Yang等[14]发现雄激素受体(AR)阳性的三阴型乳腺癌患者预后比AR阴性患者更好,他们发现一种AR阴性诱导的lncRNA ARNILA,计算机预测和荧光素酶报告基因实验均显示ARNILA上存在miR-204的直接结合位点,miR-204能够和参与乳腺癌EMT的Sox4结合,即ARNILA作为ceRNA使miR-204加强Sox4的表达;反之,敲降ARNILA减少了Sox4及其蛋白表达水平。通过间接调控Sox4,ARNILA参与了乳腺癌的EMT过程,并促进了乳腺癌的增殖、侵袭和转移。癌细胞的动态可塑性介导肿瘤的转移性,通过EMT和间质-上皮转化(mesenchymal-epithelial transition, MET),癌细胞可以在上皮和间质两种表型间转化[15-16]。Zhou等[17]构建了小鼠自发转移乳腺癌模型研究lncRNA H19对乳腺癌发生、发展的作用。作者发现H19在转移性乳腺癌中高表达,小鼠GIT2基因是miR-200b/c的靶基因,而miR-200b/c对维持上皮表型有重要作用,作者用计算机分析和双荧光素酶报告基因实验均证实H19与miR-200b/c存在结合位点;当敲降H19后,miR-200b/c的丰度没有改变,但减少了细胞中GIT2的表达。这些结果证实了H19作为ceRNA调控miR-200b/c在细胞中发挥作用。此外,作者还发现H19充当了不止一个ceRNA作用,其同样可以与miRNA let-7结合,与GIT2和CYTH3互为ceRNA,调控癌细胞的EMT,影响乳腺癌的转移。
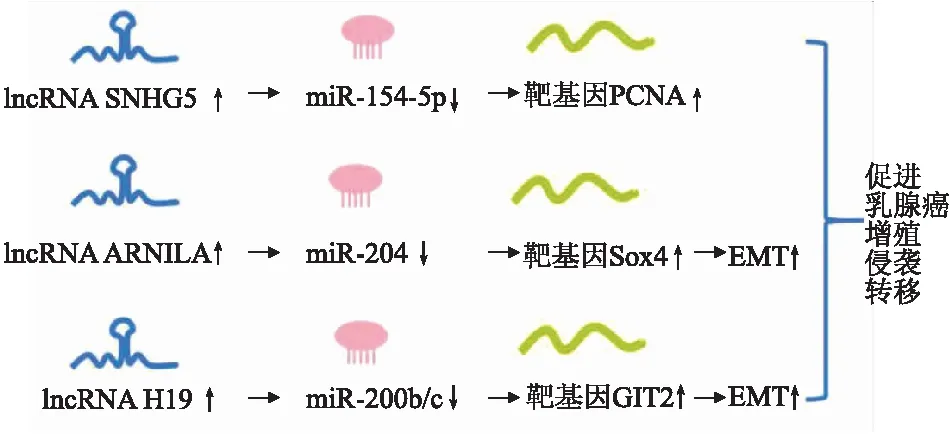
图3 ceRNA网络在乳腺癌增殖、侵袭、转移中的作用
3.2 ceRNA网络在乳腺癌耐药中的作用手术治疗是早期乳腺癌患者的一线治疗方案,对于中晚期患者,药物治疗是必不可少的,但耐药往往是导致患者预后不良的主要原因之一(图4)。Dong等[18]发现,lncRNA TINCR在耐曲妥珠单抗乳腺癌患者中高表达,且与患者预后相关,其与HER-2互为ceRNA,共同竞争miR-125b上的结合位点,沉默miR-125b表达以促进HER-2表达,导致乳腺癌患者对曲妥珠单抗耐药,同时促进癌细胞中EMT;敲降TINCER后miR-125b表达增加,HER-2表达降低。这表明TINCER可以作为miR-125b调节HER-2表达的“分子海绵”。研究还发现mRNA Snail-1同样是miR-125b的下游靶基因,过表达miR-125b显著抑制了乳腺癌细胞中Snail的表达;使用miR-125b抑制剂后结果相反,即在耐曲妥珠单抗过程中,mRNA Snail-1是TINCER/miR-125b的功能性靶点;lncRNA TINCER可能是HER-2阳性患者的潜在治疗靶点。Gu等[19]发现,lncRNA GAS5在HER-2阳性患者和耐他莫昔芬乳腺癌细胞中低表达,其下调会导致患者预后变差。有研究[20-21]发现,miR-222是GAS5的下游靶标,且受GAS5的负向调控。通过竞争性结合miR-222,GAS5上调PTEN表达,而PTEN基因是已知的调控乳腺癌患者对他莫昔芬敏感性的药物。敲降GAS5可以在乳腺癌细胞中下调拉帕替尼诱导抑制的PTEN表达,上调GAS5则可以使之通过分子海绵的作用调控miR-222加强对他莫昔芬等的敏感性。Yao等[22]发现lncRNA NONHSAT101069在乳腺癌组织和细胞中上调,且与miR-129-5p结合,miR-129-5p在乳腺癌组织中比癌旁组织含量更低;敲降NONHSAT101069后miR-129-5p的含量增加。Twist1是miR-129-5p的下游靶蛋白,其是调控EMT的关键因子且促进乳腺癌对表柔比星的耐药、迁移、侵袭。实验结果表明NONHSAT101069/miR-129-5p轴确实可以作用于Twist1,从而加强乳腺癌的耐药。
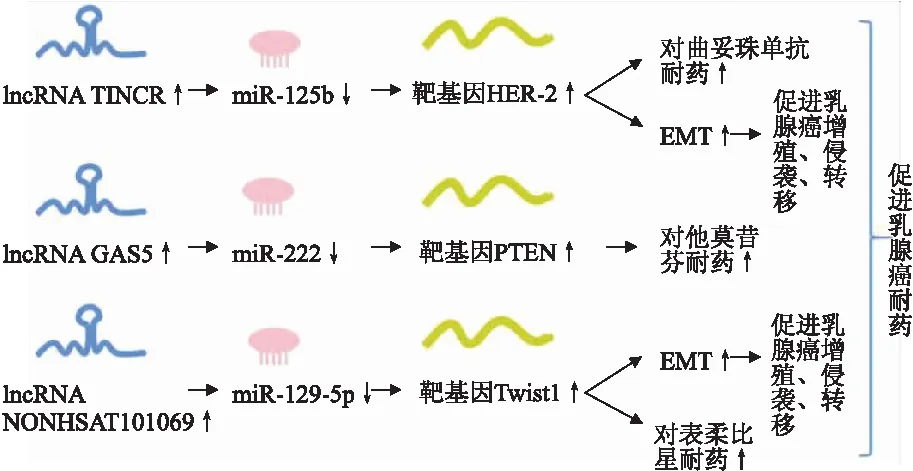
图4 ceRNA网络在乳腺癌耐药中的作用
4 展望
Abdollahzadeh等[23]首次引入了“ceRnome”作为ceRNA研究的一个新术语,描述细胞或组织内所有参与病理生理过程的RNA分子的聚集现象,旨在说明各种分子作为一个整体影响疾病的发生、发展。lncRNA作为“分子海绵”在体内影响了众多因子的表达变化,从而影响了包括肿瘤在内的许多疾病的进展。但lncRNA作为ceRNA网络的意义不仅在此,Olgun等[24]对多名患者的基因表达谱进行数学分析和测试,发现lncRNA在不同亚型乳腺癌中会充当特定的海绵作用,将患者根据特定的ceRNA互相作用机制的表达模式分组,其生存分布差异有显著性;而若仅仅依据参与ceRNA网络的单个RNA表达情况进行分组,结果则无统计学意义。这表明ceRNA网络有助于对乳腺癌进行新分型并进一步阐明各种亚型独特的发病机制,该方法对于其他类型的肿瘤也具有借鉴作用,有广泛的适用性。
虽然有大量实验佐证了ceRNA网络的重要性,但同样不能忽视的是,对于ceRNA网络也存在一些质疑的声音[25]。对于ceRNA假说质疑的主要论点:单个miRNA靶标表达的任何变化都可能仅占靶标位点丰度的小部分,即单个lncRNA表达变化不足以抑制miRNA活性[26-27]。
总之,ceRNA网络作为基因表达调节的可能机制被广泛接受并得到了初步承认,发现新的RNA及其在疾病进程中的作用机制,对于发现新的肿瘤标志物和开发新药物有积极作用,拓展了新的研究领域。随着人们对lncRNA、miRNA、mRNA、假基因等功能的进一步探究,对于ceRNA的认识可能会更加客观和全面。

