有机物芳香性判断方法的探索
秦泽鑫


[摘要]本文提出了一种简易、快速判断有機物分子(或离子)芳香性的方法,并结合实例描述了应用此方法判断有机物芳香性的基本步骤,应用此方法对多种分子(或离子)中芳香性进行解析,所得结论与实际结果相一致,展示了该方法的有效性。
[关键词]有机物;芳香性;休克尔规则
有机物芳香性是学生学习大学有机化学时一个非常重要的知识点,同时也是一个难点。在有机化学中,很少有一个概念像芳香性一样有如此高的引用频率,也很少有类似的概念能引起如此多的争议[1][2]。
“芳香”一词最早是用于形容一些有机物独特的气味,后来随着研究的深入,发现这些有机物具有特殊的稳定性,比如不能进行普通不饱和物的加成反应以及难以被氧化。
目前,通用的教材中均采用休克尔规则(Hükel Rule)来对有机物的芳香性进行判断。该规则虽然是公认的通用规则,但由于需要识记的要点较多及复杂,使学生在应用时很难掌握。所以,寻求一种简单又高效的规则,使学生快速且准确地判断有机物芳香性就显得十分重要。
1 问题的提出
最早发现具有芳香性的有机物是苯,后来随着科学研究不断发展,不仅是苯,还有稠环芳香烃、杂环甚至无机物都可能具有芳香性。由于芳香性判断的重要性,休克尔提出判断芳香性的基本规则:
(1) 离域的p轨道电子云中有4n+2个电子。
(2) 碳环骨架在同一个平面上。
(3) 环上每一个原子都有p轨道,或孤对电子都参与电子云的离域[1][2]。
学生对以上规则均表示出不同程度的困惑,集中在识记麻烦,解题时死板。因此,笔者积极探索芳香性相关知识,提出了一种简单又高效的具体方法,帮助学生解决以上困惑。
2 判断有机物芳香性的新方法
根据笔者长期的研究与实践,提出了以下新方法:
(1) 碳环骨架在同一平面内。
(2) 该有机物环内单双建交替,或者带孤对电子或空轨道的原子交替出现。
(3) 孤对电子作π键看待,空轨道的原子则作去掉该原子看待。
(4) 若π键数目之和为奇数,则该有机物具有芳香性;若为偶数,则该有机物反芳香性。
2.1 应用该方法判断有机物分子的实践
苯是最简单的芳香化合物。在苯中,每个碳原子都是sp2杂化,都有一个垂直于环平面的p轨道,并向其p轨道提供1个电子形成单双键交替的环;该体系总共有3根π键。故而,苯具有芳香性。实践结果与实际相符合。
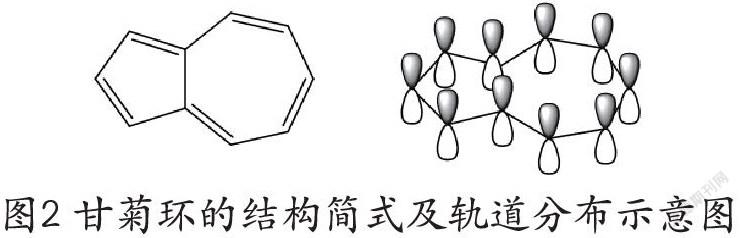
稠环芳香烃因其电子数目多,学生判断起来显得十分吃力,我们可以用以上新方法来进行判断。以甘菊环为例。
在图2中可以看出,甘菊环10个碳原子均为sp2杂化,每个碳原子向p轨道提供1个电子,形成单双键交替的环;甘菊环共有5根π键。甘菊环同样具有芳香性。若用休克尔规则判断,离域p轨道电子云10个电子,符合4n+2个电子要求,具有芳香性。
笔者提出的新方法同样适用于杂环有机物。以大家最为熟知的芳杂环呋喃为例。
按照孤对电子作π键看待,呋喃环中的氧原子存在一对孤对电子,可将其当作π键,做如下变换:
如此,呋喃环中一共有3根π键,具有芳香性。若用休克尔规则判断,呋喃含有6个离域的p轨道电子,符合4n+2个电子的要求,同样成立。
我们来验证反芳香性的有机物,比如二氢哒嗪。在二氢哒嗪中,两个氮原子上的孤对电子与两个C=C π键共同组成具有8个电子的共轭体系。
如上图所示,二氢哒嗪共4根π键,故具有相当明显的反芳香性。休克尔规则判断,因为环内有8个离域p轨道电子,不符合4n+2个电子要求,具有反芳香性。
2.2 应用该方法判断有机物离子的实践
对于以上有机物的讨论是基于电中性的环进行验证的,如果有机物是带有电荷的环,该如何进行判断呢?我们同样进行以下验证。
环戊二烯是一种非常活泼的化合物,表现出一切烯烃的性质,既能形成负离子,也能形成正离子,我们分别验证。
对于环戊二烯负离子,因为带负电荷的碳原子其垂直于环平面的p轨道上有2个电子,相当于带有孤对电子,根据我们的规则,孤对电子按π键处理,则进行如下变换:
变换后,环戊二烯负离子具有3根π键,具有芳香性。若用休克尔规则判断,6个离域p轨道电子,符合4n+2个电子规定,具有芳香性。
杜宇环戊二烯正离子,带有正电荷的碳原子其垂直于环平面的p轨道上没有电子,只剩下空轨道,按我们的规则,空轨道的原子作舍去处理,进行如下变换:
变换后,环戊二烯正离子变成了环丁二烯,虽然共轭,但因为仅有2根π键,具有反芳香性。若用休克尔规则判断,认为其没有符合共轭体系,无法判断。综合实验结果[1][2],证明其有反芳香性。所以,新规则可以弥补休克尔规则的不足,更加全面判断。
3 结果与讨论
3.1 与休克尔规则进行对比
笔者的方法实际上是将休克尔规则进行来简化与补充。
简化主要体现在,休克尔规则提出”离域电子总数要达到4n+2”才具有芳香性,笔者认为,离域电子在芳香环中就是单双键交替的共轭体系,而4n+2=2(2n+1),每2个离域电子成1根π键,2n+1则为奇数。所以,就是转化为“单双键交替的环中,π键数目之和为奇数”,这对于学生来说是简单易懂的。
创新则体现在,休克尔规则对于有机物阳离子是无法判断的,而笔者根据大量的实践与归纳,发现可将带电荷的原子作舍去处理来观察,突破了休克尔规则的局限性。
3.2 教学效果
为了验证教学效果,笔者将学生随机分成2个小组,每组30人。甲组学生只学习了休克尔规则,乙组学生只学习了新规则,使用以下习题作为测评,统计学生正确率及用时。
判断以下有机物分子或离子为芳香性、反芳香性或无芳香性:
得到成绩样本如下:
通过对比发现,乙组同学总体准确率好于甲组同学,且用时更短。甲组同学反映准确率较低的几题,均是有机物阳离子,使用休克尔规则判断出现了困难。可见,休克尔规则对于学生来说不够浅显与简单,使用时不流畅。
4 小结
针对学生学习有机化学教材中判断有机物芳香性感觉困难的问题,笔者根据多年的教学经验,结合自己对休克尔规则的理解,对休克尔规则进行简化与补充,该新规则使学生又快又准判断有机物分子或离子芳香性,而且能培养学生学习的兴趣,提高分析问题的能力。
参考文献
[1]邢其毅,裴伟伟,裴坚 基础有机化学 [M].4版。北京:北京大学出版社,2016.
[2] Jonathan Clayden,Nick Greeves,Stuart Warren.Organic Chemitstry[M].Oxford Press,2012.FBA5E94B-0A6C-4BEA-A5E4-34CA7A726EE3

